高一化学必修一化学方程式总结
1、钠及其化合物的转化关系

①Na2O+2HCl=2NaCl+H2O ②2Na+2HCl=2NaCl+H2↑
Na2O+2H+=2Na++H2O 2Na+2H+=2Na++H2↑
③2Na2O2+4HCl=4NaCl+O2↑+2H2O ④4Na+O2=2Na2O
 2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑
2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑
※⑤2Na+O2 Na2O2 2Na+2H2O=2Na++2OH-+H2↑
Na2O2 2Na+2H2O=2Na++2OH-+H2↑
⑦Na2O+H2O=2NaOH ※⑧2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2Na++2OH- 2Na2O2+2H2O=4Na++4OH-+O2↑
⑨Na2O+CO2=Na2CO3 ※⑩2Na2O2+2CO2=2Na2CO3+O2
⑾2NaOH+CO2=Na2CO3+H2O ⑿Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
2OH-+CO2=CO32-+H2O CO32-+Ca2+=CaCO3↓
⒀NaOH+CO2=NaHCO3 ※⒁Na2CO3+H2O+CO2=2NaHCO3
OH-+CO2=HCO3- CO32-+H2O+CO2=2HCO3-
※⒂2NaHCO3 Na2CO3+H2O+CO2↑或 ※NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+H2O+CO2↑或 ※NaHCO3+NaOH=Na2CO3+H2O
HCO3-+OH-=CO32-+H2O
⒃Na2CO3+2HCl=2NaCl+H2O+CO2↑ ⒄NaHCO3+HCl=NaCl+H2O+CO2↑
CO32-+2H+=H2O+CO2↑ HCO3-+H+=H2O+CO2↑
补充:①石灰水中加入少量NaHCO3 : Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
Ca2++OH-+HCO3-=CaCO3↓+H2O
②石灰水中加入过量NaHCO3 : Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
2、铝及其化合物的转化关系

①2Al+6HCl=2AlCl3+3H2↑ ②4Al+3O2 2Al2O3
2Al2O3
2Al+6H+=2Al3++3H2↑
※③2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ④Al2O3+6HCl=2AlCl3+3H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+6H+=2Al3++3H2O
※⑤Al2O3+2NaOH=2NaAlO2+H2O ⑥AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
Al2O3+2OH-=2AlO2-+H2O Al3++3NH3·H2O = Al(OH)3↓+3NH4+
⑦Al(OH)3+3HCl=AlCl3+3H2O ⑧2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
Al(OH)3+3H+=Al3++3H2O
☆⑨NaAlO2+HCl+H2O =Al(OH)3↓+NaCl或NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3
AlO2-+H++H2O=Al(OH)3↓ AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
※⑩Al(OH)3+NaOH = NaAlO2+2H2O ☆⑾Al3++3H2O Al(OH)3胶体+3H+
Al(OH)3胶体+3H+
Al(OH)3+OH-= AlO2-+2H2O 明矾净水
⑿AlCl3+4NaOH = NaAlO2+3NaCl+2H2O Al3++4OH-= AlO2-+2H2O
3、铁及其化合物的转化关系
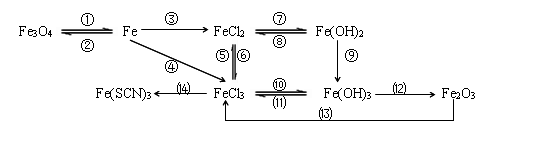
 ①Fe3O4+4CO
①Fe3O4+4CO 3Fe+4CO2 ※② 3Fe+4H2O(g)
3Fe+4CO2 ※② 3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
 ③ Fe+2HCl=FeCl2+H2↑ 或3Fe+2O2
③ Fe+2HCl=FeCl2+H2↑ 或3Fe+2O2 Fe3O4
Fe3O4
Fe+2H+=Fe2++H2↑ ④2Fe+3Cl2 2FeCl3
2FeCl3
※⑤2FeCl2+Cl2 = 2FeCl3 ※⑥Fe+2FeCl3 = 3FeCl2
2Fe2++Cl2 = 2Fe3++2Cl- Fe+2Fe3+= 3Fe2+
⑦FeCl2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl2+2H2O
Fe2++2OH-= Fe(OH)2↓ Fe(OH)2+2H+= Fe2++2H2O
※⑨4Fe(OH)2+O2+2H2O = 4Fe(OH)3 ⑩FeCl3+3NaOH = Fe(OH)3↓+3NaCl
白色沉淀迅速变成灰绿色,最后变成红褐色 Fe3++3OH-= Fe(OH)3↓
⑾Fe(OH)3+3HCl = FeCl3+3H2O Fe3++3H2O Fe(OH)3胶体+3H+(净水)
Fe(OH)3胶体+3H+(净水)
Fe(OH)3+3H+= Fe3++3H2O ⑿2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
⒀Fe2O3+6HCl = 2FeCl3+3H2O ※⒁FeCl3+3KSCN = Fe(SCN)3+3KCl
Fe2O3+6H+= 2Fe3++3H2O Fe3++3SCN-= Fe(SCN)3
4、硅及其化合物的转化关系
 ①Si+O2
①Si+O2 SiO2
SiO2
②SiO2+2C Si+2CO↑
Si+2CO↑
※③SiO2+4HF = SiF4↑+2H2O(刻蚀玻璃)
④Si+4HF = SiF4↑+2H2↑
 ⑤SiO2+CaO
⑤SiO2+CaO CaSiO3
CaSiO3
※ ⑥SiO2+2NaOH = Na2SiO3+H2O SiO2+CaCO3
⑥SiO2+2NaOH = Na2SiO3+H2O SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
SiO2+2OH-= SiO32-+H2O ※⑦Na2SiO3+2HCl = H2SiO3↓+2NaCl
 SiO2+Na2CO3
SiO2+Na2CO3 Na2SiO3+CO2↑ SiO32-+2H+= H2SiO3↓
Na2SiO3+CO2↑ SiO32-+2H+= H2SiO3↓
※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3
SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
⑧H2SiO3+2NaOH = Na2SiO3+2H2O ⑨H2SiO3 H2O+SiO2
H2O+SiO2
H2SiO3+2OH-= SiO32-+2H2O
5、氯及其化合物的转化关系
 ①2Fe+3Cl2
①2Fe+3Cl2 2FeCl3
2FeCl3
②Cu+Cl2 CuCl2
CuCl2
③2FeCl3+Cu = 2FeCl2+CuCl2
2Fe3++Cu = 2Fe2++Cu2+
 ④H2+Cl2 2HCl
④H2+Cl2 2HCl
※⑤MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 MnO2+4H++2Cl-
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
 ※⑥Cl2+H2O = HCl+HClO ※⑦2HClO 2HCl+O2↑
※⑥Cl2+H2O = HCl+HClO ※⑦2HClO 2HCl+O2↑
Cl2+H2O = H++Cl-+HClO 2HClO 2H++2Cl-+O2↑
※⑧Cl2+2NaOH = NaCl+NaClO+H2O ※⑨2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
Cl2+2OH-= Cl-+ClO-+H2O 工业制漂白粉
※⑩Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO或Ca(ClO)2+2HCl = CaCl2+2HClO
Ca2++2ClO-+H2O+CO2= CaCO3↓+2HClO或ClO-+H+= HClO
漂白粉的漂白原理
向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO
ClO-+H2O+CO2 = HCO3-+HClO
6、硫及其化合物的转化关系
 ①S+O2
①S+O2 SO2
SO2
②2H2S+SO2=3S+2H2O
※③SO2+O2 2SO3
2SO3
④SO3+H2O = H2SO4
 ⑤SO2+CaO
⑤SO2+CaO CaSO3 或 SO2+Ca(OH)2 = CaSO3↓+H2O
CaSO3 或 SO2+Ca(OH)2 = CaSO3↓+H2O
 ⑥SO3+CaO = CaSO4 SO2+Ca2++2OH-=CaSO3↓+H2O
⑥SO3+CaO = CaSO4 SO2+Ca2++2OH-=CaSO3↓+H2O
SO3+Ca(OH)2 = CaSO4+H2O ⑦2CaSO3+O2 2CaSO4
2CaSO4
※⑧SO2+Cl2+2H2O = H2SO4+2HCl ※⑨Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
SO2+Cl2+2H2O = 4H++SO42-+2Cl- Cu+2H2SO4(浓) Cu2++SO42-+SO2↑+2H2O
Cu2++SO42-+SO2↑+2H2O
※⑩C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
7、氮及其化合物的转化关系
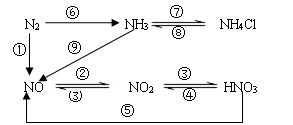
 ※①N2+O2 2NO
※①N2+O2 2NO
※②2NO+O2 = 2NO2
※③3NO2+H2O = 2HNO3+NO
3NO2+H2O =2H++2NO3-+NO
以上三个反应为“雷雨发庄稼”原理
扩展反应有:4NO2+O2+2H2O = 4HNO3
4NO+3O2+2H2O = 4HNO3
※④Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O 上面两个反应主要用于气体溶于水时的计算
 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 或 4HNO3 4NO2↑+ O2↑+ 2H2O
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 或 4HNO3 4NO2↑+ O2↑+ 2H2O
C+4HNO3(浓) CO2↑+2NO2↑+2H2O 浓硝酸见光易变黄的原因
CO2↑+2NO2↑+2H2O 浓硝酸见光易变黄的原因
※⑤3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O ⑥N2+3H2 2NH3
2NH3
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 合成氨反应是人工固氮的主要途径
⑦NH3+HCl = NH4Cl ⑧NH4Cl  NH3↑+HCl↑
NH3↑+HCl↑
NH3+H+ = NH4+(水溶液中) 补充:NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐
(如浓HCl、浓HNO3)相遇时空气中有白烟 都分解出氨气,如NH4NO3、(NH4)2SO4
※⑧NH4Cl+NaOH  NaCl+NH3↑+H2O NH4++OH-
NaCl+NH3↑+H2O NH4++OH- NH3↑+H2O
NH3↑+H2O
所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
※⑧⑶2NH4Cl+2Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
实验室制氨气,此反应为固体反应,不能写成离子方程式。
☆⑨4NH3+5O2 4NO+6H2O 氨的催化氧化反应,工业制硝酸的第一步。
4NO+6H2O 氨的催化氧化反应,工业制硝酸的第一步。
注:带“※”的反应为重要反应,必须熟记;带“☆”的反应只需了解。
有机化学方程式汇总

第二篇:高二选修5化学方程式总汇.
高二化学选修5化学方程式汇总
(知识点总结)
【编辑】Mr Liao 【日期】20xx-6
1、甲烷 烷烃通式:CnH2n+2 ☆☆ (1)结构:分子式:CH4 结构式:
(2)电子式
(3)空间构形:正四面体
(4
(5)饱和烃,化学性质稳定,光照下能发生取代反应,不能使溴的CCl4溶液或酸性KMnO4
H2)。
?CH3Cl+HCl CH3Cl+Cl2???? CH2Cl2+ HCl 取代反应: CH4+Cl2???
? CHCl3+ HCl CHCl3+Cl2???? CCl4+ HCl CH2Cl2+Cl2???
2、乙烯 烯烃通式:CnH2n ☆☆☆☆
(1)结构:乙烯分子式:C
4 结构简式:CH2=CH2 (
2)化学性质:
光照
光照
光照光照
?2CO2+2H2O ①可燃性:C2H4+3O2???
②加成、加聚反应,都能使溴的CCl4溶液或酸性KMnO4溶液褪色。
点燃
??CH3CH2OH CH2=CH2+Br2→CH2BrCH2Br 加成反应 CH2=CH2+H2O??
加聚反应
(3)用途:①石油化工基础原料 (乙烯的产量是衡量一个国家石油化学工业的重要标志);
②植物生长调节剂、催熟剂。
3、乙炔 炔烃的通式:CnH2n-2 ☆☆☆☆
(1)结构:乙炔分子式:C
CH ≡ CH
(2)化学性质:
催化剂
?4CO2+2H2O ①可燃性:2C2H2+5O2???
乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。 ②实验室制乙炔
CaC2+2H2
Ca(OH)2+C2H2↑
③加成、加聚反应
点燃
图1 乙炔的制取
加成反应 CH ≡ CH+Br
CHBr = CHBr+Br
2CHBr2
加聚反应
乙炔加聚,得到聚乙炔:n HC? n
4、苯 ☆☆☆☆
(1)结构:没有真正意义上的双键,而是介于单键和双键之间的一种独特的键。
(2)化学性质:“难氧化、易取代、难加成”。 性质稳定,不能酸性KMnO溶液褪色。 氧化反应
点燃
苯的燃烧:2C6H6+15O22+6H2O
取代反应
①苯与液溴反应(需铁作催化剂):(取代反应)
②苯的硝化反应:(取代反应)
催化剂 △
苯硝化反应生成硝基苯,它是一种带有苦杏仁味、无色油状液体,有毒。 加成反应 苯与氢气加成+3H2
苯还可以和氯气在紫外光照射下发生加成反应,生成C6H6Cl6(剧毒农药)。 ...
5、甲苯 苯的同系物通式:CnH2n-6 ☆☆☆ (1)氧化反应
点燃
甲苯的燃烧:C+9O+4H (2)取代反应
CH3 3 CH浓硫酸 N— NO2 2
+3H2O +3HNO3△
NO2
甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT), 是一种淡黄色晶体,不溶于水。它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。 (3)加成反应 CH3
+3HCH3
6、溴乙烷 ☆☆☆☆
纯净的溴乙烷是无色液体,沸点38.4℃,密度比水大。 (1)取代反应
水
溴乙烷的水解:C2H5Br+C2H5—OH+NaBr
△
(2)消去反应
醇
溴乙烷与NaOH溶液反应:CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
△
7、乙醇 ☆☆☆☆ (1)与钠反应
2CH3CH2OH+2CH3CH2ONa+H2↑(乙醇钠)
(2)氧化反应
Cu或乙醇的燃烧:2CH3CH2OH+O2 3CHO+2H2O
△
乙醇在常温下的氧化反应
酸性KMnO4或酸性重铬酸钾溶液??????????CHCHCHOH
3
2
3
(3)消去反应
乙醇在浓硫酸做催化剂的条件下,加热到170℃生成乙烯。
浓硫酸
CH3CH2OH CH2=CH2↑+H2O
170℃
注意:该反应加热到140℃
浓硫酸
2C2H5
2H5—O—C2H5+H2O (乙醚)
140℃
8、苯酚
☆☆☆☆ 图2乙烯的制取 苯酚是无色晶体,露置在空气中会因氧化显粉红色。苯酚具有特殊的气味,熔点 43℃,水中溶解度不大,易溶于有机溶剂。苯酚有毒,是一种重要的化工原料。 (1)苯酚的酸性
ONa OH +H2O
(苯酚钠)
苯酚(俗称石炭酸)的电离: -
OH O +
+H2O +H3O
苯酚钠与CO2反应:
ONa OH
+CO2+H2 +NaHCO3
苯酚钠与HCl反应:
ONa +HCl OH +NaHCO3
(2)取代反应 OH
OH Br +3Br2 Br ↓+3HBr
(三溴苯酚)
Br
(3)显色反应
苯酚能和FeCl3溶液反应,使溶液呈紫色。
9、乙醛 ☆☆☆☆
乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
O (1)加成反应 || 催化剂
乙醛与氢气反应:CH3—C—H+H2 CH3CH2OH
△
O (2)氧化反应 || 催化剂
乙醛与氧气反应:2CH3—C—H+O2 3COOH(乙酸)
△
乙醛的银镜反应:
△
CH3CHO +2Ag(NH3)2CH3COONH4+2Ag+3NH3+H2O
(乙酸铵)
注意:硝酸银与氨水配制而成的银氨溶液中含有Ag(NH3)2OH(氢氧化二氨合银), 这是一种弱氧化剂,可以氧化乙醛,生成Ag。
有关制备的方程式: ++Ag+NH3·H2O===AgOH↓+ NH4
+-
AgOH+2NH3·H2O===[Ag(NH3)2]+OH+2H2O △
乙醛还原氢氧化铜:CH3CHO+2Cu(OH) CH3COOH+Cu2O+2H2O 10、乙酸 ☆☆☆ (1)乙酸的酸性
-+
乙酸的电离:CH3COOHCH3COO+H (2)酯化反应
O || 浓硫酸
CH3—C—OH+C2H5—OH CH3—C—OC2H5+H2O
△ (乙酸乙酯)
注意:酸和醇起作用,生成酯和水的反应叫做酯化反应。 11、乙酸乙酯 ☆☆☆
乙酸乙酯是一种带有香味的无色油状液体。 (1)水解反应
稀硫酸
CH3COOC2H5+H2O CH3COOH+C2H5OH
△
(2)中和反应
CH3COOC2H5+3COONa+C2H5OH
附加:烃的衍生物的转化
