高中化学必修1化学方程式总结
一、钠及其化合物的转化关系
1.钠在空气中燃烧:2Na+O2 Na2O2
Na2O2
2.钠在氧气中燃烧:4Na+O2 2Na2O
2Na2O
3.钠与水反应:2Na+2H2O=2NaOH+H2↑
4.氧化钠与水反应:Na2O+H2O=2NaOH
5.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑
6.氧化钠与盐酸反应:Na2O+2HCl=2NaCl+H2O
7.钠与盐酸反应:2Na+2HCl=2NaCl+H2↑
8.氧化钠与二氧化碳反应:Na2O+CO2=Na2CO3
9.过氧化钠与二氧化碳反应:
2Na2O2+2CO2=2Na2CO3+O2
10.电解氯化钠(工业制钠):2NaCl 2Na+Cl2↑
2Na+Cl2↑
11.碳酸钠与水和二氧化碳反应:
Na2CO3+H2O+CO2=2NaHCO3
12.碳酸氢钠遇热分解:
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
13.碳酸氢钠与氢氧化钠反应:
NaHCO3+NaOH=Na2CO3+H2O
…… …… 余下全文

 2Cu + CO2↑
2Cu + CO2↑ 2MgO + C
2MgO + C Na2O2
Na2O2 2Na2O2
2Na2O2 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl 2Cu+CO2↑
2Cu+CO2↑  Na2O2(淡黄色固体)
Na2O2(淡黄色固体) 2Na2O2
2Na2O2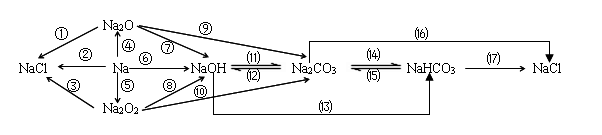
 2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑
2Na2O2+4H+=4Na++O2↑+2H2O ※⑥2Na+2H2O=2NaOH+H2↑ Na2O2 2Na+2H2O=2Na++2OH-+H2↑
Na2O2 2Na+2H2O=2Na++2OH-+H2↑ Na2O2
Na2O2  2Na+Cl2↑
2Na+Cl2↑ Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑