高一化学方程式总结
一.钠:
(1).Na在空气中与O2:4Na + O2 = 2Na2O(白色)
(2).Na在O2中燃烧:2Na + O2 Na2O2(淡黄色)
Na2O2(淡黄色)
(3).Na与S:2Na + S = Na2S(研磨即爆炸)
(4).Na与Cl2:2Na + Cl2 2NaCl
2NaCl
(5).Na与H2O:2Na + 2H2O = 2NaOH + H2↑ (2Na + 2H2O
= 2Na+ + 2OH- + H2↑)
(6).Na与HCl:2Na + 2HCl = 2NaCl + H2↑ (2Na + 2H+
=2Na+ + H2↑ )
(7).Na与CuSO4溶液:2Na + 2H2O + CuSO4 = Na2SO4+
Cu(OH)2↓ + H2↑
(8).Na与FeCl3溶液:6Na + 6H2O + 2FeCl3 = 6NaCl +
2Fe(OH)3↓ + 3H2↑
(9).Na2O与H2O:Na2O + H2O = 2NaOH
(10).Na2O与CO2:Na2O + CO2= Na2CO3
(11).Na2O2与H2O:2Na2O2 + 2H2O = 4NaOH + O2↑
(2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑)
(12).Na2O2与CO2:2Na2O2 + 2CO2 = 2Na2CO3 + O2(供
氧)
(13).Na2CO3与HCl:Na2CO3 +2HCl = 2NaCl + H2O +
CO2↑(互滴鉴别)(CO32- + 2H+ = H2O + CO2↑)
(14).NaHCO3与HCl:NaHCO3 + HCl = NaCl + H2O + CO2
↑( HCO3- + H+ = H2O + CO2↑)
(15).NaHCO3与NaOH:NaHCO3 +NaOH=Na2CO3 + H2O
(HCO3- + OH- = CO32- + H2O)
(16).Na2CO3与 H2O 与 CO2:Na2CO3 + H2O + CO2 =
2NaHCO3(鉴别、除杂)(CO32- + H2O + CO2 = 2HCO3- )
(17).NaHCO3分解:2NaHCO3 Na2CO3+H2O+ CO2↑
Na2CO3+H2O+ CO2↑
(18).NaOH与 CO2 (少量):2NaOH + CO2 (少量) = Na2CO3
+ H2O ( 2OH-+ CO2 (少量) = CO32- + H2O)
(19).NaOH 与 CO2(过量):NaOH + CO2(过量)= NaHCO3
(OH -+ CO2(过量)= HCO3-)
二.铝:
(1).Al与6HCl:2Al+6HCl=2AlCl3+3H2↑(同H2SO4)
(2Al+6H+ =2Al3+ + 3H2↑ )
(2).Al 与 NaOH 与 H2O:2Al + 2NaOH + 2H2O = 2
NaAlO2 + 3H2↑(2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑)
(3).Al2O3与 HCl: Al2O3 + 6HCl = 2AlCl3 + 3H2O
(Al2O3 + 6H+ =2Al3+ + 3H2O)
(4).Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O
(Al2O3 + 2OH- = 2AlO2- + H2O )
(5).Al(OH)3与HCl:Al(OH)3 + 3HCl = AlCl3 + 3H2O
(Al(OH)3 + 3H+ = Al3+ + 3H2O)
(6).Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O
(Al(OH)3 + OH- = AlO2- + 2H2O)
(7).2Al(OH)3 Al2O3 + 3H2O
Al2O3 + 3H2O
(8).AlCl3与NH3·H2O:AlCl3 + 3NH3·H2O = Al(OH)3↓ +
3NH4Cl (Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+)
(9).NaAlO2与HCl与H2O:
NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ (AlO2- + H+ +
H2O = Al(OH)3↓ )
(10).NaAlO2 与CO2(少量)与H2O:2NaAlO2 + CO2(少
量)+3H2O=2Al(OH)3↓+Na2CO3
(12).AlO2- + CO2(少量)+ 3H2O = 2Al(OH)3↓ + CO32- )
(11).NaAlO2与 CO2(过量)与2H2O:NaAlO2+CO2(过
量)+2H2O=Al(OH)3↓+NaHCO3
(AlO2- + CO2(过量) + 2H2O = Al(OH)3↓ + HCO3-)
(12).Al 与O2 :4Al + 3O2 = 2Al2O3
三.铁:
(1).Fe与O2:3Fe+2O2 Fe3O4
Fe3O4
(2).Al2O3电解:2Al2O3 4Al+3O2↑
4Al+3O2↑
(3).Fe与H2O(g)高温:3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(4).FeCl3 + Fe :2FeCl3 + Fe = 3FeCl2 (2Fe3+ + Fe = 3Fe2+)
(5).FeCl2+Cl2:2FeCl2+Cl2=2FeCl3( 2Fe2+ + Cl2 = 2Fe3+
+2Cl-)
(6).FeCl3与 Cu:2FeCl3 + Cu = 2FeCl2 + CuCl2(用于雕刻
铜线路板) (2Fe3+ + Cu = 2Fe2++ Cu2+ )
(7).FeO与HCl:FeO+ 2HCl = FeCl2 + H2O(同H2SO4)
( FeO+2H+ = Fe2+ +H2O )
(8).Fe2O3 与HCl :Fe2O3 + 6HCl = 2FeCl3 + 3H2O(同
H2SO4) ( Fe2O3 + 6H+ =2Fe3+ + 3H2O)
(9).Fe3O4 与HCl:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 +4H2O
(同H2SO4) (Fe3O4 + 8H+ = Fe2+ +2Fe3+ +4H2O)
(10).FeSO4与NaOH:FeSO4 + 2NaOH=Fe(OH)2↓ +
Na2SO4 ( Fe2+ + 2OH-=Fe(OH)2↓)
(11).FeCl3与NaOH:FeCl3 + 3NaOH=Fe(OH)3 ↓+ 3NaCl
(Fe3+ + 3OH-=Fe(OH)3 ↓)
(12).Fe(OH)2 与H2O 与 O2:4Fe(OH)2 + 2H2O + O2 =
4Fe(OH)3 (白色沉淀→灰绿色沉淀→红褐色沉淀)
(13).Fe(OH)2与HCl.Fe(OH)2+2HCl==FeCl2+2H2O
(Fe(OH)2 + 2H+=Fe2+ + 2H2O)
(14).Fe(OH)3与HCl:Fe(OH)3+3HCl==FeCl3+3H2O
(Fe(OH)3 + 3H+ = Fe3+ + 3H2O)
(15).Fe(OH)3加热:2Fe(OH)3 Fe2O3 + 3H2O
Fe2O3 + 3H2O
(16).FeCl3与KSCN:FeCl3+3KSCN==Fe(SCN)3+3KCl
(Fe3++ 3SCN- = Fe(SCN)3) (红色溶液,用于鉴别Fe3+)
(17).FeCl3与H2S(少量):2FeCl3 + H2S(少量) = 2FeCl2 + 2HCl + S↓
(18).FeCl3与KI:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2↓
(19).FeCl3与H2O: FeCl3+3H2O  Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
(20).C与H2O:C+H2O CO+H2 (生成水煤气)
CO+H2 (生成水煤气)
四.硅:
(1)Si与NaOH与H2O:Si + 2NaOH + H2O = Na2SiO3 +
2H2↑ (Si+2OH-+H2O= SiO32- + 2H2↑)
(2)Si与HF:Si+ 4HF = SiF4 + 2H2↑
(3)Si与F2:Si+ 2F2 = SiF4
(4)Si与O2:Si+O2 SiO2 (研细的硅与纯氧)
SiO2 (研细的硅与纯氧)
(5)Si 与 C: Si + C SiC
SiC
(6)C与SiO2:2C+ SiO2 2CO↑+Si(工业制粗硅)
2CO↑+Si(工业制粗硅)
(7)Cl2:与Si:2Cl2+Si= SiCl4
(8)SiCl4 与H2: SiCl4 +2H2=Si+4HCl(粗硅提纯)
(9)SiO2 与NaOH:SiO2 + 2NaOH = Na2SiO3 + H2O
( SiO2 + 2OH- = SiO32-+ H2O )
(10)CaO与SiO2::CaO+SiO2 CaSiO3
CaSiO3
(11)SiO2 与HF:SiO2 + 4HF = SiF4 + 2H2O
(12)Na2SiO3 与HCl:Na2SiO3 +2HCl=2NaCl+H2SiO3↓
(13)Na2SiO3 与 H2O与CO2: Na2SiO3 + H2O+CO2 =
Na2CO3 + H2SiO3↓(强酸制弱酸)
(14)Na2SiO3与H2O与CO2 (过量):Na2SiO3 + H2O+ 2CO2
(过量) = 2NaHCO3+H2SiO3↓
(15)SiO2与 Na2CO3:SiO2 + Na2CO3 Na2SiO3+ CO2↑
Na2SiO3+ CO2↑
(16)SiO2 与 CaCO3:SiO2 + CaCO3 CaSiO3+ CO2↑
CaSiO3+ CO2↑
(工业制玻璃)
(17)H2SiO3与NaOH:H2SiO3 + 2NaOH == Na2SiO3 +
2H2O
(18)H2SiO3分解:H2SiO3  SiO2 + H2O
SiO2 + H2O
五.氯:
(1)Cu与Cl2:Cu+Cl2 CuCl2 (棕黄色烟)
CuCl2 (棕黄色烟)
(2)Cl2与Fe:3Cl2+2Fe 2FeCl3(棕黄色烟) (高价产物)
2FeCl3(棕黄色烟) (高价产物)
(3)Na 与 Cl2 :2Na + Cl2  2NaCl (白烟)
2NaCl (白烟)
(4)Cl2 与H2:Cl2 +H2 2HCl (燃烧苍白色火焰,光照
2HCl (燃烧苍白色火焰,光照
会爆炸)
(5)Cl2 与P:3Cl2 + 2P  2PCl3 (液体)
2PCl3 (液体)
(6)Cl2 与P:5Cl2 + 2P  2PCl5(固体) (白色烟雾)
2PCl5(固体) (白色烟雾)
(7)Cl2与H2O:Cl2+H2O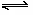 HCl+HClO (新制氯水成分
HCl+HClO (新制氯水成分
三分子H2O,Cl2,HClO四离子H+,Cl-,ClO-,OH-)
(8)Cl2 与 2NaOH:Cl2 + 2NaOH = NaCl + NaClO + H2O
(9)Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(工业制漂白粉)
(10)漂白粉的漂白原理 Ca(ClO)2与H2O与CO2(少量) :
Ca(ClO)2+H2O+ CO2(少量) = CaCO3↓+2HClO (强酸
制弱酸)
(11)漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):
Ca(ClO)2+H2O+CO2(少量) = CaCO3↓+ 2HClO
2HClO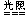 2HCl+O2↑
2HCl+O2↑
(12)FeCl2与 Cl2:2FeCl2 + Cl2 = 2FeCl3
(13)NaBr 与 Cl2:2NaBr + Cl2 == 2NaCl + Br2(2Br - + Cl2
== 2Cl- + Br2)
(14)KI + Cl2:2KI + Cl2 == 2KCl + I2(2I- + Cl2 == 2Cl- +
I2)
(15)实验室制备氯气MnO2与HCl(浓): MnO2 + 4HCl(浓)  MnCl2+Cl2↑+2H2O (MnO2+ 4H+ + 2Cl-
MnCl2+Cl2↑+2H2O (MnO2+ 4H+ + 2Cl-
Mn2+ + Cl2↑ + 2H2O)
(16)NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3
(X=Cl,Br,I)(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子)
(17)NaCl 与 AgNO3:NaCl + AgNO3 = AgCl↓ + NaNO3
(白色沉淀)
(18)NaBr 与 AgNO3:NaBr + AgNO3 = AgBr↓ + NaNO3
(浅黄色沉淀)
(19)KI 与AgNO3: KI +AgNO3 = AgI↓ + KNO3 (黄色沉淀)
六.硫:
(1)Na 与 S加热:2Na + S Na2S
Na2S
(2)Fe与S: Fe+S FeS
FeS
(3)Cu与S:2Cu+S Cu2S (低价产物)
Cu2S (低价产物)
(4)H2与S:H2 + S H2S
H2S
(5)S 与 O2:S + O2  SO2
SO2
(6)S 与NaOH:3S + 6NaOH  2Na2S + Na2SO3 +
2Na2S + Na2SO3 +
3H2O (3S + 6OH-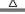 2S2- + SO32- + 3H2O)
2S2- + SO32- + 3H2O)
(7)SO2:与H2O:SO2+H2O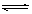 H2SO3(注意“可逆反应”
H2SO3(注意“可逆反应”
的定义)
(8)NaOH与 SO2 (少量):2NaOH+ SO2 (少量) = Na2SO3 +
H2O
(9)NaOH与 SO2(过量):NaOH+ SO2(过量)= NaHSO3
(10)Ca(OH)2 与 SO2 (少量) :Ca(OH)2 + SO2 (少量) =
CaSO3↓+ H2O
(11)Ca(OH)2 与 SO2(过量):Ca(OH)2 + SO2(过量)
=Ca(HSO3)2
 (12)CaO与 SO2:CaO+ SO2 = CaSO3 (13)SO2与O2:2SO2+O2 2SO3
(12)CaO与 SO2:CaO+ SO2 = CaSO3 (13)SO2与O2:2SO2+O2 2SO3
(14)Cl2与SO2:Cl2+SO2 +2H2O=H2SO4+2HCl (同Br2、
I2) (Cl2+SO2 +2H2O= 4H+ + SO42- + 2Cl-)
(15)H2S 与 SO2:2H2S + SO2= 2H2O + 3S↓
(16)SO3与H2O:SO3+H2O=H2SO4
(17)CaO与 SO3:CaO+ SO3 = CaSO4
(18)H2S 与O2(少量):2H2S + O2(少量)  2H2O+2S
2H2O+2S
(19)H2S + O2(足量):2H2S + 3O2(足量)  2H2O + 2SO2
2H2O + 2SO2
(20)FeS 与HCl:FeS + 2HCl = H2S↑ + FeCl2 (同H2SO4,实验室制备H2S)
(21)FeS2与O2:4FeS2+11O2 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
(22)SO3与H2O:SO3+H2O=H2SO4(工业制硫酸)
七.氮
(1)N2与H2:N2+3H2 2NH3 (工业合成氨)
2NH3 (工业合成氨)
(2)N2与O2:N2+O2 2NO
2NO
(3)N2 与Mg:N2 + 3Mg Mg3N2
Mg3N2
(4)NO 与 O2:2NO + O2 = 2NO2
(5)2NO2  N2O4
N2O4
(6)NO2与H2O: 3NO2+H2O = 2HNO3+NO
(7)NO与3O2与2H2O:NO+3O2+2H2O=4HNO3
(8)NO2与O2与H2O:4NO2+O2+2H2O=4HNO3
(9)Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2+H2O
(实验室制备SO2)
(10)Na2SO3 + O2:2Na2SO3 + O2 = 2Na2SO4
(11)SO2(少量) 与NH3 与 H2O: SO2(少量) + 2NH3 + H2O =
(NH4)2SO3
(12)NH3+H2O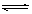 NH3·H2O
NH3·H2O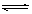 NH4++OH-
NH4++OH-
(13)NH3 与 HCl :NH3 + HCl = NH4Cl(白烟)
(14)NH3 与 HNO3:NH3 + HNO3 = NH4NO3(白烟)
(15)NH3 与 H2SO4:2NH3 + H2SO4 = (NH4)2SO4
(16)NH3与O2:4NH3+5O2 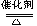 4NO+6H2O
4NO+6H2O
(17)NO + O2:2NO + O2 = 2NO2
(18)NO2+H2O:3NO2+H2O=2HNO3+NO(工业制硝酸)
(19)NH4Cl受热分解:NH4Cl NH3↑+HCl↑ (20)NH4HCO3受热分解:NH4HCO3
NH3↑+HCl↑ (20)NH4HCO3受热分解:NH4HCO3 NH3↑+ H2O
NH3↑+ H2O
+CO2↑
(21)(NH4)2SO4与 NaOH:(NH4)2SO4 + 2NaOH 
Na2SO4 + 2NH3↑+ 2H2O (用于检验NH4+)
(22)NH4Cl 与 Ca(OH)2:2NH4Cl + Ca(OH)2 CaCl2
CaCl2
+ 2NH3↑+2H2O(实验室制氨气)
八.硫酸
(1)H2SO4(浓) 与 Cu:2H2SO4(浓) + Cu  CuSO4 +
CuSO4 +
2H2O + SO2↑
(2)H2SO4(浓) 与Zn:2H2SO4(浓) +Zn = ZnSO4 + 2H2O +
SO2↑
(3)H2SO4(浓) 与Fe(少量):6H2SO4(浓) + 2Fe 
Fe2(SO4)3 + 6H2O + 3SO2↑ (Fe少量)
(4)H2SO4(浓) 与 C:2H2SO4(浓) + C  CO2↑ + 2H2O
CO2↑ + 2H2O
+ 2SO2↑
(5)H2SO4(浓) 与 S:2H2SO4(浓) + S  2H2O + 3SO2↑
2H2O + 3SO2↑
(6)H2S + H2SO4(浓):H2S + H2SO4(浓)= S↓+ SO2↑+
2H2O
(7)HBr + H2SO4(浓):2HBr + H2SO4(浓)= Br2 + SO2↑+
2H2O
(8)HNO3遇光分解:4HNO3  4NO2↑ + O2↑ + 2H2O
4NO2↑ + O2↑ + 2H2O
(硝酸显黄色的原因)
(9)Cu与
HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑ + 2H2O)
(10)HNO3(稀)与Cu:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
( 3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O)
(11)HNO3(浓)与Fe:6HNO3(浓) + Fe  Fe(NO3 )3+
Fe(NO3 )3+
3H2O + 3NO2↑
(12)HNO3(稀)与Fe(足量):8HNO3(稀) + 3Fe(足量)=
3Fe(NO3)2+2NO↑+4H2O
(13)HNO3(稀)与Fe(少量):4HNO3(稀) + Fe(少量)=
Fe(NO3)3 + NO↑ + 2H2O
(14)C与HNO3(浓):C + 4HNO3(浓)  CO2↑ + 4NO2↑
CO2↑ + 4NO2↑
+ 2H2O
