氢氧化钠标准溶液的配制和标定
一、实验目的
1.掌握NaOH标准溶液的配制和标定。
2.掌握碱式滴定管的使用,掌握酚酞指示剂的滴定终点的判断。
二、实验原理
NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。 反应方程式: 2NaOH + CO2 → Na2CO3 + H2O
由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。
除去Na2CO3最通常的方法是将NaOH先配成饱和溶液(约52%,W/W),由于Na2CO3在饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。待Na2CO3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。此外,用来配制NaOH溶液的蒸馏水,也应加热煮沸放冷,除去其中的CO2。
标定碱溶液的基准物质很多,常用的有草酸(H2C2O4?2H2O)、苯甲酸(C6H5COOH)和邻苯二甲酸氢钾(C6H4COOHCOOK)等。最常用的是邻苯二甲酸氢钾,滴定反应如下: C6H4COOHCOOK + NaOH → C6H4COONaCOOK + H2O
计量点时由于弱酸盐的水解,溶液呈弱碱性,应采用酚酞作为指示剂。
三、仪器和试剂
仪器:碱式滴定管(50ml)、容量瓶、锥形瓶、分析天平、台秤。
试剂:邻苯二甲酸氢钾(基准试剂)、氢氧化钠固体(A.R)、10g/L酚酞指示剂:1g酚酞溶于适量乙醇中,再稀释至100mL。
四、操作步骤
1. 0.1mol/L NaOH标准溶液的配制
用小烧杯在台秤上称取120g固体NaOH,加100mL水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。
准确吸取上述溶液的上层清液5.6mL到1000毫升无二氧化碳的蒸馏水中,摇匀,贴上标签。
2. 0.1mol/L NaOH标准溶液的标定
将基准邻苯二甲酸氢钾加入干燥的称量瓶内,于105-110℃烘至恒重,用减量法准确称取邻苯二甲酸氢钾约0.6000克,置于250 mL锥形瓶中,加50 mL无CO2蒸馏水,温热使之溶解,冷却,加酚酞指示剂2-3滴,用欲标定的0.1mol/L NaOH溶液滴定,直到溶液呈粉红色,半分钟不褪色。同时做空白试验。
五、结果结算
NaOH标准溶液浓度计算公式:
m
CNaOH =
(V1-V2)× 0.2042
式中:m---邻苯二甲酸氢钾的质量,g
V1---氢氧化钠标准滴定溶液用量,mL
V2---空白试验中氢氧化钠标准滴定溶液用量,mL
0.2042---与1mmol氢氧化钠标准滴定溶液相当的基准邻苯二甲酸氢钾的质量,g
第二篇:3盐酸和氢氧化钠标准溶液的配制与标定
新乡医学院分析化学实验课教案首页
授课教师姓名及职称:
新乡医学院化学教研室 年 月 日
实验 盐酸和氢氧化钠标准溶液的配制与标定
一、实验目的
1.学会近似0.1mol·L-l酸(HCl)、碱(NaOH)标准溶液的配制方法。
2.掌握容量仪器的正确使用和容量分析的基本操作。
3.进一步巩固分析天平的称量技能。
4.掌握以Na2CO3为基准物质标定HCl浓度的原理及方法。
二、实验原理
一般酸碱多因含有杂质或稳定性较差,不能直接配制成准确浓度的溶液。浓盐酸中HCl易挥发,固体氢氧化钠易吸收空气中的水分并与二氧化碳作用,因而二者只能先配制成近似浓度的溶液,然后用基准物质进行标定,测出其准确浓度,才能作为标准溶液用于测定酸性或碱性物质的含量。
酸碱滴定反应实质上就是H+与OH-结合生成H2O的反应:
H+ + OH-= H2O
当达到化学计量点时:
cHClVHCl=cNaOHVNaOH
或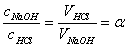
此时pH=7,滴定的突跃范围为pH=4.3~9.7,常用酚酞或甲基橙作指示剂。
用无水Na2CO3作基准物质,对HCl溶液进行标定,其反应为:
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
化学计量点时: 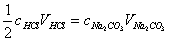
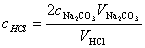
通过α值,求出NaOH的准确浓度。
cNaOH=αcHCl
三、仪器与试剂
50mL酸式滴定管,50mL碱式滴定管,滴定台,250mL锥形瓶,150mL烧怀,10mL、500mL量筒(各一个),洗瓶,250mL容量瓶,玻棒,台称,分析天平,称量瓶,洗耳球,20mL移液管,滴管,500mL试剂瓶(附玻璃塞、橡皮塞各一个),凡士林;固体NaOH(AR),浓HCl(AR),无水Na2CO3(AR),酚酞指示剂,甲基橙指示剂。
四、操作步骤
1.配制近似0.1mol·L-1HCl溶液500mL
浓盐酸浓度为12mol·L-1。首先计算出配制500mL0.1mol·L-1HCl溶液所需浓盐酸的体积,然后用洁净的量筒(10mL)量取所需的浓盐酸[1],倒入盛有20mL蒸馏水的小烧杯中,再将溶液转移到500mL量筒中,用蒸馏水洗涤烧杯2~3次,洗涤液也倒入量筒中,最后稀释至500mL,倒入洁净的500mL玻璃塞试剂瓶中,摇匀,贴上标签备用。
2.配制近似0.1mol·L-lNaOH溶液500mL
计算出所需NaOH的量,用小烧杯在台称上迅速称取计算量的NaOH[2],加入适量蒸馏水,搅拌使其溶解,放冷后转入500mL量筒中,用蒸馏水清洗烧杯2~3次,清洗液也倒入量筒中,最后稀释至500mL,倒入洁净的500mL橡皮塞试剂瓶中,摇匀,贴上标签备用。
3. Na2CO3标准溶液的配制
用分析天平准确称取无水Na2CO31.2~1.4g(准确至0.0001g),置于小烧杯中,加适量蒸馏水搅拌使之完全溶解,然后将溶液小心转入250mL容量瓶中,用蒸馏水清洗烧杯2~3次,清洗液也全部倒入容量瓶中,加水至标线(接近标线时应改用滴管加),充分摇匀,备用。
4.酸碱浓度的比较
(1)将酸式滴定管洗净,用少量蒸馏水润洗三次,再用新配制的HCl溶液润洗三次,每次洗涤过的溶液应从管尖放出,然后注满所配制的HCl溶液(由试剂瓶直接倒入滴定管中),排除滴定管尖端气泡,记录初读数。
(2)按上述操作程序将NaOH溶液装入碱式滴定管,记录初读数。
(3)核对酸式管初读数后,从酸管中准确放出HCl溶液20.00mL于一洁净的锥形瓶中(溶液应沿着锥形瓶内壁流入,以防溅出),加入酚酞2滴。核对碱式管初读数后,自碱式管向锥形瓶中缓缓滴加NaOH溶液,边滴边不断旋摇锥形瓶。当滴至锥形瓶中溶液的红色褪去较慢时,可用少量蒸馏水淋洗瓶壁,再逐滴加入直至出现淡红色并保持30秒内不消失,即达滴定终点。记录NaOH溶液体积末读数,平行测定三次,记录数据,计算三次滴定所得的α值,每次的相对偏差不应超过0.2%(半滴至1滴)。
5.HCl溶液浓度的标定
(1)将移液管洗净,用Na2CO3标准溶液润洗三次,然后准确吸取Na2CO3溶液20.00mL,注入一洁净的锥形瓶中,加入甲基橙指示剂1~2滴,此时溶液呈黄色。
(2)将HCl溶液注入酸式滴定管中,排除气泡后,记录初读数。用HCl标准溶液滴定。接近终点时,用蒸馏水淋洗瓶壁,然后逐滴加入HCl溶液,直至溶液由黄色恰变为橙色,并保持30秒不褪色即为滴定终点,记录HCl末读数。平行测定三次,记录数据。三次HCl溶液体积的相对偏差不得超过0.2%。
五、数据处理
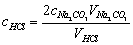
六、注意事项
1.配好的样品溶液不要在空气中久置,否则容易吸收CO2使NaOH的量减少。
2.量取浓盐酸时应在通风橱内进行。
3.在台称上称固体NaOH时,速度要快,因NaOH极易吸水,应随时将NaOH试剂瓶盖好。
