实验3 氢氧化钠标准溶液的标定(总结报告)
1. 实验目的
①用基准邻苯二甲酸氢钾标定NaOH标准溶液;
②熟练掌握煤气灯、洗瓶、容量瓶及移液管的使用,溶液的转移和定容,分析天平的使用及减量法称量操作。
2. 实验原理
①可以用基准邻苯二甲酸,氢钾或基准草酸标定NaOH标准溶液,邻苯二甲酸氢钾的摩尔质量大于草酸称量的相对误差较小,被更多的使用; ②减量法的称量方法:先将供试品放于称量瓶中,置于天平盘上,称得重量。然后取出所需的供试品量,再称得剩余供试品和称量瓶,两次称量之差,即为供试品的重量。
3. 实验步骤
①基准邻苯二甲酸氢钾的称量及溶液的配制:用分析天平准确称取2~3g基准邻苯二甲酸氢钾(准至0.0001,下同),置于150mL小烧杯,加约50mL蒸馏水,小火加热,冷却后转移至250mL容量瓶,定容;
②NaOH标准溶液的标定:用移液管移取上述邻苯二甲酸氢钾溶液50mL至250mL锥形瓶,加1~2滴酚酞指示剂,用0.1mol/L NaOH标准溶液滴定。平行实验3~4次,直至消耗的NaOH标准溶液体积的偏差小于0.02mL;
③计算NaOH标准溶液浓度。
4. 实验数据及结果记录(见附表) 5. 实验总结及误差分析
①移液管使用不规范:将移液管直立,接受器倾斜,管下端紧靠接受器内壁,放开食指,让溶液沿接受器内壁流下,管内溶液流完后,保持放液状态15s,将移液管尖端在接受器靠点处靠壁前后小距离滑动几下;②试剂瓶中溶液未摇匀。
第二篇:实验三_氢氧化钠浓度标准溶液的配制和标定(发给学生)
实验三氢氧化钠标准溶液的配制和标定
实验日期20##、9、20
一、实验目的:
1、学习碱式滴定管的使用;
2、掌握滴定操作并学会正确判断终点;
3、学会配制和标定碱标准溶液的方法。
二、实验原理:
思考:
1.为什么氢氧化钠不能直接配成标准溶液?
2.如何配制氢氧化钠标准溶液?
3.有哪些标准物质可以标定氢氧化钠溶液的浓度?
1)邻苯二甲酸氢钾,反应式如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O
2)草酸,反应式为: H2C2O4+2NaOH=Na2C2O4+2H2O
指示剂:酚酞(pH值为突跃范围为7.7~10)
3) 已知准确浓度的HCl,计量点时溶液呈中性,突跃范围:4~10,MO、MR
4 .如何计算氢氧化钠标准溶液的浓度?
三、实验步骤
1、0.1 mol?L-1 NaOH溶液的配制:
用台秤迅速称取约1.25g NaOH(为什么?) 于100mL小烧杯中,加约30mL无CO2的去离子水溶解,然后转移至试剂瓶中,用去离子水稀释至300mL,摇匀后,用橡皮塞塞紧。贴好标签,备用。
讨论:怎样称量氢氧化钠固体?
(1)NaOH应放在表面皿或小烧杯中进行,不能在称量纸上称。
(2)NaOH在烧杯内溶解,充分搅拌,溶解完全后,转移至试剂瓶内,稀释至所要体积。塞上橡皮塞,充分摇匀。
思考:如何配制不含CO32-的NaOH溶液?
方法(1).用小烧杯于台秤上称取较理论计算量稍多的NaOH,用不含CO2蒸馏水迅速冲洗两次,溶解并定溶。
(2).制备饱和NaOH(50%, Na2CO3基本不溶)待Na2CO3下沉后,取上层清液用不含CO2的蒸馏水稀释.
(3).于NaOH溶液中,加少量Ba(OH)2或BaCI2,取上层清液用不含CO2的蒸馏水稀释.
2、0.1 mol?L-1 NaOH 溶液的标定(平行三份):
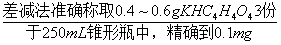 →→
→→ →→
→→ →→
→→ →→
→→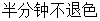 →→
→→ 。
。
四、注意事项:
1、KHC8H4O4溶解较慢,要溶解完全后,才能滴定。
2、近终点要慢滴多摇,要求加半滴到微红色并保持半分钟不褪色
基本操作:碱式滴定管的使用
3、体积读数要读至小数点后两位
仔细看录像中的以下内容:
(1)碱管下端乳胶管和玻璃珠部分的配合,如何洗涤。
(2)如何检查乳胶管内有否气泡。
(3)乳胶管内和未端玻璃管内气泡的排除。
(4)在滴定过程中,如何避免末端带入气泡?
(5)如何挤压玻璃珠,以及挤压的部位。
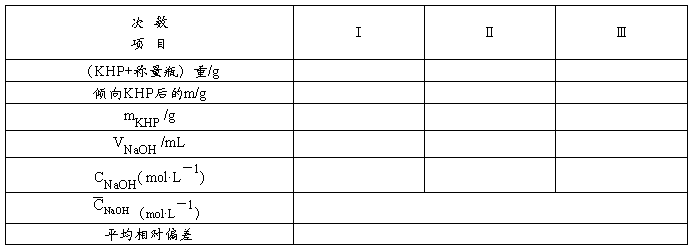
五、数据处理NaOH溶液的标定
六、思考题
1、称取NaOH及邻苯二甲酸氢钾各用什么天平?为什么?
答:称取NaOH用台秤.因为是粗配NaOH;称取邻苯二甲酸氢钾用分析天平,因为需要准确称量, 且称样量小。
2、HCI和NaOH溶液能直接配制准确浓度吗?为什么?
答:不能,因浓HCI易挥发,浓度不确定; NaOH易吸收空气中的CO2和水分。
3、在滴定分析实验中,滴定管和移液管为何需用滴定剂和待移取的溶液润洗几次?锥形瓶是否也要用滴定剂润洗?
答:(1) 防止待移取的溶液浓度被稀释;
(2) 不能,相当于多加了滴定剂,在滴定之前,这部分滴定剂已和待测物质发生了反应,影响分析结果的准确度。
4、HCI和NaOH溶液定量反应完全后,生成NaCI和水,为什么用HCI滴定NaOH时,采用甲基橙指示剂,而用NaOH滴定HCI时,使用酚酞或其它合适的指示剂?
答:因为用HCI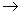 NaOH 指示剂:甲基橙 黄
NaOH 指示剂:甲基橙 黄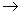 橙
橙
突跃范围PH=4..3-9.7 PH=4.4 4.0
摇动锥形瓶中的NaOH时, CO2影响大(PH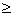 5时),用甲基橙可有效消除 CO2的影响.用酚酞指示剂,会多消耗NaOH,产生较大误差。
5时),用甲基橙可有效消除 CO2的影响.用酚酞指示剂,会多消耗NaOH,产生较大误差。
用NaOH 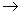 HCI, CO2影响小(滴定管液面与空气接触少),指示剂:酚酞由无色
HCI, CO2影响小(滴定管液面与空气接触少),指示剂:酚酞由无色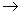 红色,易观察;而甲基橙,由红色
红色,易观察;而甲基橙,由红色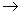 黄色,难观察。
黄色,难观察。
5、溶解基准物质时加入20~30ml水,是用量筒量取,还是用移液管移取?为什么?
答:因为这时所加的水只是溶解基准物质,而不会影响基准物质的量,因此加入的水不需要非常准确,所以可以用量筒量取。
