任务7 氢氧化钠标准溶液的标定
一、目的
1.掌握用邻苯二甲酸氢钾标定氢氧化钠溶液的原理和方法。
2.熟练减量法称取基准物质的方法。
3.熟练滴定操作和用酚酞指示剂判断滴定终点。
二、原理
固体氢氧化钠具有很强的吸湿性,且易吸收空气中的水分和二氧化碳,因而常含有Na2CO3,且含少量的硅酸盐、硫酸盐和氯化物,因此不能直接配制成准确浓度的溶液,而只能配制成近似浓度的溶液,然后用基准物质进行标定,以获得准确浓度。
由于氢氧化钠溶液中碳酸钠的存在,会影响酸碱滴定的准确度,在精确的测定中应配制不含Na2CO3的NaOH溶液并妥善保存。
用邻苯二甲酸氢钾标定氢氧化钠溶液的反应式为:
由反应可知,1mol(KHC8H4O4)与1mol(NaOH)完全反应。到化学计量点时,溶液呈碱性,PH值约为9,可选用酚酞作指示剂,滴定至溶液由无色变为浅粉色,30s不褪即为滴定终点。
三、试剂
1.氢氧化钠固体;
2.酚酞指示剂10g/L乙醇溶液;
3.邻笨二甲酸氢钾基准物。
四、操作步骤
c(NaOH)=0.1mol/lNaOH溶液的标定
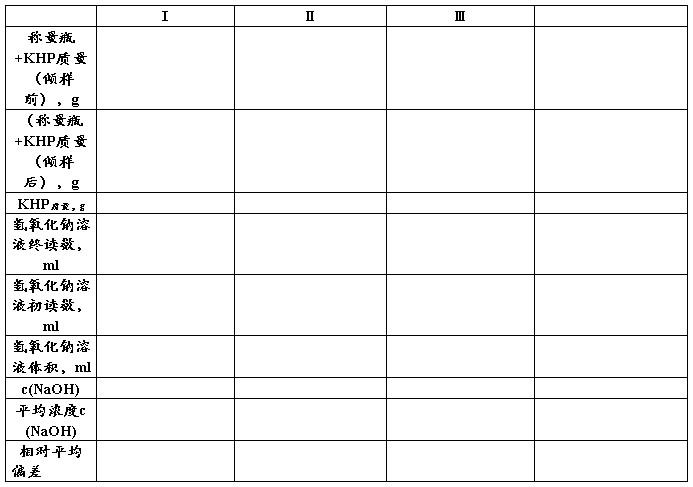
在分析天平上准确称取三份已在105~1100C烘过二小时的基准物质邻苯二甲酸氢钾0.4~0.6g(如何计算)于250ml锥形瓶中,各加25ml煮沸后刚刚冷却的水使之溶解(如没有完全溶解,可稍微加热)。冷却后滴加2滴酚酞指示剂,用欲标定的氢氧化钠溶液滴定至溶液由无色变为微红色30s不消失即为终点。记下氢氧化钠溶液消耗的体积。要求三份标定的相对平均偏差应小于0.2%。
五、计算公式
mKHC8H4O4
c(NaOH) =__________________________________________________
VNaOH. M(KHC8H4O4)
式中 c(NaOH)_______ NaOH标准溶液的浓度,mol/L;
m (KHC8H4O4)_______邻苯二甲酸氢钾的质量, g;
M(KHC8H4O4)________邻苯二甲酸氢钾的摩尔质量,g/mol;
V(NaOH)________滴定时消耗NaOH标准溶液的体积,L;
六、注意事项
配制NaOH溶液,以少量蒸馏水洗去固体NaOH表面可能含有的碳酸钠时,不能用玻璃棒搅拌,操作要迅速,以免氢氧化钠溶解过多,减小溶液浓度。
七、思考题
1.配制不含碳酸钠的氢氧化钠溶液有几种方法?
2.怎样得到不含二氧化碳的蒸馏水?
3.称取氢氧化钠固体时,为什么要迅速称取?
4.用邻苯二甲酸氢钾标定氢氧化钠为什么用酚酞而不用甲基橙作指示剂?
5.标定氢氧化钠溶液时,可用基准物KHC8H4O4,也可用盐酸标准溶液作比较。试比较此两种方法的优缺点。
6.KHC8H4O4标定NaOH溶液的称取量如何计算?为什么要确定0.4~0.6g的称量范围,为什么?
7.果NaOH标准溶液在保存过程中吸收了空气中的CO2,用该标准溶液标定HCl,以甲基橙为指示剂,用NaOH溶液原来的浓度进行计算是否会引入误差?若用酚酞为指示剂进行滴定,又怎样?请分析一下原因。
8.邻苯二甲酸氢钾没规定温度烘干,当温度>1250C时,会使基准物质中有少部分变成酸酐。问:若仍使用此基准物质标定NaOH溶液时,该NaOH溶液的浓度将怎样变化?
9.如基准物KHC8H4O4中含有少量H2C8H4O4,对氢氧化钠溶液标定结果有什么影响?
10.根据标定结果,分析一下本次标定引入的个人操作误差。
同时还吸收CO2生成易结块的碳酸钠,玻璃塞与瓶口粘结,瓶塞难以打开。
c(NaOH)=0.1mol/LNa OH溶液的配制
在托盘天平上用表面皿迅速称取2.2~2.5g NaOH固体于小烧杯中(如何计算),以少量蒸馏水洗去表面可能含有Na2CO3。然后用一定量的蒸馏水溶解,倾入500ml试剂瓶中,加水稀释到500ml,用胶塞盖紧,摇匀(或加入0.1gBaCl2或Ba(OH)2以除去溶液中可能含有的Na2CO3),贴上标签,待测定。
第二篇:氢氧化钠和盐酸标准溶液的标定
氢氧化钠和盐酸标准溶液的标定
一、氢氧化钠标准溶液的配制和标定
C(NaOH)= 1mol/L
C(NaOH)= 0.5mol/L
C(NaOH)= 0.1mol/L
(一)氢氧化钠标准溶液的配制:
称取120g NaOH,溶于100mL水中,摇匀,倒入聚乙烯容器中,密闭放置至溶液清亮。用塑料管吸取下列规定体积的上层清液,注入1000mL无CO2的水中摇匀。
C(NaOH),mol/L----NaOH饱和溶液,mL
1--------------56
0.5-------------28
0.1------------ 5.6
(二)氢氧化钠标准溶液的标定:
1.测定方法:
称取下列规定量的、于105—110。C烘至质量恒定的基准邻二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色同时作空白试验。
C(NaOH)----- 基准邻苯二甲酸氢钾 ----------- 无CO2水
mol/L ................... g...................... mL
1 ...................... 6 ..................... 80
0.5 ..................... 3 ..................... 80
0.1 .................... 0.6......................80
2. 计算:氢氧化钠标准溶液浓度按下式计算:
...................... M
C(NaOH)= ---------------
................(V—V0)×0.2042
式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L;
V——消耗氢氧化钠的量,mL;
V0——空白试验消耗氢氧化钠的量,mL;
M——邻苯二甲酸氢钾的质量,g;
0.2042——邻苯二甲酸氢钾的摩尔质量。K g/ mol。
二、 盐酸标准溶液的配制和标定
C(HCl)= 1mol/L
C(HCl)= 0.5mol/L
C(HCl)= 0.1mol/L
(一) 盐酸标准溶液的配制:
量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
C(HCl)------- HCl,mL
1------------90
0.5-----------45
0.1-----------9
(二)盐酸标准溶液的标定:
1.测定方法:
称取下列规定量的、于270—300。C灼烧至质量恒定的基准无水碳酸钠,称准至0.0001 g。溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,再煮沸2min,冷却后,继续滴定至溶液再呈暗红色。同时作空白试验。
C(HCl),mol/L -----基准无水碳酸钠,g ------ 无CO2水mL
1 ....................... 1.6 .................... 50
0.5 ......................0.8 .................... 50
0.1 ..................... 0.2 .................... 50
3. 计算:
盐酸标准溶液的浓度按下式计算:
..................... M
C(HCl)= ---------------
................(V—V0)×0.05299
式中:C(HCl)——盐酸标准溶液之物质的量浓度,mol/L;
M——无水碳酸钠之质量,g
V——盐酸溶液之用量,mL
V0——空白试验盐酸溶液之用量,mL
0.05299——无水碳酸钠的摩尔质量,K g/ mol。
溴甲酚绿-甲基红混合指示剂:三份1g/L的溴甲酚绿乙醇溶液与一份2g/L的甲基红乙醇溶液混合。
三、 硫酸标准溶液的配制和标定
C(1/2H2SO4)=1 mol/L
C(1/2H2SO4)=0.5 mol/L
C(1/2H2SO4)=0.1 mol/L
(一)硫酸标准溶液的配制
量取下列规定体积的硫酸,缓缓注入1000 mL水中,冷却,摇匀。
1/2H2SO4,mol/L ---------- H2SO4,mL
1 .............................. 30
0.5 .............................15
0.1.............................. 3
(二)硫酸标准溶液的标定
1.测定方法:
称取下列规定量的、于270—300。C灼烧至恒定的基准无水碳酸钠,称取至0.0001 g。溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示液,用配制好的硫酸溶液滴定溶液由绿色变为暗红色,煮
沸2min,冷却后继续滴定至溶液再呈暗红色。同时做空白试验。
C(1/2H2SO4),mol/L ----- 基准无水碳酸钠,g------无CO2水,mL
1 ........................... 1.6....................50
0.5 ..........................0.8 .................. 50
0.1 ......................... 0.2 .................. 50
2.计算:
硫酸标溶液浓度按下式计算:
........................ M
C(1/2H2SO4)=------------
.................(V1—V0)×0.05299
式中:C(1/2H2SO4)——硫酸标准溶液之物质的量浓度,mol/L; M——无水碳酸钠之质量,g;
V1——硫酸溶液之用量,mL;
V0——空白试验硫酸之用量,mL;
0.05299——无水碳酸钠的摩尔质量,mol/L
