盐酸和氢氧化钠标准溶液浓度的标定实验报告
一、实验目的
1.掌握NaOH标准溶液的标定方法。
2.了解基准物质邻苯二甲酸氢钾的性质及应用。
3.进一步学习碱式滴定管的使用。
4.掌握强碱滴定弱酸的滴定过程、指示剂选择和终点的确定方法。
二、实验原理
溶液的配制方法主要分直接法和间接法两种。
(1)直接法:准确称取一定质量的基准物质,溶解后定量转移到容量瓶中,稀释至一定体积,根据称取物质的质量和容量瓶的体积即可计算出该标准溶液准确浓度。
例:配制0.017 mol/L K2Cr2O7标准溶液250mL。准确称取K2Cr2O7 1.2-1.3gK2Cr2O7于100mL小烧杯,加适量水溶解后定量转入250mL容量瓶中,用水稀释至刻度,摇匀。计算其准确浓度。
可直接配制标准溶液的物质应具备的条件:
①必须具备有足够的纯度 一般使用基准试剂或优级纯;
②物质的组成应与化学式完全相等 应避免:结晶水丢失;吸湿性物质潮解; ③稳定——见光不分解,不氧化 重铬酸钾可直接配制其标准溶液。
(2)标定法:许多物质纯度达不到基准试剂的纯度要求,或它们在空气中不稳定,即粗略地称取一定量的物质或量取一定体积的溶液,配制成接近所需浓度的溶液,然后用另一标准溶液来标定。
如用基准物质准确标定出NaOH溶液的浓度。
基准物质:邻苯二甲酸氢钾,草酸。
邻苯二甲酸氢钾:易制得纯品,在空气中不吸水,易保存,摩尔质量大,与NaOH反应的计量比为1:1。 在100~125℃下干燥h后使用。
滴定反应为:
化学计量点时,溶液呈弱碱性(pH≈9.20),可选用酚酞作指示剂。
式中m邻苯二甲酸氢钾—单位g, VNaOH—单位ml。
草酸 H2C204·2H2O:在相对湿度为5%~95%时稳定(能否放置在干燥器中保存?);
用不含CO2的水配制草酸溶液,且暗处保存(光和Mn2+能加快空气氧化草酸,草酸溶液本身也能自动分解)。
滴定反应为: H2C2O4 + 2NaOH = Na2C2O4 + 2H2O
化学计量点时,溶液呈弱碱性(pH≈8.4),可选用酚酞作指示剂。
式中m草酸—单位g, VNaOH—单位mL。
标准溶液的浓度要保留4位有效数字。
三、主要试剂和仪器
NaOH(S);酚酞指示剂(0.2%乙醇溶液);邻苯二甲酸氢钾(S)(A.R)。
电子天平;台秤;量筒(10mL); 烧杯;试剂瓶(500mL带橡胶塞);碱式滴定管(50mL);锥形瓶(250mL)。
四、实验步骤
1. 500mL 0.1MNaOH标准溶液的配制
①用台秤称取2.0g NaOH于小烧杯中 ②溶解(约50mL水转入500mL试剂瓶中 ③刷小烧杯3次,转入试剂瓶 ④加水至总体积约500mL ⑤盖橡皮塞,摇匀 ⑥标定好后贴标签
2. 标定NaOH溶液
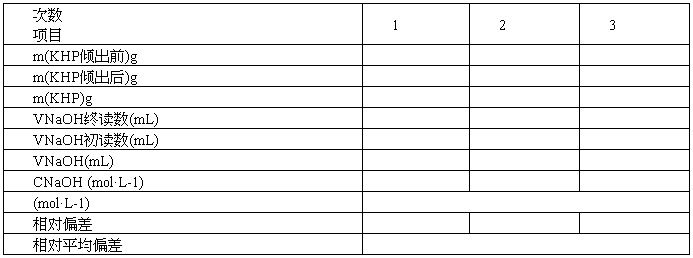
用差减法准确称取0.4~0.6g邻苯二甲酸氢钾于250mL锥形瓶中,加20~30mL水溶解(可稍加热以促进溶解,但凉后再滴定)→2~3d酚酞→NaOH溶液滴定至溶液呈微红色,30S内不褪色,即为终点。平行标定三份,计算C NaOH和标定结果的相对平均偏差(≤0.2%)。
五、数据处理
氢氧化钠标准溶液的配制及浓度标定
六、思考题
1. 基准物质KHP吸水对NaOH溶液的标定有何影响?
2.已标定的NaOH溶液在保存中吸收了二氧化碳,用它来测定盐酸的浓度,若以酚酞为指示剂对测定结果有何影响?改用甲基橙,又如何?
3.标准溶液的浓度应保留几位有效数字?
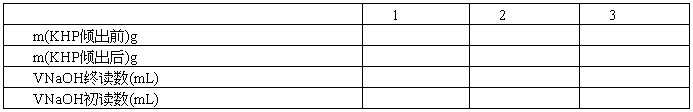
附:原始数据记录单
氢氧化钠标准溶液的配制及浓度标定
第二篇:盐酸标准溶液的标定
盐酸标准溶液的标定
时间:2012.9.10 学生:庄永招
一、 实验目的和原理(简述)
目的:(1)掌握差减称量法称取基准物的方法:
(2)掌握滴定操作基本技能:
(3)学习硼砂标定盐酸溶液的方法。
原理:硼砂与盐酸反应:Na2B4O7?10H2O + HCl = 2NaCl +4H3BO3 + 5H2O
,本实验采用称取硼砂后直接用盐酸滴定的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,可求出盐酸溶液的标准浓度。计算公式如下
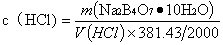
二、 实验注意事项
(1) 酸式滴定管使用前检查玻璃塞是否配套,有无橡皮套,并检漏排气;
(2) 开始滴定时,边滴边摇,观察颜色;
(3) 记录滴定前滴定管内盐酸标准溶液体积读数,读数时保持滴定管垂直,数据的小数点后有两位;
(4) 在化学计量点时,由于生成的硼酸是弱酸,溶液的pH值约为5,可用甲基红作指示剂
(5) 。
三、 主要仪器与药品
仪器:分析天平、称量瓶、酸式滴定管、锥形瓶、量筒
药品:1mol/HCl 溶液、硼砂、甲基红指示剂(0.1%乙醇溶液)
四、 实验步骤
0.1mol/L HCl溶液的标定
(1)检查、洗涤仪器
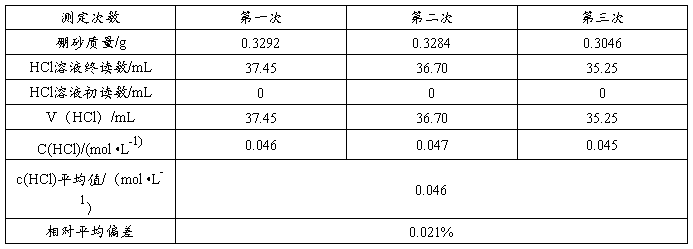
(2)从称量瓶中用差减法准确称取纯净硼砂三份,每份重为0.3~0.4g(称量小数点后四位,标号1、2、3)
(3)溶解,在各锥形瓶中加入20mL水溶解
(4)滴定,在锥形瓶中各滴2~3滴甲基红指示剂,用0.1mol/HCl溶液滴定至溶液由黄色恰变橙色为止
(5)数据处理,记录滴定前后HCl溶液的体积,计算HCl溶液物质的量浓度,求其平均值,计算相对平均偏差
五、实验数据记录
实验结果分析
由公式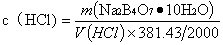 求得HCl溶液浓度再求平均值,
求得HCl溶液浓度再求平均值,
由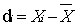 求得平均偏差 平均偏差为
求得平均偏差 平均偏差为 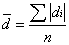
相对平均偏差为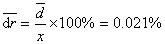
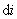 为偏差,偏差越小,精密度越高,反之越低;
为偏差,偏差越小,精密度越高,反之越低;
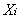 为测量值;
为测量值;
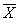 为各测量值得算术平均值;
为各测量值得算术平均值;
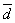 为平均偏差;
为平均偏差;
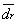 为相对平均偏差。
为相对平均偏差。
