新课标高一必修2化学方程式总汇 (知识点总结)
第一章 物质结构 元素周期律
1、Li与O2反应(点燃)Na与O2反应(点燃)Na与H2O反应:K与H2O反应:2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应 、 、
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:
①
② P9
(2)溴水与碘化钠溶液反应: P9
4、Mg与H2O反应:5、Na与Cl2、反应(点燃): P19
6、用电子式表示氯化钠的形成过程:用电子式表示氯分子的形成过程: P20 用电子式表示氯化氢的形成过程: P20 用电子式表示下列分子:H2 N2 H2O
CO2 CH4
第二章 化学反应与能量
1、Ba(OH)2·8H2O与NH4Cl的反应2、原电池原理
典型的原电池(Zn-Cu原电池)
负极(锌):
正极(铜): (还原反应)
电子流动方向:由锌经过外电路流向铜。
总反应离子方程式: P36
3、H2O2在催化剂作用下受热分解:4、Na2SO4与CaCl2反应 : P45
5、高炉炼铁:
第三章 有机化合物
1、甲烷的主要化学性质
(1)氧化反应(与O2的反应): P53
(2)取代反应(与Cl2在光照条件下的反应,生成四种不同的取代物):P54
①
②
③
④
2、乙烯的主要化学性质
(1) 氧化反应(与O2的反应): P60
(2) 加成反应((与Br2的反应): P60
(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:P60
①
②
③
(4)聚合反应:P60
(乙烯制聚乙烯) ①(氯乙烯制聚氯乙烯)②
3、苯的主要化学性质: P62
(1)氧化反应(与O2的反应):
(2)取代反应
① 与Br2的反应 :
② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。反应方程式:
(3)加成反应
用镍做催化剂,苯与氢发生加成反应:
4、乙醇的重要化学性质
(1)乙醇与金属钠的反应: P67
(2)乙醇的氧化反应
①乙醇的燃烧 P67
②乙醇的催化氧化反应 P68
③乙醇在常温下的氧化反应
酸性KMnO4或酸性重铬酸钾溶液??????????CHCOOH CHCHOH323
5、乙酸的重要化学性质
(1) 乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2) 乙酸的酯化反应
①反应原理(与乙醇的反应): P69
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
6、①蔗糖水解反应:②淀粉(纤维素)水解反应: P73 ③油脂的重要化学性质——水解反应 P73
a)油脂在酸性条件下的水解
油脂+H2O
b)油脂在碱性条件下的水解(又叫
油脂+H2O碱???甘油+ 酸???甘油+
蛋白质+H2O?酶等???各种
第四章 化学与可持续发展
1、2HgO受热分解:Ag2O受热分解:2、CO还原Fe2O3
①C 还原ZnO
②C 还原MgO
③O2还原Cu2
④Al 还原Fe2O3(铝热反应)
⑤Fe还原CuSO4:
3、电解NaCl:①电解NaOH:
②电解MgCl2
③电解Al2O3
4、石油的催化裂化,例如:C4H10裂化得到乙烯和乙烷: P87
[参考答案]
第一章 物质结构 元素周期律
1、4Li + O2
2Na+O
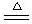
2 2Li2 O Na2O2
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
2、卤素单质与氢气反应
F2 + H2 === 2HF
Cl2 + H2 === 2HCl
Br2 + H2 === 2Br
I2 + H2 === 2HI
3、卤素单质间的置换反应:
(1)Cl2可以从溴化物(或碘化物)中置换出Br2(或I2):
①Cl2+2NaBr=Br2+2NaCl
②Cl2+2KI=I2+2KCl
(2)Br2可以从碘化物中置换出I2:
Br2+2KI=I2+2KBr
4、Mg+2H2O === Mg(OH)2↓+H2↑
2Al+6HCl===2AlCl3+3H2↑
Mg+2 HCl === MgCl2+ H2↑
5、
氯化钠的形成过程:略`
氯分子的形成过程: 氯化氢的形成过程:
用电子式表示下列分子:略
第二章 化学反应与能量
1、 Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O
NaOH+HCl==NaCl+H2O
2、原电池原理
(1)概念:原电池是把化学能转变成电能的装置
(2)典型的原电池(Zn-Cu原电池)
- 负极(锌):Zn-2e=Zn2+ (氧化反应)
-正极(铜):2H++2e=H2↑ (还原反应)
电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:Zn+2H=Zn+H2↑
催化剂 3、2H2O2=△ 2H2O+O2↑ +2+
4、Na2SO4+CaCl2=CaSO4↓+Na2CO3
5、2C + O2 = 2CO
Fe2O3 + 3CO ==2Fe + 3CO2
第三章 有机化合物
1、甲烷的主要化学性质
(1)氧化反应
CH4(g)+2O2(g)???? CO2(g)+2H2O(l)
(2
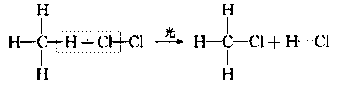
)取代反应
点燃
2、乙烯的主要化学性质
? 2CO2+2H2O (1)氧化反应:C2H4+3O2 ???
(
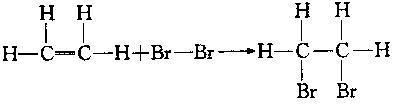
2)加成反应 点燃
乙烯还可以和氢气、氯化氢、水等发生加成反应。 CH2=CH2 + H2
CH2=CH2+HCl
CH2=CH2+H2O
CH3CH3 CH3CH2Cl(一氯乙烷) CH3CH2
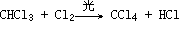
OH
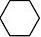
(乙醇)
(3)聚合反应:
3、苯的主要化学性质
(1) 氧化反应 2C6H6+15O2 ???? 12CO2+6H2O
(2) 取代反应
①

+
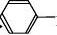
Br2

② 苯与硝酸(用HONO2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
NO2 浓硫酸
+ HONO2 + H2O △
(3) 加成反应
用镍做催化剂,苯与氢发生加成反应,生成环己烷。
+ 3H2 eB3

r?F??
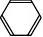

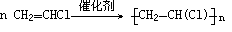
+ HBr 点燃?催化剂???
4、乙醇的重要化学性质
(1) 乙醇与金属钠的反应
2CH3CH2OH+2Na
(2) 乙醇的氧化反应
①乙醇的燃烧
CH3CH2OH+3O2
②乙醇的催化氧化反应
2CH3CH2OH+O2 或Ag?Cu??? 2CH3CHO+2H2O 2CH3CH2ONa+H2↑ ?点燃??? 2CO2+3H2O
乙醛 ③乙醇在常温下的氧化反应
酸性KMnO4或酸性重铬酸钾溶液??????????CHCOOH CHCHOH323
5、乙酸的重要化学性质
(3) 乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3): 2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(4) 乙酸的酯化反应
①反应原理
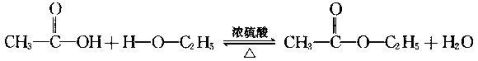
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
6、C12H22O11+H2O→C6H12O6+C6H12O
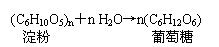
6
油脂的重要化学性质——水解反应
(1) 油脂在酸性条件下的水解
油脂+H2O
(2) 油脂在碱性条件下的水解(又叫皂化反应)
油脂+H2O碱???甘油+高级脂肪酸 酸???甘油+高级脂肪酸
蛋白质+H2O?酶等???各种氨基酸
第四章 化学与可持续发展
略
第二篇:高一必修二化学方程式
1、4Li + O2 ==△== 2Li2O 2K + 2H2O =2KOH + H2↑2、卤素单质与氢气反应:H2 + F2 = 2HF 光照或点燃 △H2 + Cl2 =============2HCl H2 + Br2 === 2HBr△H2 + I2 <=== > 2HI(可逆反应)3、氯水与溴化钠反应:Cl2+2NaBr = 2NaCl+Br2 离子方程式:Cl2 + 2Br- = Br2 + 2Cl-碘化钾在氯水中发生置换反应:2KI+Cl2 == 2KCl+I2 离子方程式:2I- + Cl2 = I2 + 2Cl-新制溴水与碘化钾反应:Br2 +2KI == I2 +2KBr 离子方程式: Br2 +2I- == I2 +2Br-4、八水合氢氧化钡与氯化铵反应:Ba(OH)2·8H2O +2NH4Cl == 2NH3·H2O+BaCl2+8H2O5、原电池的反应:锌片:Zn - 2e- = Zn2+ (氧化反应) 铜片:2H+ + 2e- = H2(还原反应)干电池的反应:Zn → Zn 2- + 2e-放电6、C + CO2 == 2CO(可逆反应) Pb + Pb + 2H2SO4 <======>2PbSO4 + 2H2O(可逆反应)充电光6nH2O + 6nCO2 ——→ (C6H12O6)n + 6nO2叶绿素 △Fe + S ==== FeS 7、有机物反应: H H│ 光 │H─C─H + Cl─Cl ——→ H─C─Cl + H—Cl(取代反应)│ │H H一氯甲烷继续反应,依次生成二氯甲烷、三氯甲烷、四氯甲烷(四氯化碳)二氯甲烷: H 三氯甲烷: Cl│ │H─C─Cl H─C─Cl│ │Cl Cl四氯甲烷(四氯化碳): Cl│ Cl─C─Cl │ Cl 点燃乙烯的氧化反应:C2H4 + 3O2 ———→2CO2 + 2H2O加成反应: H H H H
│ │ │ │H—C=C—H + Br—Br ——→ H—C=C—H│ │Br Br (二溴乙烷)乙烯与氢气反应:CH2=CH2+H2→CH3CH3 乙烯与水反应:CH2=CH2+H2O→CH3CH2OH 乙烯与氯化氢反应:CH2=CH2+HCl→CH3CH2Cl点燃苯燃烧:2C6H6 + 15O2 ———→ 12CO2 + 6H2O1、苯的取代反应:(苯环打不出来,只好截图了....)乙醇与金属钠的反应:2CH3CH2OH + 2Na ——→ 2CH3CH2ONa + H2↑(乙醇钠)点燃乙醇的氧化反应: 2CH3CH2OH + 3O2 ——→ 2CO2 + 3H2OCu或Ag2CH3CH2OH + O2 ————→ 2CH3CHO + 2H2O△乙醇能被重铬酸钾酸性溶液氧化,其氧化过程分两个阶段:乙醇先被氧化为乙醛,再进一步被氧化为乙酸。现象:溶液由橙红色变为绿色。另举一例:如果将70%的硫酸溶液和2%的重铬酸钾溶液按1:2的体积比混合得到“强酸性的重铬酸钾溶液”,取这种溶液2ml,滴加2滴乙醇,不必振荡,就能观察到自上而下逐渐出现蓝绿色的Cr2+的全过程,演示效果好。 乙醇被酸性重铬酸钾溶液氧化的两个过程用化学方程式表示如下:4C2H5OH + K2Cr2O7 + 3H2SO4 = 4CH3CHO + K2SO4 + 2CrSO4 +7H2O 4CH3CHO + K2Cr2O7 + 3H2SO4 = 4CH3COOH + K2SO4 + 2CrSO4 + 3H2O 乙醇被酸性高猛酸钾溶液氧化的化学方程式:5C2H5OH + 4KMnO4 + 6H2SO4 ==== 5CH3COOH + 4MnSO4 + 11H2O + 2K2SO4乙酸的酯化反应: O O‖ 浓硫酸 ‖CH3—C—OH + H—O—C2H5 <===> CH3—C—O—C2H5 + H2O(可逆反应)乙烯转化为溴乙烷:C2H4→C2H5Br : CH2=CH2 + HBr → C2H5Br 加成反应(溴乙烷)溴乙烷 结构式如下 简单的说就是乙烷的一个氢原子被卤素原子溴所取代的产物。H H
| |H—c— c—H| |Br H双糖、多糖可以在稀酸的催化下,最终水解为葡萄糖或果糖: 催化剂蔗糖水解:C12H22O11 + H2O ————→C6H12O6 + C6H12O6蔗糖 葡萄糖 果糖 催化剂淀粉(或纤维素)水解:(C6H10O5)n + nH2O ————→ nC6H12O6淀粉(或纤维素) 葡萄糖油脂在酸或碱催化条件下可以水解。在酸性条件下水解为甘油(丙三醇)、高级脂肪酸;在碱性条件下水解为甘油、高级脂肪酸盐。油脂在碱性条件下的水解反应称为皂化反应。加热 加热 8、 金属冶炼: 加热分解法: 2HgO ======2Hg + O2↑ 2Ag2O ====== 4Ag + O2↑电解电解法: MgCl2(熔融) ====== Mg + Cl2↑电解 电解2Al2O3(熔融)====== 4Al + 3O2↑ 2NaCl(熔融) ======2Na + Cl2↑高温 高温 Fe: Fe2O3 + 3CO ====== 2Fe + 3CO2(高炉炼铁) Fe2O3 + 2Al ====== 2Fe + Al2O3(铝热法炼铁)高温Cu: Cu2S + O2 ====== 2Cu + SO2(火法炼铜) Fe + CuSO4 ===== FeSO4 + Cu(湿法炼铜)高温 电解Mg: MgO + C ====== Mg(g) + CO(g) MgCl2(熔融)====== Mg + Cl2↑高温 △Ti: TiO2 + 2C + Cl2 ====== TiCl4 + 2CO TiCl4 + 2Mg ====== 2MgCl2 + Ti电解 Al: 2Al2O3(熔融)====== 4Al + 3O2↑冰晶石电解Na: 2NaCl(熔融) ====== 2Na + Cl2↑酸性环境下,碘离子被双氧水氧化成碘单质:H2O2 + 2I- + 2H+ = 2H2O + I2 (海带提碘)△ △ 高温SnO2 + 2C ==== Sn + 2CO 2PbS + 3O2 ==== 2PbO + 3S
O2 UF4 + 2Mg ====== U + 2MgF22Au(CN)2 - + Zn ==== 2Au + Zn(CN)4 2- △2[2CuCO3·Cu(OH)2] + 3C ===== 6Cu + 7CO2↑ + 2H2O海水中提取溴: Cl2 + 2Br- == 2Cl- + Br2 SO2 + Br2 + 2H2O == 2HBr + H2SO4Cl2 + 2HBr == Br2 + 2HCl在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴。然后,再用氯气将其氧化得到产品溴。Cl2 + 2NaI === 2NaCl + I2 高温C(s) + H2O(g) ——→ CO(g) + H2(g) 催化剂 催化剂9、重油裂化: C16H34 ————→ C8H18 + C8H16 C8H18 ————→ C4H10 + C4H8或裂解 加热、加压 加热、加压十六烷 辛烷 辛烯 辛烷 丁烷 丁烯催化剂 催化剂9、重油裂化: C4H10 ————→ CH4 + C3H6 C4H10 ————→ C2H4+ C2H6 加热、加压 加热、加压丁烷 甲烷 丙烯 丁烷 乙烯 乙烷_ _乙烯自身发生加成反应: nCH2=CH2 ——→ —├ CH2—CH2 ┤—n ̄  ̄聚乙烯看原图清晰点,手打的比较...像这样一类合成高分子化合物的反应称为加成聚合反应,简称加聚反应。在聚乙烯这种高分子化合物中,乙烯称为单体,重复结构单元—CH2—CH2— 称为链节;n称为聚合度,表示高分子化合物中所含链节的数目。以乙烯为原料生产环氧乙烯,经典的方法是氯代乙醇法,包括以下两步反应:① CH2=CH2 + Cl2 + H2O ——→ ClCH2CH2OH + HClO/ \
② ClCH2CH2OH + HCl + Ca(OH)2 ——→ H2C—CH2 + CaCl2 + 2H2O现代石油化工采用银做催化剂,可以实现一步完成:OAg / \2CH2=CH2 + O2 ——→ 2H2C — CH2甲基丙烯酸甲酯是合成有机玻璃的单体。旧法合成的反应是: (CH3)2C = O + HCN ——→ (CH3)2C(OH)CN(CH3)2C(OH)CN + CH3OH + H2SO4 ——→ CH2=C(CH3)COOCH3 + NH4HSO4Pd新法合成的反应是:CH3C≡CH + CO + CH3OH ——→ CH2=C(CH3)COOCH3氯乙烯(CH2=CHCl)反应生成聚氯乙烯: 催化剂 _ _ n(CH2=CHCl)————→ —├ CH2—CHCl┤—n △  ̄  ̄苯乙烯反应生成聚苯乙烯:(苯乙烯) 习题方程式:点燃 催化剂 C3H8 + 5O2 ——→ 3CO2 + 4H2O 4NH3 + 6NO ====== 5N2 + 6H2O△△6PbO + O2 ====== 2Pb3O4高一必修课本课后习题答案查询网址:/p-198495392.html大家有发现错误请帮忙改正。谢谢。最后修改时间二〇一二年八月六日 19:30:33之前转载的请重转一次,没有检查好很抱歉。
