第二章 化学物质及其变化
第四讲 章末总结及测试
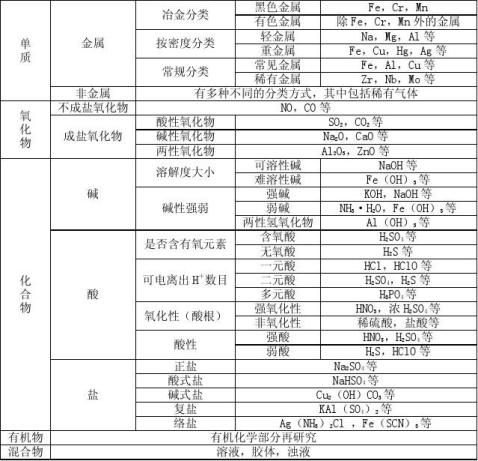
考点聚焦:
1.感受分类方法对于化学科学研究和化学学习的重要作用。
2.知道胶体是一种常见的分散系,了解丁达尔效应。
3.了解电解质的概念,知道酸、碱、盐在溶液中能发生电离。
4.认识离子反应及其发生的条件。

1
1、氧化还原概念关系:
2、书写离子方程式注意事项
(1)离子反应是在溶液中或熔融状态时进行的反应,凡非溶液中进行的反应一般不写离子方程式。如:NH4Cl固体和Ca(OH)2固体混合加热,不能写成离子方程式,即:

(2)离子方程式中写化学式:
单质、氧化物一律写化学式(Cu、Fe、CuO等);弱酸(HF、H2S、H2SO3、HClO等);弱碱(NH3·H2O等);难溶于水的物质(BaSO4、CaCO3、FeS、Fe(OH)3等)
(3)多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写。如NaHSO3溶液和稀H2SO4
-+反应:HSO3+H=H2O+SO2↑
3、离子共存的问题
+-2+2-2+2-(1)生成难溶或微溶物质不能大量共存。例如:Ag与Cl、Ca与CO3、Ba和SO4等。
--2---(2)强酸中不共存的离子有氢氧根和弱酸的酸根,如:ClO、F、S、HSO3、AlO2、
3---2-2-PO4、HS、H2PO4、CO3、SiO3等。
+3+2+3+2(3)强碱中不共存的离子有:氢离子和弱碱的阳离子,如:NH4、Fe、Cu、Al、Mg
+--2--等以及弱酸的酸式酸根,如:HCO3、HSO3、HPO4、HS等。
3+2---2--2(4)发生氧化还原反应的离子不能大量共存,如:Fe与S、I; MnO4与S、I、SO3
-2++-2--2+、

NO3与S、I、Fe等。
2004江苏)Cl2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KCl O3+H2C2O4+H2 SO4===2 ClO2↑+K2 SO4+2CO 2 ↑+2H2 O 下列说法正确的是
A.KCl O3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1mol KCl O3参加反应有2mol电子转移

2
解析:由反应方程式看出KCl O3中Cl元素的化合价由+5降到了+4,所以A正确,D错误;B错误,ClO2应是还原产物;H2C2O4中C元素的化合价由+3升到CO 2中的+4,H2C2O4被氧化正确。本题关键要记清氧化剂、还原剂、还原产物、氧化产物之间的关系。答案:AC。
【例2】(2002上海卷)在氯氧化法处理的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一)氰酸盐进一步被氧化为无毒物质。
—1(1) 某厂废水中含KCN,其浓度为650 ml·L,现用氯氧化法处理,发生如下反应(其
中N均为—3价):KCN+2KOH+Cl2→KOCN+2KCl+H2O,被氧化的元素是_______
(2)投入过量的液氯,可将氰本盐是一步氧化为氮敢。请配平下列化学方程
式:___KOCN+__KOH+___Cl2=___CO2+___N2+____KCl+___H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯________g
解析:(1)此题关键是判断元素前后价态的变化,氯元素化合价降低。K、H、O三元素化合价未变,所以变化的是碳(升高)。(2)首先分清还原剂是KOCN,氧化剂是Cl2,再配平其计量数。(3)在完成(1)(2)的基础上找出关系式2KCN~3Cl进行计算。此题主要是考查氧化还原反就的概念、配平及有关多步反应的计算,此题是一信息题,与实际生活相联系,思考量大,有效地考查了学生分析问题的能力,增强学生的环保意识,是今后命题的方向。
答案:(1)碳(或C) (2)2KOCN+4KOH+3Cl2→2CO2+N2+ 6KCl+2H2O (3)35.5
【例3】(20xx年上海,19)下列离子方程式书写正确的是
2+3+-A.FeCl2溶液中通入Cl2:Fe+Cl2=Fe+2Cl
2+-—B.澄清石灰水与少量小苏打溶液混合:Ca+OH+HCO3=CaCO3↓+H2O
+2+C.FeS固体放入稀硝酸溶液中:FeS+2H=Fe+H2S↑
3+-—D.AlCl3溶液中加入过量氨水:Al+4OH=AlO2+2H2O
2+3+-解析:A选项电荷不守恒,正确的是2Fe+Cl2=2Fe+2Cl;C选项中未考虑稀硝酸
的氧化性,导致产物有误;D选项中氨水是弱电解质,在离子方程式中应写化学式,同时Al
3++(OH)3也不溶于过量的氨水,正确的是Al+3NH3·H2O=Al(OH)3↓)+2NH4。答案:B
思维启迪:澄清石灰水若与足量小苏打溶液混合,离子方程式是________________。
2+-2—2—答案: Ca+2OH+2HCO3=CaCO3↓+CO3+2H2O
【例4】(20xx年上海,9)在pH=1的无色溶液中能大量共存的离子组是
+2+2—-2++-— A.NH4、Mg、SO4、Cl B.Ba、K、OH、NO3
3+2+2—-+2+-—C.Al、Cu、SO4、Cl D.Na、Ca、Cl、AlO2
-2+解析:pH=1表明溶液呈较强的酸性,在酸性溶液中不存在大量的OH,C项因Cu呈蓝
——+—色而不符合题意要求,D项中因AlO2在酸性溶液中发生AlO2+H+H2O=Al(OH)3或AlO2
+3++4H=Al+2H2O而不能大量共存.审视各项,只有A项符合题意.答案:A。
——+—3+思维启迪:在溶液中NO3几乎与所有的离子能大量共存,如:NO3与H、NO3与Al、
—2+—-2++NO3与Fe等,请思考在pH=1的溶液中NO3、Cl、Fe、K能否大量共存?答案:不能大 量共存。
+2+3+【例5】有甲、乙两相邻的工厂,排放的污水经初步处理后只溶有:Ag、Ba、Fe、
+-2——-Na、Cl、SO4、NO3、OH中的各不相同的4种离子.若单独排放会造成环境污染.如将两厂的污水按适当比例混合,沉淀后,污水转变成无色澄清的硝酸钠溶液排出,则污染程 度大为降低,现又测得甲厂的污水pH>7,试推断:
(1)甲厂污水中含有的4种离子是____________________.
(2)乙厂污水含有的4种离子是____________________.
解析:环境保护是目前考试的热点内容.本题实质考查的是离子共存问题,甲厂的污水-+3++3+-2—中含OH,则一定不含Ag和Fe,即乙厂污水中含Ag和Fe,不能含Cl和SO4,由
--2—++3此进而推得:甲厂污水中的离子是OH、Cl、SO4、Na;乙厂污水的离子是Ag、Fe
3
+、Ba、NO3.答案: (1)OH、Cl、SO4、Na(2)Ag、Fe、Ba、NO3
【例6】含有农药、染料、酚、氰化物,以及引起色度、臭味的废水,常用化学氧化法
进行处理,所用的氧化剂有氯类(如液氯、次氯酸钙、次氯酸钠等)和氧类(如空气、臭氧、
-过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN)的废
水.在碱性条件
--下(pH=8.5~11),氯气可将氰化物中CN氧化为只有它毒性1/1000的氰酸盐(含CNO)。
-(1)写出含CN废水用氯气氧化生成氰酸盐的离子方程式____________________.
--(2)若向含CNO的废水中再通入氯气,可使CNO转化为无毒的气体,写出这个反应的
离子方程式____________________.
--(3)在用液氯不便的地区,可用漂白粉处理含CN的废水,若将其氧化为CNO,其离
子方程式为__________________________________________________.
--解析:(1)CN是在碱性条件下被Cl2氧化的,故反应物应有OH参加,产物除生成氰酸
盐外
-----还应有Cl及H2O,离子方程式为:CN+Cl2+2OH=CNO+2Cl+H2O。
-(2)当Cl2过量时(1)中的产物CNO与Cl2反应,碱性条件下不可能产生CO2及其他气
2—--体,而碳元素的存在形式为CO3,无毒气体一定为N2,离子方程式: 2CNO+3Cl2+8OH=
2—-2 CO3+6Cl+4H2O+N2↑
-----(3)由于漂白粉中的ClO具有强氧化性,故可发生反应:CN+ClO=CNO+Cl
------2—-答案:(1)CN+Cl2+2OH=CNO+2Cl+H2O(2)2CNO+3Cl2+8OH=2 CO3+6Cl
---- +

CN+ClO=CNO+Cl
3分,16小题,共48分)
1、根据中央气象台报道,近年每到春季,我国沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
A、溶液 B、悬浊液 C、乳浊液 D、胶体
2、将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是
A、冷水 B、沸水 C、NaOH溶液 D、NaCl溶液
3.下列物质的水溶液能导电,但该物质属于非电解质的是
A.Cu B.HCl C.CO2 D.CH3CH2OH(乙醇)
4.下列物质不属于盐类的是
A.纯碱 B.烧碱 C.小苏打 D.灰锰氧
5.除去FeCl3溶液中的Fe(OH)3胶体,可行的方法是
A.过滤 B.蒸发 C.加入适量的盐酸 D.加入适量的NaOH溶液
6.下列实验现象与氧化还原反应无关的是
A.点燃酒精灯,灯芯燃烧产生黄色火焰 B.碳与氧化铜共热,黑色固体变成红色
C.往澄清石灰水中吹气,石灰水变混浊 D.稀硫酸中加入锌粒,有无色气泡从溶液中逸出
7. 下列反应既属于离子反应,又属于氧化还原反应的是
A.Zn与CuSO4 溶液的反应 B.分解氯酸钾制氧气
C.NaOH溶液与盐酸中和 D.MgCl2溶液 与KOH溶液产生沉淀
+-8、能用H+OH=H2O来表示的化学反应是
A、氢氧化镁和稀盐酸反应 B、Ba(OH)2溶液滴入稀硫酸中
C、澄清石灰水和稀硝酸反应 D、二氧化碳通入澄清石灰水中
9.必须加入还原剂才能实现的反应是
3+ 2+2-A.KMnO4 → O2 B.Fe→ Fe C.S → SO2 D.CO3 → CO2
4 2+—--2—++3+2+—
10.(2006江苏化学,10).一定能在下列溶液中大量共存的离子组是
3+++2-- A 含有大量Al的溶液:Na、NH4、SO4、Cl
+—13—1+2+2-2-B c(H)=1×10mol·L的溶液:Na、Ca、SO4、CO3
3++2+-- C 含有大量Fe的溶液:Na、Mg、NO3、SCN
-+2+2-- D 含有大量NO3的溶液:H、Fe、SO4、Cl
11.胶体区别于溶液最本质的特征是
A.可以通过滤纸 B.有丁达尔效应
C.分散质粒子因吸附而带电荷 D.分散质粒子的直径大小
12.下列有关说法正确的是
A.能在水溶液或熔融状态下导电的物质是电解质 B.电离出氢离子的化合物是酸
C.纳米材料也是一种胶体 D.丁达尔效应,是胶体粒子对光散射形成的
13.下列离子方程式与化学反应事实一致的是
2-+ A.石灰石溶于盐酸:CO3 + 2H== H2O +CO2↑
2+-B.硫酸铜溶液与氢氧化钡溶液反应 :Cu + 2OH == Cu(OH)2↓
+-C.硫酸氢钠溶液与氢氧化钾溶液反应:H + OH == H2O
-—D.硝酸银溶液与氯化钠溶液反应:AgNO3 + Cl == AgCl↓+NO3
14.有关氧化还原反应的叙述错误的是
A.复分解反应一定不是氧化还原反应 B.置换反应都是氧化还原反应
C.金属单质只能做还原剂 D.氧化还原反应的本质是化合价的升降
15.从海水中提取溴有如下反应:
5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是
A.2NaBr+Cl2=2CaCl+Br2 B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl
C.2H2S+SO2=2H2O+3S↓ D.C+CO22CO
16.(2006北京理综,8).已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
-3+A.上述实验证明氧化性:MnO4>Cl2>Fe>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
2+D.实验②证明Fe既有氧化性又有还原性
二、填空题(4个小题,共42分)
17.(12分)现有下列8种物质,请按要求回答问题:①淀粉溶胶 ②锌 ③氧化铁 ④碳 ⑤盐酸 ⑥苛性钠 ⑦碳酸钙⑧氢氧化铜悬浊液
⑴ 运用树状分类法将这些物质(用化学式表示)进行分类。

⑵ 常温下,上述物质两两混合,能够制取的气体有___________________,所发生的反应属离子反应的写出离子方程式,并注明反应类型(按反应形式分)_________________ 。
18.(8分)写出CuSO4溶液和BaCl2溶液反应的离子方程式 ,发生了该反应的实验现象是 。为了检验某些离子实际上没有参加反应,还要进行的实验是(简要地写出实验操作过程) 。
19.(8分) 双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN), 5
化学方程式为:KCN + H2O2 + H2O = KHCO3 + A↑(已配平)
(1)生成物A的化学式为
(2)反应中被氧化的元素为
(3)设反应中的氧化剂是
(4)若将KCN改为HCN也发生类似一述反应,则该反应的化学方程式为: 。
20.(8分)离子反应在污水处理方面也有实际应用,例如:某河段两岸有甲、乙两家工
++3+--- 厂,排出的废水中分别含有下列离子中的三种:K、Ag、Fe、OH、Cl、NO3等,经测定,
甲厂的废水呈明显碱性,则甲厂废水含有的离子是 ,乙厂的废水含有的离子是 。为了消除两厂废水的污染,可控制两厂排出废水的流量使之混合,将大部分污染性强的离子沉淀而除去,用离子方程式表示这种治污原
理 。
21、(6分)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。
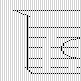
试回答
⑴此实验中,观察到的现象有 ② 。
⑵写出实验过程中反应的离子方程式为 。
三、计算题(1小题,10分)
22.(10分)已知: MnO2 +4HCl(浓) △ === MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:
⑴反应耗用MnO2的质量 ⑵被氧化的HCl物质的量 (3)原浓盐酸的物质的量浓度 参考答案及评分标准:
1、D 2、B3、C4、B5、C6、C7、A 8、C 9、B 10、A 11、D 12、D 13、C 14、D15、D16、A
17.(12分) ⑴ (4分)
6
⑵ H2和CO2(2分)
+2+ Zn + 2H = Zn+ H2↑ 置换反应,(3分)
+ 2+CaCO3 +2H= Ca +CO2↑+ H2O 复分解反应(3分)
2+2- 18.(8分)Ba + SO4= BaSO4↓(2分);产生白色沉淀(2分,)静置后,观察上层清液
2+ 为蓝色,说明Cu未参加反应(2分),取上层清液,滴入用硝酸酸化的硝酸银溶液,产生白
- 色沉淀,说明Cl未参加反应(2分)
19.(8分)(1)NH3 (2)-1价的氧元素 (3)H2O2
(4)HCN + H2O2 = CO2↑ + NH3↑(各2分,共8分)
--++3+-+-20.(8分)OH、Cl、K(2分),Ag、Fe、NO3(2分),Ag + Cl = AgCl↓(2分),
3+-Fe + 3OH = Fe(OH)3↓(2分)
2+-+2-21.(6分)(1)溶液里有白色沉淀产生;(2)小球下沉到烧杯底;(3)Ba+2OH+2H+SO4
=BaSO4↓+4H2O;(各2分)
22.(10分)(1)17.4g(3分),(2)0.4 mol(2分),(3)9 mol/L(4分)
7
