氯化钠的提纯
仪器、药品及材料
仪器:台秤,烧杯(100ml)2个,普通漏斗,漏斗架,布氏漏斗,吸滤瓶,真空泵,蒸发皿,量筒(10ml 1个,50ml 1个),泥三角,石棉网,三角架,坩埚钳,酒精灯。
药品:HCl溶液(2 mol·L-1),NaOH(2 mol·L-1),BaCL2(1 mol·L-1),NaCO3(1 mol·L-1),
(NH4)2C2O4(0.5 mol·L-1),粗食盐,镁试剂。
材料:PH试纸,滤纸。
实验步骤
1.粗食盐的提纯
(1)粗食盐的称量和溶解
在台秤上称取8g 粗食盐,放入100ml 烧杯中,加入30ml 水,加热、搅拌使食盐溶解。
(2)SO42-离子的除去
在煮沸的食盐水溶液中,边搅拌边逐滴加入1 mol·L-1 BaCL2溶液(约1ml)。为检验SO42-离子是否沉淀完全,可将酒精灯移开,待沉淀下沉后,再在上层清液中滴入1~2滴BaCL2溶液,观察溶液是否有浑浊现象。如清液不变浑浊,证明SO42-离子已沉淀完全,如清液浑浊,
则要继续加BaCL2溶液,直到沉淀完全为止。然后用小火加热3~5min,以使沉淀颗粒长大而
便于过滤。用普通漏斗过滤,保留滤液,弃去沉淀。
(3)Ca2+,Mg2+,Ba2+等离子的除去
在滤液中加入适量的(约0.5ml)2 mol·L-1 NaOH溶液和1.5ml 1 mol·L-1 NaCO3溶液,
加热至沸。仿照(2)中方法检验Ca2+,Mg2+,Ba2+等离子已沉淀完全后,继续用小火加热煮沸5min,用普通漏斗过滤,保留滤液,弃去沉淀。
(4)调节溶液的PH值
在滤液中逐滴加入2 mol·L HCl溶液,充分搅拌,并用玻璃棒蘸取滤液在PH试纸上试验,直到溶液微酸性(PH=4~5)为止。
(5)蒸发浓缩
将溶液转移至蒸发皿中,放于泥三角上用小火加热,蒸发浓缩到溶液呈稀糊状为止,切不可将溶液蒸干。
(6)结晶、减压过滤、干燥 -1
将浓缩液冷却至室温。用布氏漏斗减压过滤,尽量抽干。再将晶体转移到蒸发皿中,放在石棉网上,用小火加热并搅拌,以干燥之。冷却后称其质量,计算收率。
2.产品纯度的检验
称取粗食盐和提纯后的精盐各1g,分别溶于5ml去离子水中,然后各分盛于3支试管中。用下述方法对照检验它们的纯度。
(1) SO42-的检验
加入2滴1 mol·L-1 BaCL2溶液,观察有无白色的BaSO4沉淀生成。
(2) Ca2+-的检验
加入2滴0.5 mol·L-1(NH4)2C2O4溶液,稍待片刻,观察有无白色的CaC2O4沉淀生成。
(3) Mg2+的检验
加入2~3滴2 mol·L-1 NaOH溶液,使溶液呈碱性,再加入几滴镁试剂,如有蓝色沉淀产生,表示有Mg2+离子存在。
第二篇:高中化学实验讲义第三部分-物质的分离提纯
高中化学实验讲义 20100106
第三部分 物质的提纯与分离
一、.固-固分离
(1)加热分解法。
请举3例 、 、 。
(2)升华法
请举1例 ;写出你还知道易升华的物质 。
(3)结晶法
①这是分离 的方法;NaCl的溶解度受温度影响小,除可溶杂质,用 法,不能蒸干,理由是 ;KNO3的溶解度随温度的升高而增大,可用 法提纯。
②在实验室中由粗盐制精盐的操作包括溶解、过滤、蒸发、_________、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是_______。
a. 蒸发的目的是得到热饱和溶液b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
③MgCl2的溶解度随温度的升高而增大,由MgCl2溶液得到MgCl2·6H2O也需要蒸发,蒸发的目的是_________。
a. 得到热饱和溶液 b. 析出晶体
(4)生成沉淀分离的方法
①CuSO4溶液中含有Fe2+、Fe3+,提纯的步骤是
。
②某铝土矿样品中含有Al2O3、Fe2O3和SiO2,要将它们分离出来,需要一系列加入试剂、过滤、洗涤、灼烧等操作。依次加入的一组试剂可以是
A.NaOH溶液、盐酸、氨气 B.盐酸、NaOH溶液、二氧化碳
C.NaOH溶液、盐酸、二氧化碳 D.水、盐酸、NaOH溶液
二、液-液分离
(1)分液法
①从碘水中提取碘,步骤是 ;为什么用CCl4比用苯好 ;为什么萃取剂的用量少 ;为什么不用酒精 。
②填写以下物质提纯所用的试剂(括号内物质为杂质)和方法。
乙酸丁酯(乙酸) (为什么不用水 );溴苯(溴)
;苯(苯酚) (为什么不用浓溴水 );
溴乙烷(乙醇) 。
(2)蒸馏(分馏)法
①蒸馏法可用来 、 。
②填写以下物质提纯所用的试剂和方法:
水(NaCl) ;乙醇(水) ;HNO3(水) ;
硝基苯(水) ;邻二甲苯(对二甲苯) 。
(3)纸上层析法
实验原理:纸上层析是用滤纸作为支持剂(载体)的一种色层分析法,这种方法的基本原理是利用混和物中各组分在流动相和固定相间的分配比的不同(即溶解度的不同)而展开的速率不同而使之分离。把试样点在滤纸的原点位置上,当流动相溶剂在滤纸的毛细管作用下,连续不断地沿着滤纸前进通过原点时,试样中各组分便随着流动相溶剂向前移动,并在流动相和固定相溶剂之间连续发生一次又一次的分配。结果,分配比较大的物质移动速度较快,移动的距离较远;分配比较小的物质移动速度慢,移动的距离较近。这样,便把试样中各组分分开聚集在滤纸的不同位置上。这种分离过程叫展开。因此,流动相溶剂又叫做展开剂。
纸上层析可用于化学性质相近的混和物的分离,特别适宜于微量物质的分离和鉴别。当分离的物质是有色的,如甲基橙,层析后在滤纸上可以直接看出它的色斑。当分离的是无色的物质,如酚酞,就必须用显色剂使之显色。无色的酚酞可以用氨水使之显红色,所用的氨水就是显色剂。
[典型实验]用纸上层析法分离铜离子和铁离子
ⅰ用品:大试管、橡皮塞、毛细管、回形针、移液管。饱和FeCl3 溶液、饱和CuSO4 溶液、丙酮、盐酸。
ⅱ操作:
1)装配仪器 取大试管一支,配一个合适的橡皮塞。在橡皮塞的底部用小刀切开一条缝,插入小半段回形针,用来夹持层析的滤纸条。在离开滤纸条末端约2 厘米处用铅笔画×作记号。
2)点层析试样 另取一支试管加入1 毫升饱和FeCl3 溶液和1 毫升饱和CuSO4 溶液,混和后作为层析试样。用毛细管蘸取试样在滤纸条上末端画×记号处滴一小滴,晾干后再滴,重复三次,要求留下斑点的直径保持在0.5 厘米以内。
3)配制展开剂 再取一支试管,加入丙酮9 毫升和6 摩/升的盐酸1 毫升,混和后作展开剂,小心地注在大试管的底部,注意不要沾湿试管壁。
4)层析操作 将橡皮塞上嵌好的点有试样的滤纸条慢慢伸入大试管内,使纸条末端浸入展开剂里约0.1 厘米,不能让试样点接触展开剂。塞紧橡皮塞,插在试管架上静待展开剂展开。约5 分钟后,可以看到试样随着展开剂逐渐在滤纸条上向上移动,直到溶剂上升到滤纸条的上端。
5)显色反应 取出滤纸条,放在浓氨水的瓶口上用氨气熏,即见滤纸条上端出现红棕色,这是Fe3+离子跟氨水反应生成的Fe(OH)3 的颜色。在滤纸条上红棕色的下方出现深蓝色,这是Cu2+离子跟氨反应生成的铜氨络离子[Cu(NH3)4]2+的颜色。由于Fe3+的展开速度比Cu2+快,它们的富集地区就分开了,达到铜离子和铁离子分离的目的。
问题:①该实验的展开剂(流动相)是 ;固定相是 ;
在展开剂中溶解度大的离子是 ;显色剂是 。
②为什么不能让试样点接触展开剂 。
三、气-气分离
1.气体的干燥(除水气)
①浓硫酸不可用来干燥 。
a.CO b.H2 c.H2S d.SO2 e.SO3 (g) f.NH3
②NH3不能用无水氯化钙干燥是因为 。
③碱石灰不能用来干燥 。
1. 填写以下物质的除杂试剂括号内为杂质)。
①乙烷(乙烯) (能否催化加氢 ;能否用酸性高锰酸钾溶液 )。
②H2(H2O、HCl) 。
③Cl2(H2O、HCl) 。
④CO2(H2O、HCl) 。
⑤CO2(CO) 。
⑥CO2(H2S) 。
⑦CO2(SO2) 。
⑧CO(CO2) 。
⑨N2(O2) .
[练习]
1.以下物质的分离提纯方法,正确的是 。
①Na2CO3(NaHCO3):加热分解②I2(KI)加热升华③KNO3 (NaCl):降温结晶④NaCl(KNO3):蒸发结晶⑤乙酸乙酯(乙酸):饱和Na2CO3溶液,分液⑥溴苯(溴): NaOH溶液,分液⑦苯(苯酚): NaOH溶液,分液⑧乙醇(水):新制生石灰,蒸馏⑨乙醇(乙酸):加浓硫酸,蒸馏
2.以下物质的分离提纯,不用蒸馏的是
A.NaCl (水) B. 硝基苯(氯化钙) C.HNO3(水) D. 硝基苯(苯)
3. 以下物质的分离提纯方法都是错误的,对其原因的分析正确的是 。
①乙烷(乙烯),催化加氢:实验条件高;氢气无论多或少都会留有杂质
②乙烷(乙烯),酸性KMnO4溶液,洗气:会产生CO2气体
③苯酚(甲苯),酸性KMnO4溶液,分液: 苯酚也会被氧化
④苯(苯酚),浓溴水,过滤:生成的2,4,6-三溴苯酚不溶于水,但溶于苯(相似相溶)
⑤苯(苯酚), 加NaOH溶液,过滤:应是分液(苯酚难以过滤)
⑥溴苯(溴), 加NaI溶液,分液:生成的I2溶于溴苯,应用NaOH溶液
⑦水(NaCl)),蒸发:应是蒸馏
⑧CO2(HCl),饱和Na2CO3溶液,洗气:应是饱和NaHCO3溶液,因为CO2会和 Na2CO3溶液反应
⑨NH3(水),氯化钙,洗气:氨会和氯化钙反应,应用碱石灰
⑩S02(SO3), 氯化钡溶液,洗气: S02会溶解,应用浓硫酸洗气或管外通过冰水使SO3冷凝为固体
4.混有H2O、H2S、HCl的H2提纯所用试剂最合理的是
A.CuSO44溶液、饱和NaCl溶液、浓H2SO4 B. CuSO44溶液浓H2SO4
C. CuSO44溶液、 NaOH溶液 D.碱石灰
5下列实验装置不适用于物质分离的是

6.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
7.关于以下编号为①-④的装置,能达到实验目的的是 。
a.可用装置①除去Na2CO3(s)中的NaHCO3 b.可用装置②证明NH3(g)极易溶于水
c.可用装置③从海水中得到淡水 d.可用装置④洗涤过滤得到的晶体
8. 某工厂从乙醇、乙酸、乙酸乙酯的混合物中分离、回收上述三种物质,设计了以下方案:

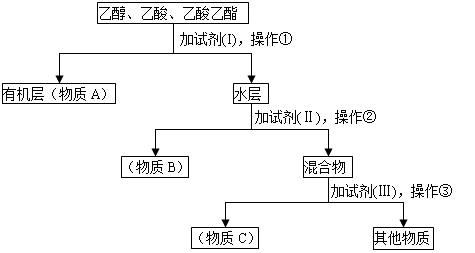
(1)A、B、C是被回收的物质,它们分别是(写名称)
A________________ B_________________ C___________________
(2)所用试剂分别是(写名称)I_______________ Ⅱ_______________Ⅲ_______________
(3)三步操作分别是①_______________②_______________③_______________。
(4)在实验室,操作①应在_______________(填仪器名称)中进行。
第四部分 物质的检验
第五部分 物质的分析
第六部分 探究实验
第七部分 工业流程
