普通化学实验要求:
实验前必须进行预习:
① 认真阅读实验教材、参考教材、资料中的有关内容。
② 明确本实验的目的和内容提要。
③ 掌握本实验的预备知识和实验关键。
④ 了解本实验的内容、步骤、操作和注意事项。
⑤ 写好简明扼要的预习报告后,方能进行实验,若发现预习不够充分,应停止实验,要求熟悉实验内容后再进行实验。
⑥ 预习报告必须书写在专用的的实验记录本上,内容包括:
一、实验目的
二、实验原理
三、实验关键
四、实验步骤(采用流程示意图简单明了地表示)
五、实验数据记录和数据处理(采用表格形式表示,在表格的左下端注明计算公式以及 采用的其他数据)。
六、思考题(必须做出解答)
2. 对实验的要求
① 认真操作,细心观察,如实记录,不得抄袭他人数据。实验中测量的原始数据必须记录在实验记录本上(附在预习报告后面),不得将数据记录在纸片上或其他地方,不得伪造和涂改原始数据。
② 认真阅读“实验室规则”和“实验室学生须知”,要遵守实验制度,养成良好的科学实验习惯,实验中保持肃静,遵守规则,注意安全,整洁节约。
③ 实验过程中应勤于思考,仔细分析,力争自己解决问题,遇到难以解决疑难问题时,可请教师指点。
④ 设计新实验和做规定以外的实验时,应先经指导教师允许。
⑤ 实验过程药品用完后要及时放回原处。
⑥ 随身携带的物品包括书包不得放置在实验台面上,应放在实验台下面的抽屉里。 ⑦ 实验室内不准吃东西喝水,不允许拍照。
⑧ 实验完毕后,将公用仪器放回原来的位置,擦净桌面,填好实验记录卡,并交给指导老师。最后由值日生负责打扫卫生,装去离子水,清理水池废物,倒垃圾。
⑨ 实验不得迟到、缺课。迟到5分钟取消此次实验资格,因病或重大事情不能上实验
课的,必须事先以书面形式向老师请假,不得以口头形式让别人通知老师。以后与指导教师联系再补做所缺实验。因故不能按时上课、请其他人代做实验者,一经查出,取消本年度实验资格。
⑩ 实验完成后,征得实验老师同意方可离开实验室,不得私自离开,否则本次实验成
绩记为不及格。
3. 对实验报告的要求
实验结束后,应严格地根据实验记录数据进行处理和计算,作出相应的结论,并对实验中的问题进行讨论,独立完成实验报告,及时交给指导教师审阅。
书写报告应字迹端正,简单扼要,整齐清洁。实验报告写得潦草者,应重写;实验报告中数据是抄袭他人的或是伪造的,实验成绩记为“0”分。
实验报告包括六部分内容:
一、实验目的
二、实验原理
三、实验仪器、试剂(主要)
四、实验步骤和实验现象
按照实验过程中的操作步骤如实详细地记录。
五、实验数据处理和结果讨论
实验数据处理采用表格形式表示,表格中的物理量均采用无量纲量,在表格的左下端注明计算公式以及采用的其他数据。
结果讨论要求对实验结果的可靠性与合理性进行评价,并解释所观察到的实验现象。
六、实验体会和建议
针对本实验中遇到的疑难问题,提出自己的见解和收获,也可对实验方法和实验内容提出自己的见解,对训练创新思维和创新能力有何帮助。
氯化钠的提纯
实验目的
1.掌握提纯NaCl的原理和方法。
2.学习溶解、沉淀、常压过滤、蒸发浓缩、结晶等基本操作。
实验原理
化学试剂或医药用的NaCl都是以粗食盐为原料提纯的,粗食盐中含有Ca2+、Mg2+、K+和SO42-等可溶性杂质和泥沙等不溶性杂质。选择适当的试剂可使Ca2+、Mg2+、
SO42-等离子生成难溶盐沉淀而除去,一般先在食盐溶液中加BaCl2溶液,除去SO42-离子:
Ba2+ + SO42- = BaSO4↓
然后再在溶液中加Na2CO3溶液,除Ca2+、Mg2+和过量的Ba2+:
Ca2+ + CO32- = CaCO3↓
Ba2+ + CO32- = BaCO3↓
2Mg + 2OH + CO3 = Mg2(OH)2CO3↓
过量的Na2CO3溶液用HCl中和,粗食盐中的K+仍留在溶液中。由于KCl溶解度比NaCl大,而且粗食盐中含量少,所以在蒸发和浓缩食盐溶液时,NaCl先结晶出来,而KCl仍留在溶液中。
常压过滤操作可总结为“一角”、“二低”和“三靠”。“一角”是滤纸的折叠,必须和漏斗的角度相符,使它紧贴漏斗壁,并用水湿润。“二低”是滤纸的边缘须低于漏斗口5毫米左右,漏斗内液面又要略低于滤纸边缘,以防固体混入滤液。“三靠”是过滤时,盛待过滤液的烧杯嘴和玻璃棒相靠,液体沿玻棒流进过滤器;玻璃棒末端和滤纸三层部分相靠;漏斗下端的管口与用来装盛滤液的烧杯内壁相靠;使过滤后的清液成细流沿漏斗颈和烧杯内壁流入烧杯中。
过滤时,置漏斗于漏斗架上,漏斗颈与接收容器紧靠,用玻璃棒贴近三层滤纸一边,a.首先沿玻棒倾入沉淀上层清液,一次倾入的溶液一般最多只充满滤纸的2/3,以免少量沉淀因毛细作用越过滤纸上沿而损失。倾析完成后,在烧杯内将沉淀用少量洗涤液搅拌洗涤,静置沉淀,再如上法倾出上清液。如此3-4次。残留的少量沉淀可用如下方法全部转移干净。左手持烧杯倾斜着拿在漏斗上方,烧杯嘴向着漏斗。用食指将玻璃棒横架在烧杯口上,玻璃棒的下端向着滤纸的三层处,用洗瓶吹出洗液,冲洗烧杯内壁,沉淀连同溶液沿玻璃棒流入漏斗中。B.沉淀全部转移到滤纸上以后,仍需在滤纸上洗涤沉淀,以除去沉淀表面吸附的杂质和残留的母液。其方法是从滤纸边沿稍下部位开始,用洗瓶吹出的水流,按螺旋形向下移动。2+-2-
并借此将沉淀集中到滤纸锥体的下部。洗涤时应注意,切勿使洗涤液突然冲在沉淀上
注意:1.为了提高洗涤效率,每次使用少量洗涤液,洗后尽量沥干,多洗几次,通常称为“少量多次”的原则。
2.沉淀洗涤至最后,用干净的试管接取几滴滤液,选择灵敏的定性反应来检验共存离子,判断洗涤是否完成,这样容易溅失。 器材和药品
1.器材
电磁加热搅拌器,循环水泵,抽滤瓶,布氏漏斗,普通漏斗,烧杯,蒸发皿,台秤,滤纸,pH试纸。
2.药品
NaCl(粗)。
实验方法
一、NaCl的提纯
1.粗盐溶解
称取5g粗食盐于50mL烧杯中,加入20mL水,用电磁加热搅拌器(或酒精灯)加热搅拌使其溶解。
2.除SO42-
加热溶液至沸,边搅拌边滴加1mol〃L-1 BaCl2溶液约3~4mL,继续加热5min,
使沉淀颗粒长大易于沉降。
3.检查SO42-是否除尽
将电磁搅拌器(或酒精灯)移开,待沉降后取少量上清液加几滴6mol〃L-1 HCl,再加几滴1mol〃L-1 BaCl2溶液,如有混浊,表示SO42-尚未除尽,需再加BaCl2溶液直至完全除尽SO42-。
4.除Ca2+、Mg2+和过量的Ba2+
将上面溶液加热至沸,边搅拌边滴加饱和Na2CO3溶液,至滴入Na2CO3溶液不生成沉淀为止,再多加0.5mL Na2CO3溶液,静置。
5.检查Ba2+是否除尽
用滴管取上清液放在试管中,再加几滴3mol〃L-1 H2SO4,如有混浊现象,则
表示Ba2+未除尽,继续加Na2CO3溶液,直至除尽为止。常压过滤,弃去沉淀。
6.用HCl调整酸度除去CO32-
往溶液中滴加6mol〃L-1HCl,加热搅拌,中和到溶液呈微酸性(pH=3~4左右)。
7.浓缩与结晶
在蒸发皿中把溶液浓缩至原体积的1/3,冷却结晶,抽吸过滤,用少量的2:1酒精水溶液洗涤晶体,抽滤至布氏漏斗下端无水滴。
然后转移到蒸发皿中小火烘干(除去何物?),冷却产品待检验。
二、产品纯度的检验
取粗食盐和提纯后的产品NaCl各0.5g,分别溶于约5mL蒸馏水中,然后用下列方法对离子进行定性检验并比较二者的纯度。
1.硫酸根离子的检验
在两支试管中分别加入上述粗、纯NaCl溶液约1mL,分别加入2滴
6mol〃L-1HCl和3~4滴0.2mol〃L-1 BaCl2溶液,观察其现象。
2.钙离子的检验
在两支试管中分别加入粗、纯NaCl溶液约1mL,加2mol〃L-1HAc使呈酸性,再分别加入3~4滴饱和草酸铵溶液,观察现象。
3.镁离子的检验
在两支试管中分别加入粗、纯NaCl溶液约1mL,先各加入约4~5滴
6mol〃L-1NaOH,摇匀,再分别加3~4滴镁试剂溶液,溶液有蓝色絮状沉淀时,表示有镁离子存在。反之,若溶液仍为紫色,表示无镁离子存在。
三、实验结果
1. 产品外观:(1)粗盐:________(2)精盐:_________。
2. 产品质量:________g, 产率________。
第二篇:氯化钠的提纯
氯化钠的提纯
一.实验目的
1. 了解有关沉淀、沉淀条件的基本知识,了解SO42-、Ca2+、Mg2+、K+等离子的鉴定方法和鉴定条件;
2. 学习与掌握试管的洗涤、离心机的使用、少量沉淀的离心分离、溶液酸度的调节 ;晶形沉淀的洗涤、固体的烘干与灼烧
二.实验原理:
1.粗食盐中含有不溶性杂质(如泥沙)和可溶性杂质(主要是Ca2+、Mg2+、K+和SO42-)。不溶性杂质,可用溶解和过滤的方法除去。
2.可溶性杂质可用下列方法除去:
⑴ 在粗食盐溶液中加入稍微过量的BaCl2溶液时,即可将SO42-转化为难溶解的BaSO4沉淀而除去:
Ba2++SO42- = BaSO4
⑵ 将溶液过滤,除去BaSO4沉淀,再加入Na2CO3溶液,由于发生下列反应:Mg2++2OH- = Mg(OH)2 Ca2++CO32- = CaCO3 Ba2++ CO32- = BaCO3
食盐溶液中的杂质Mg2+、Ca2+以及沉淀SO42-时加入的过量Ba2+转化为难溶的Mg(OH)2,CaCO3,BaCO3沉淀,并通过过滤的方法除去。
⑶过量的NaOH和Na2CO3可以用纯盐酸中和除去
OH- + H + = H2O 2H+ +CO32+ = H2O + CO2↑
⑷少量可溶性的杂质(如KCl)由于含量很少,在蒸发浓缩和结晶过程中仍留在溶液中,不会和NaCl同时结晶出来。
三.主要仪器与试剂
主要仪器:烧杯,试管,蒸发皿,布氏漏斗,吸滤瓶,离心机
主要试剂:粗盐,BaCl2溶液,Na2CO3溶液,H2SO4 稀溶液,6盐酸溶液,六硝基合钴酸钠溶液,镁试剂,2mol/L NaOH, ( NH4)2C2O4溶液,
四.操作步骤:
1. 氯化钠的提纯: 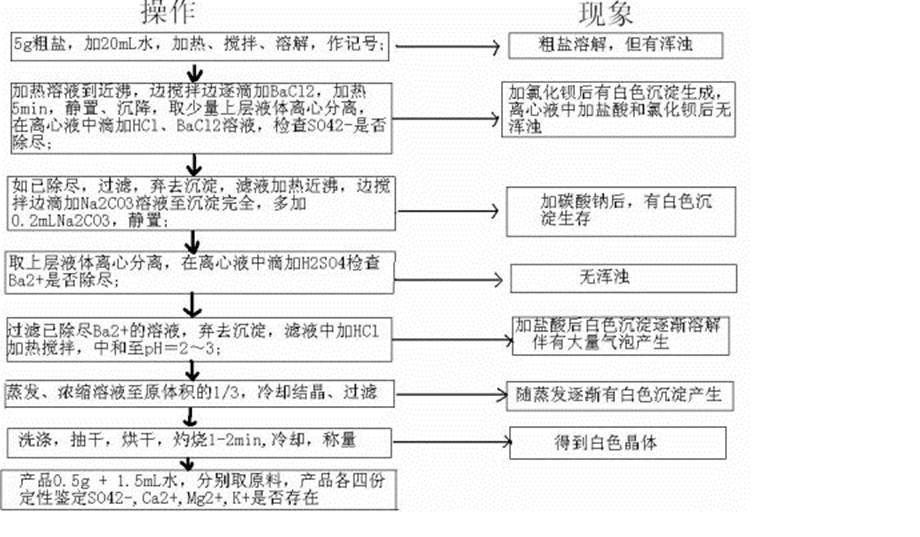
2.定性鉴定:
⑴ K+的鉴定:
.取2滴K+试液,加3滴六硝基合钴酸钠(Na3[Co(NO2)6])溶液,放置片刻,黄色的K2Na[Co(NO2)6]沉淀析出,示有K+ :
2K++Na++[Co(NO2)6]3-=K2Na[Co(NO2)6]↓
⑵ Mg2+的鉴定:取2滴Mg2+试液,加2滴2mol·L-1NaOH溶液,1滴
镁试剂(Ⅰ),沉淀呈天蓝色,示.有Mg2+ 。

对硝基苯偶氮苯二酚,俗称镁试剂(Ⅰ),在碱性环境下呈红色或红紫色,被Mg(OH)2吸附后则呈天蓝色。
⑶Ca2+的鉴定:
取2滴Ca2+试液,滴加饱和(NH4)2C2O4溶液,有白色的CaC2O4沉淀形成, 示有Ca2+
⑷SO42+的鉴定:
试液用6mol·L-1HCl酸化,加2滴0.5mol·L-1BaCl2溶液,白色沉淀析出,示有SO42-
五.实验结果及分析
结果:1.提纯后氯化钠为1.79g
提纯产率:1.79 / 5.0 *100% = 35.8%
2.定性鉴定结果:

3.分析:本次实验得到提纯后的氯化钠产品量偏少,主要因为最后的蒸发浓缩程度不够,最后四种离子的定性鉴定都合格,说明本次实验要求除去的杂质离子达到了标准。
六.问题及思考题
★思考题
1.粗盐中不溶性,可溶性杂质如何出去?
答:粗盐中不溶性杂质可通过过滤除去,可溶性杂质可以根据情况加入沉淀剂,再过滤除去。
2,能否用CaCl2代替毒性很大的BaCl2来除去SO42-?
答:不能。按定性分析的要求,溶液中离子浓度≤10-5mol·L-1;按定量分析的要求,离子浓度≤10-6mol·L-1,才认为该离子已除去。
如以 ≤10-6mol·L-1为标准来选择沉淀剂,则可分析如下 :
已知Ksp(BaSO4)=1.08×10-10,当[SO42-]=10-6mol·L-1,则
[Ba2+]≥1.68×10-4mol·L-1,即可除尽SO42-;如选用CaCl2,由于CaSO4是
微溶盐,Ksp(CaSO4)=9.6×10-6,当[SO42-]=10-6mol·L-1,则[Ca2+]≥9.6mol·L-1,这已超出了CaCl2的溶解度。
3.能否用其他的酸来除去多余的CO32-?
答:不能,会引入新的杂质。
4.除去可溶性杂质离子的先后次序是否合理,可否任意变换次序?
答:合理,不能任意改变。
5.加沉淀剂除杂质,为了得到较大晶粒的沉淀,沉淀的条件是什么?
答:如溶液的浓度不高,冷却缓慢,静置陈化。
6.在除杂质过程中,倘若加热温度高或者时间长,液面上会有晶体出现,这是什么物质,此时能否过滤除去杂质,如不能,怎么办?
答:晶体是NaCl。由于是产品,此时不能过滤,应加水、加热,使其溶解,稍冷后过滤。
★问题
1.能否一次过滤除去硫酸钡、碳酸盐(或氢氧化物)沉淀?
答:不能。如在有硫酸钡的沉淀中滴加碳酸钠溶液,此时体系中存在下列平衡:
BaSO4(s)+CO32- BaCO3(s)+SO42-
由Ksp(BaSO4)=1.1×10-10可知,当按定量分析除尽的标准
[SO42-]≤10-6mol·L-1,必有[Ba2+]≥1.1×10-4mol·L-1,加Na2CO3除Ba2+时,随着CO32-的加入,平衡右移,产生SO42-,使[SO42-]增加。因此不能一次过滤。
2.计算说明加盐酸除去剩余的CO32-,溶液的PH应该控制在何值?
答:控制pH=2~3
已知溶液溶解二氧化碳达到饱和时[H2CO3]=0.04mol·L-1;CO32-除尽的标准:[HCO3-]=1.0×10-6mol·L-1,解得溶液的pH值为1.8。若以[HCO3-]=1.0×10-5mol·L-1的定性标准,解得溶液的pH值为2.7。由产品的质量分析知,pH=3时,NaCl的质量分数为99.8%已达到氯化钠化学试剂的国家标准,所以酸度控制在pH=2~3。
3.氯化钠溶液的浓缩程度对产品的质量有何影响?
答:浓缩太少,溶液中留有的氯化钠多,使产率低;
溶液中还有K+,浓缩太过会使产品中含有较多的K+而没有达到提纯的目的。
七.注意事项
1.粗食颗粒要研细;
2.食盐溶液浓缩时切不可蒸干;
3.普通过滤与减压过滤的正确使用与区别。
4.为防止烘干、灼烧后NaCl结成块状,要及时加以搅拌,并且火不能太大。
