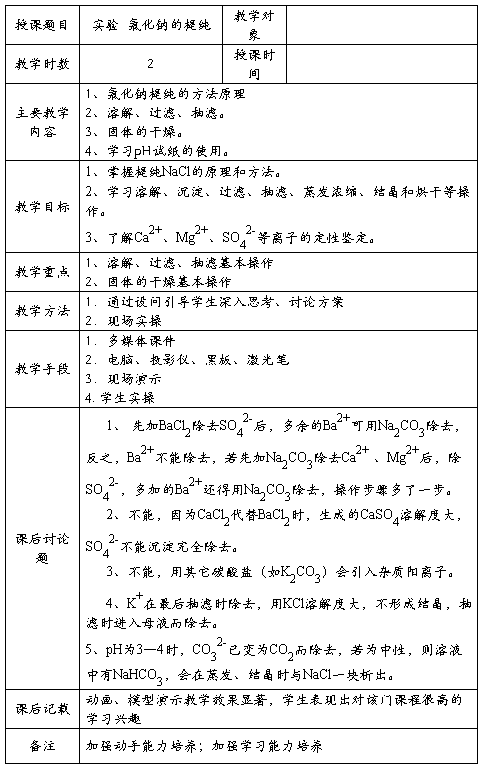
实验 氯化钠的提纯
实验 氯化钠的提纯
【实验目的】
1、掌握提纯NaCl的原理和方法。
2、学习溶解、沉淀、过滤、抽滤、蒸发浓缩、结晶和烘干等操作。
3、了解Ca2+、Mg2+、SO42-等离子的定性鉴定。
【基本操作】
1、溶解、过滤、抽滤。
2、固体的干燥。
3、学习pH试纸的使用。
【实验原理】
粗盐中含Ca2+、Mg2+、K+、SO42-杂质离子和泥沙等机械杂质,可依次用BaCl2除去SO42-,用Na2CO3除去Ca2+,Mg2+、Fe3+、K+在结晶后抽滤时除去。
Ba2+ + SO42- = BaSO4↓
Ca2+ + CO32- = CaCO3↓
Ba2+ + CO32- = BaSO4↓(多余的Ba2+)
2Mg2+ + 2OH- + CO32- = Mg2(OH)2CO3↓ 2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3↓+ 3CO2
Fe3+ + 3OH- = Fe(OH)3↓
【实验步骤】
1、 称15g粗盐×,加50ml水溶解(加热搅拌)。
称7.5g,其它试剂用量减半,可先取水,加热,再称量。
2、除SO42-
将粗盐溶液加热至沸腾,边搅拌边滴加1mol.L-1 BaCl2溶液共(3-4ml),继续加热5min。
3、检验SO42-是否除尽
停止加热,让溶液静置,沉降至上部澄清,取上清液0.5ml,加几滴6mol.L-1HCl,加几滴BaCl2溶液,若无沉淀产生,示SO42-已除尽;若有沉淀,需再加BaCl2至SO42-沉淀完全。
4、除去Ca2+、Mg2+和过量Ba2+
将上述混合物加热至沸腾,边搅拌边滴加饱和Na2CO3溶液(共6—8ml),直至沉淀完全。
5、检验Ba2+是否除去
将上述混合物放置沉降,取0.5ml上清液,滴加3mol.L-1H2SO4,若无沉淀,示Ba2+已除净;否则,再补加Na2CO3至沉淀完全。
验证沉淀完全后,常压过滤,弃去沉淀,保留溶液。
6、用HCl调酸度,除去CO32-。
在滤液中滴加6mol.L-1HCl,搅匀,用pH试纸检验,至pH为3-4左右。
7、加热,蒸发,结晶
将滤液在蒸发皿中加热蒸发,体积为1/3时(糊状,勿蒸干),停止加热,冷却、结晶、抽滤。用少量2:1酒精洗涤沉淀,抽干。
8 、烘干
将抽滤得到的NaCl晶体,在干净干燥的蒸发皿中小火烘干,冷却,称重 _ g,计算产率。
9 、产品纯度的检验
称取粗盐和精盐各0.5g,分别用5ml蒸馏水溶解备用。
(1)SO42-的检验
各取上述两种盐溶液1ml,各加2滴6mol.L-1和3-4滴BaCl2,观察有无白色BaSO4沉淀。
(2) Ca2+的检验
各取上述两种盐溶液1ml,各加几滴2mol.L-1HAc酸化,分别滴加3-4滴饱和(NH4)2C2O4溶液,观察有无CaC2O4白色沉淀。
(3)Mg2+的检验
各取上述两种盐溶液1ml,各加4-5滴6mol.L-1NaOH摇匀,各加3-4滴镁试剂,若有蓝色絮状沉淀,表示含Mg2+。
【实验结果】
1 产品外观:(1)粗盐 _; (2)精盐 _
2 计算产率
【思考题】
1、 先加BaCl2除去SO42-后,多余的Ba2+可用Na2CO3除去,反之,Ba2+不能除去,若先加Na2CO3除去Ca2+ 、Mg2+后,除SO42-,多加的Ba2+还得用Na2CO3除去,操作步骤多了一步。
2、不能,因为CaCl2代替BaCl2时,生成的CaSO4溶解度大,SO42-不能沉淀完全除去。
3、不能,用其它碳酸盐(如K2CO3)会引入杂质阳离子。
4、K+在最后抽滤时除去,用KCl溶解度大,不形成结晶,抽滤时进入母液而除去。
5、pH为3—4时,CO32-已变为CO2而除去,若为中性,则溶液中有NaHCO3,会在蒸发、结晶时与NaCl一块析出。
第二篇:实验三 水、饱和氯化钠的点解
水、饱和氯化钠溶液的电解
燕紫娟
20##级化学3班 学号:41207155
一、实验目的
1.掌握演示电解水和饱和食盐水实验操作技能;
2.初步掌握这两个实验的讲解方法;
3.探索、设计电解水器的代用装置。
二、实验原理
1.水的电解: (电解液为5%的NaOH溶液)

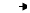 阴极反应:2H+ + 2e- H2 (检验:点燃,有爆鸣声)
阴极反应:2H+ + 2e- H2 (检验:点燃,有爆鸣声)

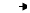 阳极反应:4OH- - 4e- 2H2O + O2 (检验:带火星的木条复燃)
阳极反应:4OH- - 4e- 2H2O + O2 (检验:带火星的木条复燃)





 总反应:2H2O 2H2 + O2
总反应:2H2O 2H2 + O2
2.饱和NaCl溶液的电解

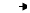 正接:阴极反应(Fe):2H+ + 2e- H2 (用无色酚酞试液检验)
正接:阴极反应(Fe):2H+ + 2e- H2 (用无色酚酞试液检验)

 阳极反应(C): 2Cl- - 2e- Cl2 (用湿润的淀粉Kl试纸检验)
阳极反应(C): 2Cl- - 2e- Cl2 (用湿润的淀粉Kl试纸检验)




 总反应: 2NaCl + 2H2O 2NaOH + H2 + Cl2
总反应: 2NaCl + 2H2O 2NaOH + H2 + Cl2
反接(不换液):

 阴极反应(C):2H2O + 2e- 2OH- + H2
阴极反应(C):2H2O + 2e- 2OH- + H2
 阳极反应(Fe): Fe – 2e Fe2+
阳极反应(Fe): Fe – 2e Fe2+



 总反应:Fe + H2O H2 + Fe(OH)2 (灰绿色沉淀)
总反应:Fe + H2O H2 + Fe(OH)2 (灰绿色沉淀)
反接(饱和NaCl溶液):
 阴极反应(C):2H+ + 2e- = H2
阴极反应(C):2H+ + 2e- = H2
 阳极反应(Fe): Fe – 2e Fe2+
阳极反应(Fe): Fe – 2e Fe2+



 总反应:Fe + H2O H2 + Fe(OH)2
总反应:Fe + H2O H2 + Fe(OH)2
三、实验仪器及试剂
仪器:霍夫曼电解水器、直流低压电源、具支U形管、带刻度试管、
石墨电极、铁电极、导线、淀粉Kl试纸、火柴
试剂:NaOH固体、饱和NaCl溶液、无色酚酞试液
四、实验内容
1.水的电解
(1)使用霍夫曼电解水器电解水
使用前,先用水检验霍夫曼电解水器如图1的气密性。方法是将上部的两个旋钮关闭,塞紧下面的塞子,从贮液器加入水,到一定高度时,在贮液器液面处做一标记,数分钟后看液面是否下降,若不下降则说明气密性良好,否则需要给旋钮涂抹凡士林,并检查塞子是否塞好。
配制5%的NaOH溶液约250mL,冷却至室温后,由贮液器加入5%的NaOH溶液到刻度管的最高刻度处,赶尽气泡后关闭旋钮,连接导线与低压直流电源。接通电源,调解电压为20V开始电解,约10min后,可以看到阴极产生的气体的体积约为阳极的2倍(电解水时,产生气体体积比和理论上的2:1不一致,主要由于以下几个方面的原因:①气体溶解度不同。20℃、1kPa时,O2为31mL/L,H2为18.2mL/L;②电极材料与O2发生了反应;③电极上的其他副反应)。
(2)检验电解出来的气体
打开阴极旋钮,调节速度使液面缓慢上升(先排一会,将导气管内的空气排出,防止氢气中混有空气,发生爆炸),在阴极的尖嘴处点燃,若有爆鸣声,说明阴极生成的是H2。
打开阳极旋钮,调节速度使液面缓慢上升,将带火星的木条放在阳极的小型漏斗内,发现木条复燃,说明阳极生成的是O2。

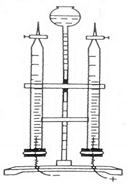
 图1 霍夫曼电解水器
图1 霍夫曼电解水器
2.饱和NaCl溶液的电解
(1)正接
如图2所示,向具支U形管中滴加饱和NaCl溶液至支管以下约2cm处,并从两管口各滴加2滴酚酞试液,装上铁阴极和石墨阳极(铁电极和石墨电极使用时,要想进行预处理,用砂纸打磨铁电极,除去铁锈),接通低压直流电源。可以看到电极附近有大量气泡产生。在阴极区,溶液变红,说明阴极区溶液呈碱性;在阳极区上方,用润湿的KI淀粉试纸试之,变蓝,说明在阳极区有Cl2生成。
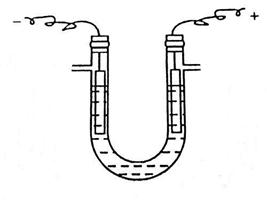
图2 电解NaCl水溶液装置
(2)不换液反接
不换溶液在上述实验的基础上反接阴极和阳极,发现在铁电极的一侧出现白色絮状沉淀,并且沉淀向下移动,在具支U型管底部慢慢变为灰绿色,这是因为Fe(OH)2在向Fe(OH)3转变。溶液中的氧化性物质渐渐将Fe(OH)2氧化为Fe(OH)3。(3)换液直接反接
按照上述方法,在具支U形管中加入新的饱和NaCl溶液,铁电极做阳极,石墨电极做阴极,电解时发现电极附近没有Fe(OH)2絮状沉淀生成,看见铁电极附近溶液变黄,且黄色渐渐向下移动,在具支U形管底部生成灰绿色沉淀。该过程为:电解产生的Fe2+被向阴极移动与向阳极移动的OH-反应,生成Fe(OH)2,溶液中的氧化性物质会将Fe(OH)2氧化成Fe(OH)3,所以底部灰绿色沉淀逐渐转变为红褐色沉淀。
五、实验注意事项
1.用霍夫曼电解水器时,电解液为5%的H2SO4或5%的NaOH溶液。
2.电解完毕,一定要用水冲洗干净霍夫曼电解水器中残留的碱溶液,以免旋钮被卡住。最好在旋塞里衬张小纸片。
3.电解水时,加入的电解质并不参与电极反应,主要是为了增加导电性。浓度过低,达不到效果,以5%为宜。
4.在滴入酚酞之前,注意向具支U形管中滴加的饱和NaCl溶液是在支管以下约2cm处,如果太多,会给后续反应造成不必要的影响。
5.电解NaCl过程中,在滴入酚酞的溶液表面有时会出现一层白色胶体,这是由于酚酞在饱和NaCl溶液中溶解度变小之故。
6.检验阳极产生的Cl2时,不要直接手持淀粉KI试纸,以免与Cl2直接接触,可以借助镊子或玻璃棒。检验时间不宜过长,否则会看到蓝色褪去,因为Cl2可以和生成的I2进一步反应。
7. 电解用饱和NaCl溶液在使用前一定要精制,这样可除去其中的Ca2+、Mg2+,以避免在阴极附近出现白色混浊现象。方法是:给盛有36g NaCl的烧杯中加入蒸馏水,边加热边搅拌,制成饱和溶液。待稍冷却,滴入2滴酚酞试液,再注入含有NaOH和Na2CO3各2g的混合溶液至碱性。静置数小时,待沉淀形成后过滤,将滤液加热至沸腾,稍冷后滴加盐酸至酚酞刚好变为无色为止。
8.电解水实验时注意调节直流电源电压的大小,记录电解水器中产生气体的速率变化,以每产生5mLH2所用时间为例,记录数据如表1所示:
表1 直流电源电压大小与产生H2的速率关系表

由表1可以看出,电解水实验中产生5mLH2所用时间随直流电源电压的增大而减少,即产生5mLH2的速率随直流电源电压的增大而加快。
六、相关文献与重点文献综述
1引自期刊:王良民在《电解饱和食盐水的实验改进》中指出,在新课程苏教版化学一“氯气的生产原理”实验教学中,由于电解产生的氢气量少,导致用爆鸣实验来检验氢气很难成功,并且用淀粉KI试纸检验氯气的操作也不好进行。基于化学演示实验常见易得、操作简单、现象明显的原则,作者进行了如下改进:①用2B铅笔芯代替石墨电极。②阳极支管处增设干燥管。③采用吹肥皂泡的方法检验氢气。原装置如图3所示:

图3 原装置图
改进后的装置如图4所示:
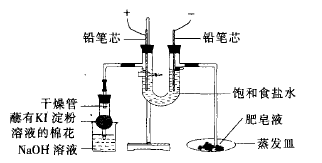
图4 改进后的装置图
改进后的装置优点:采用2B铅笔芯代替石墨电极,减少电极的体积和表面积,可以有效减少石墨电极对氯气的吸附,同时可以减少石墨电极对观察黄绿色氯气的颜色的干扰。同时增加了电极长度,可以减小两极间的距离及电解质电阻,可以加速反应进行,提高电解效率;检验氯气在密闭条件下,可以有效减少氯气对环境的污染,更加环保、安全;用点燃肥皂泡的方法检验氢气,效果显著,操作安全方便,同时增加了趣味性。总之,改进后的装置简单合理,安全环保,操作方便。不足:电解时,铅笔芯发热,电解时间稍长,铅笔芯易断。
2.引自期刊:王赛萍在《化学非预设性课堂初探——学生实验“电解饱和食盐水”》中所报告的课堂改变以教为主的预设性策略,采用以学为主的非预设性策略进行教学。主要解决了学生在课堂上随机提出的以下问题:①用湿润碘化钾淀粉试纸检验时, 开始也看到蓝色,但是后来蓝色消失了。②发现变红的溶液后又褪为无色, 这是怎么回事?③不小心把电源和电极接反了而造成的奇怪的实验现象。同时作者还进行了课堂反思。
对文献的评价:非预设性课堂的教学设计往往在课堂教学中生成,随着教学活动的展开,教师、学生的思想和教学内容不断碰撞,创造性火花不断迸发,新的学习需求、方向不断产生,学生在这个过程中兴趣盎然,认识和体验不断加深,思考和感悟时有形成。在这样的课堂上,学生获得了多方面的满足和发展,教师的劳动也闪耀着创造的光辉,师生都能感觉到生命活力的涌动。教学中应该多加采纳这种教学方式。另外,我们可以在做实验时,预先考虑这些可能存在的实验现象,进行实验,并思考验证。这样对学生学习新知识能起到更好的效果。
3.引自期刊:柏书梅在《电解食盐水实验的创新设计》指出了苏教版电解饱和食盐水存在的几个弊端,并对该实验进行了两种方法的改进。
改进一:实验装置如图5所示:
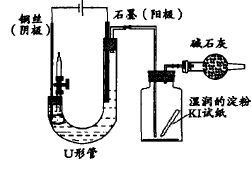
图5 改进一的实验装置
改进二:实验装置如图6所示:
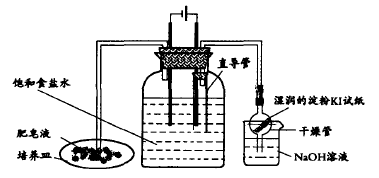
图6 改进二的实验装置
对改进实验的评价:改进装置一类似王良民所进行的改进,有异曲同工之妙;改进装置二采用J形管,固液易分离,使实验操作更加方便简单,产生的气体量可以得到控制,由于右端液柱的压力,排出的氢气气流量大,点燃效果明显。两个装置均是密封的,清洁环保。
八、参考文献
[1] 段玉峰.综合训练与设计[M].20##年8月.北京 :科学出版社,20##年.230-233.
[2] 王良民. 电解饱和食盐水的实验改进[J]. 实验教学与仪器, 2007,(11):23.
[3] 王赛萍. 化学非预设性课堂初探——学生实验“电解饱和食盐水”[J]. 中学化学教学参考, 2008,(06):27-28.
[4] 柏书梅. 电解食盐水实验的创新设计[J]. 化学教与学, 2011,(10):86.
