氯元素
一:氯气的化学性质
1.氯气和金属单质反应(K、Ca、Na、Mg、
Al、Zn、Fe、Cu……)生成高价金属氯化物
 2Fe+3Cl2 2FeCl3
2Fe+3Cl2 2FeCl3
 Cu+Cl2 CuCl2
Cu+Cl2 CuCl2
2Na+Cl2═2NaCl
2.氯气与非金属单质反应
 H2+Cl2 2HCl
H2+Cl2 2HCl
3.氯气与水反应
 Cl2+H2O HCl+HClO
Cl2+H2O HCl+HClO

 2HclO 2HCl+O2
2HclO 2HCl+O2
4.氯气与碱溶液反应
Cl2+2NaOH═NaCl+NaClO+H2O
2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O
漂白粉漂白原理:
Ca(ClO)2+CO2+H2O═CaCO3+2HClO
二:氯气的生产原理
1、实验室制法:
 MnO2+4HCl(浓)
MnO2+4HCl(浓) MnCl2+Cl2 +2H2O
MnCl2+Cl2 +2H2O
2.工业制法:


 2NaCl+2H2O 2NaOH+H2 +Cl2
2NaCl+2H2O 2NaOH+H2 +Cl2
溴元素、碘元素
1. 置换反应
Cl2+2KBr═Br2+2KCl
Cl2+2KI═I2+2KCl
Br2+2KI═I2+2KBr
2. 复分解反应
 NaBr+AgNO3═AgBr +NaNO3
NaBr+AgNO3═AgBr +NaNO3
 NaI+AgNO3═AgI +NaNO3
NaI+AgNO3═AgI +NaNO3
钠元素
一:钠
1、钠与非金属单质
 4Na+O2═2Na2O 2Na+O2 Na2O2
4Na+O2═2Na2O 2Na+O2 Na2O2
 2Na+Cl2 2NaCl 2Na+S═Na2S
2Na+Cl2 2NaCl 2Na+S═Na2S
2. 钠与水
 2Na+2H2O═2NaOH+H2
2Na+2H2O═2NaOH+H2
3. 钠与酸反应
 2Na+2HCl═2NaCl+H2
2Na+2HCl═2NaCl+H2
4. 钠与硫酸铜溶液反应
 2Na+2H2O═2NaOH+H2
2Na+2H2O═2NaOH+H2
 2NaOH+CuSO4═Na2SO4+Cu(OH)2
2NaOH+CuSO4═Na2SO4+Cu(OH)2
5. 置换反应
 TiCl4+4Na Ti+4NaCl
TiCl4+4Na Ti+4NaCl
二:过氧化钠
1. 过氧化钠与二氧化碳反应
2Na2O2+2CO2═2Na2CO3+O2
2. 过氧化钠与水反应
 2Na2O2+2H2O═4NaOH+O2
2Na2O2+2H2O═4NaOH+O2
3. 过氧化钠与盐酸反应
 2Na2O2+4HCl═4NaCl+2H2O+O2
2Na2O2+4HCl═4NaCl+2H2O+O2
4. 过氧化钠与硫酸铜溶液反应
Na2O2+2H2O═4NaOH+O2
 2NaOH+CuSO4═Na2SO4+Cu(OH)2
2NaOH+CuSO4═Na2SO4+Cu(OH)2
三:氧化钠
1. 氧化钠与二氧化碳反应
Na2O+CO2═Na2CO3
2. 氧化钠与水反应
Na2O+H2O═2NaOH
3. 氧化钠与硫酸铜溶液反应
Na2O+H2O═2NaOH
 2NaOH+CuSO4═Cu(OH)2 +Na2SO4
2NaOH+CuSO4═Cu(OH)2 +Na2SO4
四:碳酸钠
1. 与碱反应
 Na2CO3+Ca(OH)2═CaCO3 +2NaOH
Na2CO3+Ca(OH)2═CaCO3 +2NaOH
2. 与盐反应
 Na2CO3+CaCl2═CaCO3 +2NaCl
Na2CO3+CaCl2═CaCO3 +2NaCl
3. 与酸反应
 Na2CO3+2HCl═2NaCl+H2O+CO2
Na2CO3+2HCl═2NaCl+H2O+CO2
4. 碳酸氢钠
① 与碱反应
NaHCO3+NaOH═Na2CO3+H2O
② 与酸反应
 NaHCO3+HCl═NaCl+H2O+CO2
NaHCO3+HCl═NaCl+H2O+CO2
③ 与盐不反应
5. 碳酸钠与碳酸氢钠相互转化
Na2CO3+ CO2+H2O═2NaHCO3
 2NaHCO3
2NaHCO3 Na2CO3+H2O+CO2
Na2CO3+H2O+CO2
镁元素
 ①2Mg+O2 2MgO
①2Mg+O2 2MgO
 ②3Mg+N2 Mg3N2
②3Mg+N2 Mg3N2
 ③2Mg+CO2 2MgO+C
③2Mg+CO2 2MgO+C
 ④Mg+H2SO4═MgSO4+H2
④Mg+H2SO4═MgSO4+H2
 ⑤Mg+2H2O
⑤Mg+2H2O Mg(OH)2+H2
Mg(OH)2+H2
⑥镁的提取

 CaCO3 CaO+CO2 CaO+H2O═Ca(OH)2
CaCO3 CaO+CO2 CaO+H2O═Ca(OH)2
 MgCl2+Ca(OH)2═Mg(OH)2 +CaCl2
MgCl2+Ca(OH)2═Mg(OH)2 +CaCl2
Mg(OH)2+2HCl═MgCl2+2H2O

 MgCl2 Mg+Cl2
MgCl2 Mg+Cl2
铝元素
一:铝
1. 铝与O2、Cl2、S等非金属反应
 4Al+3O2 2Al2O3
4Al+3O2 2Al2O3
 2Al+3Cl2 2AlCl3 2Al+3S
2Al+3Cl2 2AlCl3 2Al+3S Al2S3
Al2S3
2. 铝与水的反应

 2Al+6H2O 2Al(OH)3+3H2
2Al+6H2O 2Al(OH)3+3H2
3. 铝与酸的反应
① 铝与稀硫酸、稀盐酸反应
 2Al+6HCl═2AlCl3+3H2
2Al+6HCl═2AlCl3+3H2
 2Al+3H2SO4═Al2(SO4)3+3H2
2Al+3H2SO4═Al2(SO4)3+3H2
② 常温下,铝与浓硝酸、浓硫酸发生钝化
4. 铝与强碱溶液的反应(只和强碱反应,不和弱碱反应)
 2Al+2NaOH+2H2O═2NaAlO2+3H2
2Al+2NaOH+2H2O═2NaAlO2+3H2
5. 铝与金属氧化物的反应
 2Al+Fe2O3 2Fe+Al2O3
2Al+Fe2O3 2Fe+Al2O3
 8Al+3Fe3O4 9Fe+4Al2O3
8Al+3Fe3O4 9Fe+4Al2O3
6.从铝土矿中提取铝
Al2O3+2NaOH═2NaAlO2+H2O
 NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O

 2Al2O3 4Al+3O2
2Al2O3 4Al+3O2
二:氧化铝
1.氧化铝与强酸反应
Al2O3+3H2SO4═Al2(SO4)3+3H2O
2.氧化铝与强碱反应
Al2O3+2NaOH═2NaAlO2+H2O
3.氧化铝制备
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
三:氢氧化铝
1.制备:
①AlCl3溶液中加入NaOH溶液
②AlCl3溶液中加入氨水
 AlCl3+3NH3·H2O═Al(OH)3 +3NH4Cl
AlCl3+3NH3·H2O═Al(OH)3 +3NH4Cl
③NaAlO2溶液中通入CO2 ④NaAlO2溶液中滴加盐酸
2.氢氧化铝与强酸反应
Al(OH)3+3HCl═AlCl3+3H2O
3.氢氧化铝与强碱反应
Al(OH)3+NaOH═NaAlO2+2H2O
四:偏铝酸钠
1.偏铝酸钠溶液通入过量二氧化碳
 NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
2.偏铝酸钠溶液中滴入少量盐酸
 NaAlO2+HCl+ H2O═Al(OH)3 +NaCl
NaAlO2+HCl+ H2O═Al(OH)3 +NaCl
五:复盐
明矾 KAl(SO4)2·12H2O
明矾溶于水后发生电离
KAl(SO4)2═K++Al3++2SO42-
电离出的铝离子与水反应生成氢氧化铝胶体
Al3++3H2O═Al(OH)3(胶体)+3H+
六:AlCl3与过量NaOH反应
Al3++4OH-═AlO2+2H2O
铁元素
① 3CO+Fe2O3═2Fe+3CO2
②铁与非金属单质

 3Fe+2O2 Fe3O4 2Fe+3Cl2 2FeCl3
3Fe+2O2 Fe3O4 2Fe+3Cl2 2FeCl3
Fe+S FeS
FeS
 ③铁与酸 Fe+2H+═Fe2++H2
③铁与酸 Fe+2H+═Fe2++H2
④铁与盐溶液 Fe+CuSO4═FeSO4+Cu
⑤Fe3++3SCN-═Fe(SCN)3
 ⑥Fe3++3OH-═Fe(OH)3
⑥Fe3++3OH-═Fe(OH)3
 ⑦Fe2++2OH-═Fe(OH)2
⑦Fe2++2OH-═Fe(OH)2
⑧4Fe(OH)2+O2+2H2O═4Fe(OH)3
 ⑨2Fe(OH)3
⑨2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
 ⑨Fe2+ Fe3+:2FeCl2+Cl2═2FeCl3
⑨Fe2+ Fe3+:2FeCl2+Cl2═2FeCl3
 ⑩Fe3+ Fe2+:2FeCl3+Cu═CuCl2+2FeCl2
⑩Fe3+ Fe2+:2FeCl3+Cu═CuCl2+2FeCl2
2FeCl3+Fe═3FeCl2
铜元素
1.铜与非金属单质
 2Cu+O2
2Cu+O2 2CuO Cu+Cl2 CuCl2
2CuO Cu+Cl2 CuCl2
2Cu+S Cu2S
Cu2S
2.铜与酸
Cu+2H2SO4(浓) CuSO4+SO2+2H2O
CuSO4+SO2+2H2O
3.铜与盐
Cu+2AgNO3═2Ag+Cu(NO3)2
4.还原Fe3+
2FeCl3+Cu═CuCl2+2FeCl2
5.铜的冶炼
 ①工业炼铜 黄铜矿(CuFeS2) 粗铜
①工业炼铜 黄铜矿(CuFeS2) 粗铜
 精铜(99.95﹪)
精铜(99.95﹪)

 ②生物炼铜 CuS CuSO4 Cu
②生物炼铜 CuS CuSO4 Cu
③湿法冶铜 Fe+CuSO4═Cu+FeSO4
 ④加热孔雀石绿 Cu2(OH)2·CO3
④加热孔雀石绿 Cu2(OH)2·CO3 2CuO+H2O+CO2
2CuO+H2O+CO2
硅元素
一:硅
1.硅与非金属单质 Si+O2 SiO2 Si+2F2═SiF4
SiO2 Si+2F2═SiF4
 Si+2Cl2 SiCl4
Si+2Cl2 SiCl4
 2.硅与强碱反应 Si+2NaOH+H2O═Na2SiO3+2H2
2.硅与强碱反应 Si+2NaOH+H2O═Na2SiO3+2H2

 3.硅与HF反应 Si+4HF═SiF4 +2H2
3.硅与HF反应 Si+4HF═SiF4 +2H2
二:二氧化硅
1.二氧化硅与强碱反应 SiO2+2NaOH═Na2SiO3+H2O
 2.二氧化硅与碱性氧化物反应SiO2+CaO CaSiO3
2.二氧化硅与碱性氧化物反应SiO2+CaO CaSiO3
 3.二氧化硅与HF反应 SiO2+4HF═SiF4 +2H2O
3.二氧化硅与HF反应 SiO2+4HF═SiF4 +2H2O

 4.弱氧化性SiO2+2C Si+2CO
4.弱氧化性SiO2+2C Si+2CO

 5. Na2CO3+SiO2 Na2SiO3+CO2
5. Na2CO3+SiO2 Na2SiO3+CO2

 CaCO3+SiO2 CaSiO3+CO2
CaCO3+SiO2 CaSiO3+CO2
三:硅酸钠的化学性质
 Na2SiO3+CO2+H2O═H2SiO3 +Na2CO3
Na2SiO3+CO2+H2O═H2SiO3 +Na2CO3
 Na2SiO3+2HCl═2NaCl+H2SiO3
Na2SiO3+2HCl═2NaCl+H2SiO3
 Na2SiO3+CO2+2H2O═Na2CO3+H4SiO4
Na2SiO3+CO2+2H2O═Na2CO3+H4SiO4
四:硅酸
H2SiO3 H2O+SiO2 H4SiO4
H2O+SiO2 H4SiO4 H2O+H2SiO3
H2O+H2SiO3
五:制高纯度硅

 SiO2+2C Si+2CO (制粗硅)
SiO2+2C Si+2CO (制粗硅)
 Si+2Cl2 SiCl4 (SiCl4常温下为液态)
Si+2Cl2 SiCl4 (SiCl4常温下为液态)
 SiCl4+2H2 Si+4HCl
SiCl4+2H2 Si+4HCl
硫元素
 一:二氧化硫
一:二氧化硫
1.二氧化硫与水反应 SO2+H2O H2SO3
2H2SO3+O2═2H2SO4
2.二氧化硫与碱反应 SO2(少)+2NaOH═Na2SO3+H2O
SO2(多)+NaOH═NaHSO3
 SO2(少)+Ca(OH)2═CaSO3 +H2O
SO2(少)+Ca(OH)2═CaSO3 +H2O
2SO2(多)+Ca(OH)2═Ca(HSO3)2
3.与碱性氧化物
SO2+Na2O═Na2SO3 2Na2SO3+O2═2Na2SO4
SO+CaO═CaSO3 2CaSO3+O2═2CaSO4
4.  弱氧化性 2H2S+SO2═3S +2H2O
弱氧化性 2H2S+SO2═3S +2H2O
5. 较强还原性 (SO2与O2、H2O2、Na2O2、KMnO4、HNO3 Cl2 Br2 I2 等反应)
 2SO2+O2 2SO3 SO2+H2O2═H2SO4
2SO2+O2 2SO3 SO2+H2O2═H2SO4
SO2可以使KMnO4溶液褪色 SO2+Na2O2═Na2SO4
SO2+Cl2+2H2O═H2SO4+2HCl SO2可以使卤水褪色
6. 漂白性 SO2使品红褪色,不能漂白酸碱指示剂
HClO、H2O2、Na2O2、O3→强氧化性→漂白性
7. 酸雨的形成(硫酸型酸雨)

 2SO
2+O
2 2SO
3 SO
2+H
2O
2SO
2+O
2 2SO
3 SO
2+H
2O
 H
2SO
3
H
2SO
3
SO3+H2O═H2SO4 2H2SO3+O2═2H2SO4
二:浓硫酸
1.制备 S+O2 SO2 ;4FeS2+11O2
SO2 ;4FeS2+11O2 8SO2+2Fe2O3
8SO2+2Fe2O3
 2SO2+O2 2SO3 SO3+H2O═H2SO4
2SO2+O2 2SO3 SO3+H2O═H2SO4
2.脱水性
3.吸水性

 4.强氧化性 C+2H2SO4(浓)
4.强氧化性 C+2H2SO4(浓) CO2 +2SO2 +2H2O
CO2 +2SO2 +2H2O
 Cu+2H2SO4(浓)
Cu+2H2SO4(浓) CuSO4+SO2 +2H2O
CuSO4+SO2 +2H2O
5.高沸点酸制低沸点酸

 H2SO4(浓)+NaCl NaHSO4+HCl
H2SO4(浓)+NaCl NaHSO4+HCl
6.其它方程式
2H2S+O2═2H2O+2S 2H2SO4+O2═2H2SO4
H2S+Cl2═2HCl+S H2SO3+Cl2+H2O═H2SO4+2HCl
氮元素
一:一氧化氮
1.一氧化氮与氧气反应 2NO+O2═2NO2
2.NO与O2的混合气体通入水中 4NO+3O2+2H2O═4HNO3
二:二氧化氮
1.二氧化氮与水反应3NO2+H2O═2HNO3+NO
2.NO2与O2的混合气体通入水中 4NO2+O2+2H2O═4HNO3
三:氮气
 ①N2+3H2
①N2+3H2 2NH3 ②N2+O2 2NO
2NH3 ②N2+O2 2NO
 ③3Mg+N2 Mg3N2
③3Mg+N2 Mg3N2
四:“雷雨发庄稼”
 ①N2+O2 2NO ②2NO+O2═2NO2
①N2+O2 2NO ②2NO+O2═2NO2
② 3NO2+H2O═2HNO3+NO
五:氨气
 1.与水反应 NH3+H2O NH3·H2O
1.与水反应 NH3+H2O NH3·H2O

 (NH3·H2O NH4++OH- NH3·H2O
(NH3·H2O NH4++OH- NH3·H2O NH3 +H2O)
NH3 +H2O)
2.氨气与酸反应
NH3+HCl═NH4Cl NH3+HNO3═NH4NO3
2NH3+H2SO4═(NH4)2SO4
 3.氨气的工业制法 N2+3H2 2NH3
3.氨气的工业制法 N2+3H2 2NH3
 4.铵盐 ①NH4Cl
4.铵盐 ①NH4Cl NH3 +HCl
NH3 +HCl
 ②2NH4Cl+Ca(OH)2═2NH3 +CaCl2+2H2O
②2NH4Cl+Ca(OH)2═2NH3 +CaCl2+2H2O
六:硝酸


 1.不稳定性 4HNO3 2H2O+4NO2 +O2
1.不稳定性 4HNO3 2H2O+4NO2 +O2
因为NO2,所以浓硝酸略显黄色。出去黄色:
4NO3+O2+2H2O═4HNO3
2.强酸性 电离方程式 HNO3═H++NO3-
①使指示剂变色
②与碱(氢氧化钠)发生中和反应
HNO3+NaOH═NaNO3+H2O
③与碱性氧化物反应 2HNO3+CuO═Cu(NO3)2+H2O
③ 与某些盐(碳酸钠)反应
 2HNO3+Na2CO3═2NaNO3+H2O+CO2
2HNO3+Na2CO3═2NaNO3+H2O+CO2
3.强氧化性
 Cu+4HNO3(浓)═Cu(NO3)2+NO2 +2H2O
Cu+4HNO3(浓)═Cu(NO3)2+NO2 +2H2O
4.具有强氧化性的浓硝酸一定程度上具有漂白性
5.硝酸的工业制法
 4NH3+5O2 4NO+6H2O(氨的催化氧化)
4NH3+5O2 4NO+6H2O(氨的催化氧化)
2NO+O2═2NO2 3NO2+H2O═2HNO3+NO
6.硝酸的实验室制法
 H2SO4(浓)+NaNO3
H2SO4(浓)+NaNO3 NaHSO4+HNO3
NaHSO4+HNO3
第二篇:高中化学方程式总结_高考必备
氯元素
一:氯气的化学性质
1.氯气和金属单质反应(K、Ca、Na、Mg、
Al、Zn、Fe、Cu……)生成高价金属氯化物
 2Fe+3Cl2 2FeCl3
2Fe+3Cl2 2FeCl3
 Cu+Cl2 CuCl2
Cu+Cl2 CuCl2
 2Na+Cl2 2NaCl
2Na+Cl2 2NaCl
2.氯气与非金属单质反应
 H2+Cl2 2HCl
H2+Cl2 2HCl
3.氯气与水反应
 Cl2+H2O HCl+HClO
Cl2+H2O HCl+HClO

 2HclO 2HCl+O2
2HclO 2HCl+O2
4.氯气与碱溶液反应
Cl2+2NaOH═NaCl+NaClO+H2O
2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O
漂白粉漂白原理:
Ca(ClO)2+CO2+H2O═CaCO3+2HClO
二:氯气的生产原理
1、实验室制法:
 MnO2+4HCl(浓)
MnO2+4HCl(浓) MnCl2+Cl2 +2H2O
MnCl2+Cl2 +2H2O
2.工业制法:


 2NaCl+2H2O 2NaOH+H2 +Cl2
2NaCl+2H2O 2NaOH+H2 +Cl2
溴元素、碘元素
1. 置换反应
Cl2+2KBr═Br2+2KCl
Cl2+2KI═I2+2KCl
Br2+2KI═I2+2KBr
2. 复分解反应
 NaBr+AgNO3═AgBr +NaNO3
NaBr+AgNO3═AgBr +NaNO3
 NaI+AgNO3═AgI +NaNO3
NaI+AgNO3═AgI +NaNO3
钠元素
一:钠
1、钠与非金属单质
 4Na+O2═2Na2O 2Na+O2 Na2O2
4Na+O2═2Na2O 2Na+O2 Na2O2
 2Na+Cl2 2NaCl 2Na+S═Na2S
2Na+Cl2 2NaCl 2Na+S═Na2S
2. 钠与水
 2Na+2H2O═2NaOH+H2
2Na+2H2O═2NaOH+H2
3. 钠与酸反应
 2Na+2HCl═2NaCl+H2
2Na+2HCl═2NaCl+H2
4. 钠与硫酸铜溶液反应
 2Na+2H2O═2NaOH+H2
2Na+2H2O═2NaOH+H2
 2NaOH+CuSO4═Na2SO4+Cu(OH)2
2NaOH+CuSO4═Na2SO4+Cu(OH)2
5. 置换反应
 TiCl4+4Na Ti+4NaCl
TiCl4+4Na Ti+4NaCl
二:过氧化钠
1. 过氧化钠与二氧化碳反应
2Na2O2+2CO2═2Na2CO3+O2
2. 过氧化钠与水反应
 2Na2O2+2H2O═4NaOH+O2
2Na2O2+2H2O═4NaOH+O2
3. 过氧化钠与盐酸反应
 2Na2O2+4HCl═4NaCl+2H2O+O2
2Na2O2+4HCl═4NaCl+2H2O+O2
4. 过氧化钠与硫酸铜溶液反应
Na2O2+2H2O═4NaOH+O2
 2NaOH+CuSO4═Na2SO4+Cu(OH)2
2NaOH+CuSO4═Na2SO4+Cu(OH)2
三:氧化钠
1. 氧化钠与二氧化碳反应
Na2O+CO2═Na2CO3
2. 氧化钠与水反应
Na2O+H2O═2NaOH
3. 氧化钠与硫酸铜溶液反应
Na2O+H2O═2NaOH
 2NaOH+CuSO4═Cu(OH)2 +Na2SO4
2NaOH+CuSO4═Cu(OH)2 +Na2SO4
四:碳酸钠
1. 与碱反应
 Na2CO3+Ca(OH)2═CaCO3 +2NaOH
Na2CO3+Ca(OH)2═CaCO3 +2NaOH
2. 与盐反应
 Na2CO3+CaCl2═CaCO3 +2NaCl
Na2CO3+CaCl2═CaCO3 +2NaCl
3. 与酸反应
 Na2CO3+2HCl═2NaCl+H2O+CO2
Na2CO3+2HCl═2NaCl+H2O+CO2
4. 碳酸氢钠
① 与碱反应
NaHCO3+NaOH═Na2CO3+H2O
② 与酸反应
 NaHCO3+HCl═NaCl+H2O+CO2
NaHCO3+HCl═NaCl+H2O+CO2
③ 与盐不反应
5. 碳酸钠与碳酸氢钠相互转化
Na2CO3+ CO2+H2O═2NaHCO3
 2NaHCO3
2NaHCO3 Na2CO3+H2O+CO2
Na2CO3+H2O+CO2
镁元素
 ①2Mg+O2 2MgO
①2Mg+O2 2MgO
 ②3Mg+N2 Mg3N2
②3Mg+N2 Mg3N2
 ③2Mg+CO2 2MgO+C
③2Mg+CO2 2MgO+C
 ④Mg+H2SO4═MgSO4+H2
④Mg+H2SO4═MgSO4+H2
 ⑤Mg+2H2O
⑤Mg+2H2O Mg(OH)2+H2
Mg(OH)2+H2
⑥镁的提取

 CaCO3 CaO+CO2 CaO+H2O═Ca(OH)2
CaCO3 CaO+CO2 CaO+H2O═Ca(OH)2
 MgCl2+Ca(OH)2═Mg(OH)2 +CaCl2
MgCl2+Ca(OH)2═Mg(OH)2 +CaCl2
Mg(OH)2+2HCl═MgCl2+2H2O

 MgCl2 Mg+Cl2
MgCl2 Mg+Cl2
铝元素
一:铝
1. 铝与O2、Cl2、S等非金属反应
 4Al+3O2 2Al2O3
4Al+3O2 2Al2O3
 2Al+3Cl2 2AlCl3 2Al+3S
2Al+3Cl2 2AlCl3 2Al+3S Al2S3
Al2S3
2. 铝与水的反应

 2Al+6H2O 2Al(OH)3+3H2
2Al+6H2O 2Al(OH)3+3H2
3. 铝与酸的反应
① 铝与稀硫酸、稀盐酸反应
 2Al+6HCl═2AlCl3+3H2
2Al+6HCl═2AlCl3+3H2
 2Al+3H2SO4═Al2(SO4)3+3H2
2Al+3H2SO4═Al2(SO4)3+3H2
② 常温下,铝与浓硝酸、浓硫酸发生钝化
4. 铝与强碱溶液的反应(只和强碱反应,不和弱碱反应)
 2Al+2NaOH+2H2O═2NaAlO2+3H2
2Al+2NaOH+2H2O═2NaAlO2+3H2
5. 铝与金属氧化物的反应
 2Al+Fe2O3 2Fe+Al2O3
2Al+Fe2O3 2Fe+Al2O3
 8Al+3Fe3O4 9Fe+4Al2O3
8Al+3Fe3O4 9Fe+4Al2O3
6.从铝土矿中提取铝
Al2O3+2NaOH═2NaAlO2+H2O
 NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O

 2Al2O3 4Al+3O2
2Al2O3 4Al+3O2
二:氧化铝
1.氧化铝与强酸反应
Al2O3+3H2SO4═Al2(SO4)3+3H2O
2.氧化铝与强碱反应
Al2O3+2NaOH═2NaAlO2+H2O
3.氧化铝制备
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
三:氢氧化铝
1.制备:
①AlCl3溶液中加入NaOH溶液
②AlCl3溶液中加入氨水
 AlCl3+3NH3·H2O═Al(OH)3 +3NH4Cl
AlCl3+3NH3·H2O═Al(OH)3 +3NH4Cl
③NaAlO2溶液中通入CO2 ④NaAlO2溶液中滴加盐酸
2.氢氧化铝与强酸反应
Al(OH)3+3HCl═AlCl3+3H2O
3.氢氧化铝与强碱反应
Al(OH)3+NaOH═NaAlO2+2H2O
四:偏铝酸钠
1.偏铝酸钠溶液通入过量二氧化碳
 NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
NaAlO2+CO2+2H2O═Al(OH)3 +NaHCO3
2.偏铝酸钠溶液中滴入少量盐酸
 NaAlO2+HCl+ H2O═Al(OH)3 +NaCl
NaAlO2+HCl+ H2O═Al(OH)3 +NaCl
五:复盐
明矾 KAl(SO4)2·12H2O
明矾溶于水后发生电离
KAl(SO4)2═K++Al3++2SO42-
电离出的铝离子与水反应生成氢氧化铝胶体
Al3++3H2O═Al(OH)3(胶体)+3H+
六:AlCl3与过量NaOH反应
Al3++4OH-═AlO2+2H2O
铁元素
① 3CO+Fe2O3═2Fe+3CO2
②铁与非金属单质

 3Fe+2O2 Fe3O4 2Fe+3Cl2 2FeCl3
3Fe+2O2 Fe3O4 2Fe+3Cl2 2FeCl3
Fe+S FeS
FeS
 ③铁与酸 Fe+2H+═Fe2++H2
③铁与酸 Fe+2H+═Fe2++H2
④铁与盐溶液 Fe+CuSO4═FeSO4+Cu
⑤Fe3++3SCN-═Fe(SCN)3
 ⑥Fe3++3OH-═Fe(OH)3
⑥Fe3++3OH-═Fe(OH)3
 ⑦Fe2++2OH-═Fe(OH)2
⑦Fe2++2OH-═Fe(OH)2
⑧4Fe(OH)2+O2+2H2O═4Fe(OH)3
 ⑨2Fe(OH)3
⑨2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
 ⑨Fe2+ Fe3+:2FeCl2+Cl2═2FeCl3
⑨Fe2+ Fe3+:2FeCl2+Cl2═2FeCl3
 ⑩Fe3+ Fe2+:2FeCl3+Cu═CuCl2+2FeCl2
⑩Fe3+ Fe2+:2FeCl3+Cu═CuCl2+2FeCl2
2FeCl3+Fe═3FeCl2
铜元素
1.铜与非金属单质
 2Cu+O2
2Cu+O2 2CuO Cu+Cl2 CuCl2
2CuO Cu+Cl2 CuCl2
2Cu+S Cu2S
Cu2S
2.铜与酸
Cu+2H2SO4(浓) CuSO4+SO2+2H2O
CuSO4+SO2+2H2O
3.铜与盐
Cu+2AgNO3═2Ag+Cu(NO3)2
4.还原Fe3+
2FeCl3+Cu═CuCl2+2FeCl2
5.铜的冶炼
 ①工业炼铜 黄铜矿(CuFeS2) 粗铜
①工业炼铜 黄铜矿(CuFeS2) 粗铜
 精铜(99.95﹪)
精铜(99.95﹪)

 ②生物炼铜 CuS CuSO4 Cu
②生物炼铜 CuS CuSO4 Cu
③湿法冶铜 Fe+CuSO4═Cu+FeSO4
 ④加热孔雀石绿 Cu2(OH)2·CO3
④加热孔雀石绿 Cu2(OH)2·CO3 2CuO+H2O+CO2
2CuO+H2O+CO2
硅元素
一:硅
1.硅与非金属单质 Si+O2 SiO2 Si+2F2═SiF4
SiO2 Si+2F2═SiF4
 Si+2Cl2 SiCl4
Si+2Cl2 SiCl4
 2.硅与强碱反应 Si+2NaOH+H2O═Na2SiO3+2H2
2.硅与强碱反应 Si+2NaOH+H2O═Na2SiO3+2H2
 3.硅与HF反应 Si+4HF═SiF4 +2H2
3.硅与HF反应 Si+4HF═SiF4 +2H2
二:二氧化硅
1.二氧化硅与强碱反应 SiO2+2NaOH═Na2SiO3+H2O
 2.二氧化硅与碱性氧化物反应SiO2+CaO CaSiO3
2.二氧化硅与碱性氧化物反应SiO2+CaO CaSiO3
 3.二氧化硅与HF反应 SiO2+4HF═SiF4 +2H2O
3.二氧化硅与HF反应 SiO2+4HF═SiF4 +2H2O

 4.弱氧化性SiO2+2C Si+2CO
4.弱氧化性SiO2+2C Si+2CO
 5. Na2CO3+SiO2 Na2SiO3+CO2
5. Na2CO3+SiO2 Na2SiO3+CO2

 CaCO3+SiO2 CaSiO3+CO2
CaCO3+SiO2 CaSiO3+CO2
三:硅酸钠的化学性质
 Na2SiO3+CO2+H2O═H2SiO3 +Na2CO3
Na2SiO3+CO2+H2O═H2SiO3 +Na2CO3
 Na2SiO3+2HCl═2NaCl+H2SiO3
Na2SiO3+2HCl═2NaCl+H2SiO3
 Na2SiO3+CO2+2H2O═Na2CO3+H4SiO4
Na2SiO3+CO2+2H2O═Na2CO3+H4SiO4
四:硅酸
H2SiO3 H2O+SiO2 H4SiO4
H2O+SiO2 H4SiO4 H2O+H2SiO3
H2O+H2SiO3
五:制高纯度硅

 SiO2+2C Si+2CO (制粗硅)
SiO2+2C Si+2CO (制粗硅)
 Si+2Cl2 SiCl4 (SiCl4常温下为液态)
Si+2Cl2 SiCl4 (SiCl4常温下为液态)
 SiCl4+2H2 Si+4HCl
SiCl4+2H2 Si+4HCl
硫元素
 一:二氧化硫
一:二氧化硫
1.二氧化硫与水反应 SO2+H2O H2SO3
2H2SO3+O2═2H2SO4
2.二氧化硫与碱反应 SO2(少)+2NaOH═Na2SO3+H2O
SO2(多)+NaOH═NaHSO3
 SO2(少)+Ca(OH)2═CaSO3 +H2O
SO2(少)+Ca(OH)2═CaSO3 +H2O
2SO2(多)+Ca(OH)2═Ca(HSO3)2
3.与碱性氧化物
SO2+Na2O═Na2SO3 2Na2SO3+O2═2Na2SO4
SO+CaO═CaSO3 2CaSO3+O2═2CaSO4
4.  弱氧化性 2H2S+SO2═3S +2H2O
弱氧化性 2H2S+SO2═3S +2H2O
5. 较强还原性 (SO2与O2、H2O2、Na2O2、KMnO4、HNO3 Cl2 Br2 I2 等反应)
 2SO2+O2 2SO3 SO2+H2O2═H2SO4
2SO2+O2 2SO3 SO2+H2O2═H2SO4
SO2可以使KMnO4溶液褪色 SO2+Na2O2═Na2SO4
SO2+Cl2+2H2O═H2SO4+2HCl SO2可以使卤水褪色
6. 漂白性 SO2使品红褪色,不能漂白酸碱指示剂
HClO、H2O2、Na2O2、O3→强氧化性→漂白性
7. 酸雨的形成(硫酸型酸雨)

 2SO
2+O
2 2SO
3 SO
2+H
2O
2SO
2+O
2 2SO
3 SO
2+H
2O
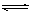 H
2SO
3
H
2SO
3
SO3+H2O═H2SO4 2H2SO3+O2═2H2SO4
二:浓硫酸
1.制备 S+O2 SO2 ;4FeS2+11O2
SO2 ;4FeS2+11O2 8SO2+2Fe2O3
8SO2+2Fe2O3
 2SO2+O2 2SO3 SO3+H2O═H2SO4
2SO2+O2 2SO3 SO3+H2O═H2SO4
2.脱水性
3.吸水性

 4.强氧化性 C+2H2SO4(浓)
4.强氧化性 C+2H2SO4(浓) CO2 +2SO2 +2H2O
CO2 +2SO2 +2H2O
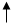 Cu+2H2SO4(浓)
Cu+2H2SO4(浓) CuSO4+SO2 +2H2O
CuSO4+SO2 +2H2O
5.高沸点酸制低沸点酸

 H2SO4(浓)+NaCl NaHSO4+HCl
H2SO4(浓)+NaCl NaHSO4+HCl
6.其它方程式
2H2S+O2═2H2O+2S 2H2SO4+O2═2H2SO4
H2S+Cl2═2HCl+S H2SO3+Cl2+H2O═H2SO4+2HCl
氮元素
一:一氧化氮
1.一氧化氮与氧气反应 2NO+O2═2NO2
2.NO与O2的混合气体通入水中 4NO+3O2+2H2O═4HNO3
二:二氧化氮
1.二氧化氮与水反应3NO2+H2O═2HNO3+NO
2.NO2与O2的混合气体通入水中 4NO2+O2+2H2O═4HNO3
三:氮气
 ①N2+3H2
①N2+3H2 2NH3 ②N2+O2 2NO
2NH3 ②N2+O2 2NO
 ③3Mg+N2 Mg3N2
③3Mg+N2 Mg3N2
四:“雷雨发庄稼”
 ①N2+O2 2NO ②2NO+O2═2NO2
①N2+O2 2NO ②2NO+O2═2NO2
② 3NO2+H2O═2HNO3+NO
五:氨气
 1.与水反应 NH3+H2O NH3·H2O
1.与水反应 NH3+H2O NH3·H2O

 (NH3·H2O NH4++OH- NH3·H2O
(NH3·H2O NH4++OH- NH3·H2O NH3 +H2O)
NH3 +H2O)
2.氨气与酸反应
NH3+HCl═NH4Cl NH3+HNO3═NH4NO3
2NH3+H2SO4═(NH4)2SO4
 3.氨气的工业制法 N2+3H2 2NH3
3.氨气的工业制法 N2+3H2 2NH3
 4.铵盐 ①NH4Cl
4.铵盐 ①NH4Cl NH3 +HCl
NH3 +HCl
 ②2NH4Cl+Ca(OH)2═2NH3 +CaCl2+2H2O
②2NH4Cl+Ca(OH)2═2NH3 +CaCl2+2H2O
六:硝酸


 1.不稳定性 4HNO3 2H2O+4NO2 +O2
1.不稳定性 4HNO3 2H2O+4NO2 +O2
因为NO2,所以浓硝酸略显黄色。出去黄色:
4NO3+O2+2H2O═4HNO3
2.强酸性 电离方程式 HNO3═H++NO3-
①使指示剂变色
②与碱(氢氧化钠)发生中和反应
HNO3+NaOH═NaNO3+H2O
③与碱性氧化物反应 2HNO3+CuO═Cu(NO3)2+H2O
③ 与某些盐(碳酸钠)反应
 2HNO3+Na2CO3═2NaNO3+H2O+CO2
2HNO3+Na2CO3═2NaNO3+H2O+CO2
3.强氧化性
 Cu+4HNO3(浓)═Cu(NO3)2+NO2 +2H2O
Cu+4HNO3(浓)═Cu(NO3)2+NO2 +2H2O
4.具有强氧化性的浓硝酸一定程度上具有漂白性
5.硝酸的工业制法
 4NH3+5O2 4NO+6H2O(氨的催化氧化)
4NH3+5O2 4NO+6H2O(氨的催化氧化)
2NO+O2═2NO2 3NO2+H2O═2HNO3+NO
