课时提升作业(三十九)
(40分钟 100分)
一、单项选择题(本大题共8小题,每小题5分,共40分。在每小题给出的四个选项中,只有一个选项符合题目要求)
1.只能用排水法收集的气体是( )
A.H2 B.NO C.CH4 D.C3H8
2.下列物质中既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.Cl2 B.NH3 C.H2S D.O2
3.制备Fe(OH)3胶体,下列操作方法能使之成功的是( )
A.把Fe2O3粉末放在水中加热至沸
B.氯化铁溶液中加少量氨水
C.把约30 mL蒸馏水加热至沸,滴入几滴浓氯化铁溶液
D.在约30 mL蒸馏水中加数滴氯化铁浓溶液
4.(2013·珠海模拟)在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.CCOCO2Na2CO3溶液
B.CuCu(NO3)2溶液Cu(OH)2
C.FeFe2O3Fe2(SO4)3溶液
D.CaOCa(OH)2溶液NaOH溶液
5.用如图所示装置制取表中的四种干燥、纯净的气体(图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
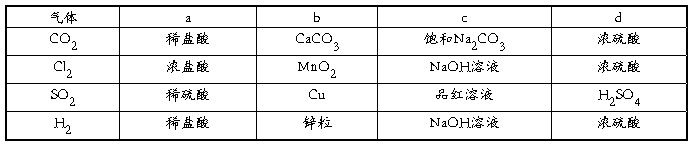
上述方法中可以得到干燥、纯净的气体是( )
A.CO2 B.Cl2 C.SO2 D.H2
6.(2013·温州模拟)有如下几种制备气体的方案:
①用稀硝酸与锌粉反应制氢气;②用水与过氧化钠固体反应制氧气;③常温下用铁片和浓硫酸制备二氧化硫;④氧化钙与浓氨水反应制氨气。不宜采用的方案有
( )
A.①③ B.②③ C.③④ D.①④
7.下列制取二氧化碳的装置中,不能做到“随时控制反应的发生与停止”的是
( )
8.(2013·株洲模拟)已知:酸式乙二酸钠与浓硫酸共热时反应为
HOOC—COONa+H2SO4(浓)NaHSO4+CO2↑+CO↑+H2O。
利用该反应所产生的气体(X)及下列有关仪器装置进行以下实验:
下列说法不正确的是( )
A.对装置Ⅰ,关闭活塞K2,打开活塞K1,在导管D处能得到纯净而干燥的CO
B.当A选项反应完成后,再关闭活塞K1,打开活塞K2,在导管D处能得到纯净而干燥的CO2
C.利用装置Ⅰ中D处所得的纯净CO,通过实验装置Ⅱ能够说明CO具有还原性
D.实验装置Ⅲ与实验装置Ⅱ相比较,能减少CO的污染,能顺利完成氧化铁还原实验
二、双项选择题(本大题共2小题,每小题6分,共12分。在每小题给出的四个选项中,有两个选项符合题目要求)
9.(2013·深圳模拟)下图是一套实验室制取气体的装置,用于制取、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是( )
A.MnO2和浓盐酸
B.Na2SO3(s)和浓硫酸
C.铜片和浓硝酸
D.浓氨水和生石灰
10.(2013·广州模拟)下列实验装置图正确的是( )
A.装置①可用于做HCl喷泉实验
B.装置②可用于吸收HCl气体,并防倒吸
C.装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2等气体
三、非选择题(本大题共3小题,共48分)
11.(14分)利用如图装置收集以下8种气体:
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO
⑦H2S ⑧SO2
(1)若烧瓶是干燥的,则由A口进气,B口出气,可收集的气体有 。(填气体代号,下同)
(2)若烧瓶充满水,可收集的气体有 ,这时气体由 口进入。
(3)若在烧瓶内装入浓硫酸,进行气体干燥,则可用此装置的气体有 ,这时气体由 口进入。
(4)若烧瓶是干燥的,不能用此装置收集的气体是 。
12.(16分)(能力挑战题)某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O。他们设计了如下制取氯气并验证其性质的实验。
试回答:(1)该实验中A部分的装置是 (填写装置的序号)。
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式
。
(4)该实验存在明显的缺陷,请你提出改进的方法
。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2Na2S4O6+ 2NaI反应完成时,共用去Na2S2O320.0 mL。则该漂白粉中Ca(ClO)2的质量分数为: 。
13.(18分)(能力挑战题)(2013·梅州模拟)碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式
。
(2)上图装置中NaOH溶液的作用是
。
(3)步骤二中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外),水浴加热的优点是
。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是 。
答案解析
1.【解析】选B。NO易被空气中的氧气氧化,只能用排水法收集。H2、CH4、C3H8不与空气中的成分反应,且密度与空气有明显的差异,故可用排气法收集。
2.【解析】选D。Cl2和H2S均可被碱石灰吸收,而氨气可被浓硫酸吸收,氧气与浓硫酸和碱石灰均不作用,故既能用浓硫酸干燥,又能用碱石灰干燥的是氧气。
【方法技巧】气体除杂的四条原则:
(1)不损失主体气体,即被干燥的气体不能与干燥剂发生化学反应;
(2)不引入新的杂质气体;
(3)在密闭装置内进行;
(4)先除去易除的杂质气体。
3.【解析】选C。Fe2O3难与水发生反应,A项错误;氯化铁溶液加氨水形成的是Fe(OH)3沉淀,B项错误;把约30 mL蒸馏水加热至沸,滴入几滴浓氯化铁溶液,可发生水解反应,生成的氢氧化铁胶粒分散到溶液中形成胶体。
4.【解析】选D。A项中制取Na2CO3溶液的步骤繁琐,且生成的CO不便收集,故A项不正确;B项涉及贵重试剂,不经济,故该项不正确;铁在氧气中燃烧产物是四氧化三铁,故C项不正确;D项制取NaOH溶液所用试剂经济易得,原理正确,步骤简洁,故D项正确。
5.【解析】选D。CO2可与饱和碳酸钠溶液反应,Cl2可与氢氧化钠溶液反应,稀硫酸不与铜反应,故A、B、C三项均不正确。
6.【解析】选A。①稀硝酸与金属反应一般不生成氢气,应用稀硫酸;③常温下浓硫酸能使铁钝化。
7.【解析】选A。A项装置当关闭止水夹时,继续反应生成的气体不能将盐酸完全排到漏斗中,反应物之间不能分离,反应不会停止,故不是“随时控制反应的发生与停止”的制气装置。
8.【解析】选D。对装置Ⅰ,关闭活塞K2,打开活塞K1,气体经过氢氧化钠溶液除去CO2,再经浓硫酸干燥,即能得到纯净而干燥的CO,故A项正确;B项中CO2与氢氧化钠溶液生成的碳酸钠溶液中加入稀硫酸生成CO2,故B项正确;纯净的CO通过实验装置Ⅱ,若红色粉末变为黑色或澄清石灰水变浑浊,都能够说明CO具有还原性,故C项正确;实验装置Ⅲ气体不能顺利进入硬质玻璃管,故D项不正确。
9.【解析】选B、C。MnO2与浓盐酸制Cl2需加热,A错;NH3是碱性气体,不能用浓硫酸干燥,且NH3密度小,不能使用向上排空气法收集,D错。
10.【解析】选A、C。HCl气体极易溶于水,利用装置①可做喷泉实验,A对;HCl直接通入水中易产生倒吸,装置②不可用于HCl的吸收,B错;Ca(OH)2与NH4Cl加热可产生NH3并可用碱石灰干燥,C对;CO2密度大于空气,可采用长管进,短管出的方法收集,D错。
11.【解析】(1)若烧瓶是干燥的,则由A口进气,B口出气,相当于向下排气法收集气体,可收集密度比空气小,且不与空气成分反应的气体,如H2、CH4、NH3等。
(2)若烧瓶充满水,A口进气,B口出气,则相当于排水集气法,可收集不与水反应,和不溶于水的气体,如H2、CH4、NO等。
(3)浓硫酸作干燥剂,洗气装置应从B口进气,A口出气。
(4)由于NO易与空气中氧气反应,而不能用该装置收集。
答案:(1)①③⑤ (2)①③⑥ A
(3)①②③④⑥⑧ B (4)⑥
【误区警示】(1)不仅与空气中成分反应的气体不能用排空气法收集,那些密度与空气接近的气体也不能用排空气法收集。
(2)如果将烧瓶口向下,在排气法收集相应气体时,进出气口应与瓶口向上时相反。
12.【解析】(1)该制备氯气的原理是固液加热,应选择b装置;(2)洗气瓶C中的Na2SO3若被氧化,就会含有硫酸根离子,检验硫酸根离子可加入稀盐酸和氯化钡溶液,看是否产生沉淀;(3)Cl2+HC====CO2+Cl-+HClO。(4)氯气有毒,不能直接排放到空气中,缺少尾气吸收装置。(5)漂白粉加入过量的KI溶液和过量的H2SO4溶液,反应为ClO-+2I-+2H+====I2+Cl-+H2O,结合2Na2S2O3+I2====Na2S4O6+2NaI可得:Ca(ClO)2→4Na2S2O3,250 mL溶液中Ca(ClO)2的物质的量为:0.02 L×
0.1 mol·L-1÷4×10=0.005 mol,漂白粉2.0 g中Ca(ClO)2的质量分数为35.75%。
答案:(1)b (2)取C中溶液少量,加入稀盐酸和氯化钡溶液,看是否产生沉淀
(3)Cl2+HC====CO2+Cl-+HClO
(4)增加尾气吸收装置 (5)35.75%
13.【解析】(1)铜与浓硝酸反应生成NO2,其离子方程式为Cu+4H++2N====Cu2++
2NO2↑+2H2O。
(2)NO2有毒可与氢氧化钠溶液反应生成硝酸盐和亚硝酸盐。
(3)水浴加热可使被加热物体受热均匀,且温度易于控制。水浴加热所需仪器除了热源、夹持仪器、石棉网外,还必须有烧杯、温度计。
(4)Cu2(OH)2CO3分解反应方程式为Cu2(OH)2CO32CuO+CO2↑+H2O,
用差量法求解
Cu2(OH)2CO32CuO+CO2↑+H2O 差量
222 160 62
m 2.42 g-1.80 g=0.62 g
=
解得m=2.22 g
样品中碱式碳酸铜的质量分数=×100%≈92%。
答案:(1)Cu+4H++2N====Cu2++2NO2↑+2H2O
(2)吸收氮氧化物
(3)烧杯 温度计 受热均匀,温度易于控制
(4)92%
第二篇:【20xx-20xx学年高中数学(人教A版,必修一) 第二章基本初等函数 2.2.1第1课时 课时作业
www.ks5u.com
§2.2 对数函数
2.2.1 对数与对数运算
第1课时 对 数
课时目标 1.理解对数的概念,能进行指数式与对数式的互化.2.了解常用对数与自然对数的意义.3.掌握对数的基本性质,会用对数恒等式进行运算.
1.对数的概念
如果ax=N(a>0,且a≠1),那么数x叫做__________________,记作____________,其中a叫做__________,N叫做______.
2.常用对数与自然对数
通常将以10为底的对数叫做____________,以e为底的对数叫做____________,log10N可简记为______,logeN简记为________.
3.对数与指数的关系
若a>0,且a≠1,则ax=N?logaN=____.
对数恒等式:alogaN=____;logaax=____(a>0,且a≠1).
4.对数的性质
(1)1的对数为____;
(2)底的对数为____;
(3)零和负数__________.
一、选择题
1.有下列说法:
①零和负数没有对数;
②任何一个指数式都可以化成对数式;
③以10为底的对数叫做常用对数;
④以e为底的对数叫做自然对数.
其中正确命题的个数为( )
A.1 B.2 C.3 D.4
2.有以下四个结论:①lg(lg 10)=0;②ln(ln e)=0;③若10=lg x,则x=100;④若e=ln x,则x=e2.其中正确的是( )
A.①③ B.②④
C.①② D.③④
3.在b=log(a-2)(5-a)中,实数a的取值范围是( )
A.a>5或a<2
B.2<a<5
C.2<a<3或3<a<5
D.3<a<4
4.方程=的解是( )
A.x= B.x=
C.x= D.x=9
5.若loga=c,则下列关系式中正确的是( )
A.b=a5c B.b5=ac
C.b=5ac D.b=c5a
6.的值为( )
A.6 B.
C.8 D.

二、填空题
7.已知log7[log3(log2x)]=0,那么=________.
8.若log2(logx9)=1,则x=________.
9.已知lg a=2.431 0,lg b=1.431 0,则=________.
三、解答题
10.(1)将下列指数式写成对数式:
①10-3=;②0.53=0.125;③(-1)-1=+1.
(2)将下列对数式写成指数式:
①log26=2.585 0;②log30.8=-0.203 1;
③lg 3=0.477 1.
11.已知logax=4,logay=5,求A=的值.
能力提升
12.若loga3=m,loga5=n,则a2m+n的值是( )
A.15 B.75
C.45 D.225
13.(1)先将下列式子改写成指数式,再求各式中x的值:
①log2x=-;②logx3=-.
(2)已知6a=8,试用a表示下列各式:
①log68;②log62;③log26.
1.对数概念与指数概念有关,指数式和对数式是互逆的,即ab=N?logaN=b(a>0,且a≠1),据此可得两个常用恒等式:(1)logaab=b;(2) =N.
2.在关系式ax=N中,已知a和x求N的运算称为求幂运算;而如果已知a和N求x的运算就是对数运
算,两个式子实质相同而形式不同,互为逆运算.
3.指数式与对数式的互化
§2.2 对数函数
2.2.1 对数与对数运算
第1课时 对 数
知识梳理
1.以a为底N的对数 x=logaN 对数的底数 真数 2.常用对数 自然对数 lg N ln N 3.x N x 4.(1)零 (2)1 (3)没有对数
作业设计
1.C [①、③、④正确,②不正确,只有a>0,且a≠1时,ax=N才能化为对数式.]
2.C [∵lg 10=1,∴lg(lg 10)=0,故①正确;
∵ln e=1,∴ln(ln e)=0,故②正确;
由lg x=10,得1010=x,故x≠100,故③错误;
由e=ln x,得ee=x,故x≠e2,所以④错误.]
3.C [由对数的定义知?
?2<a<3或3<a<5.]
4.A [∵=2-2,∴log3x=-2,
∴x=3-2=.]
5.A [由loga=c,得ac=,
∴b=(ac)5=a5c.]
6.C [()-1+log0.54=()-1·()=2×4=8.]
7.
解析 由题意得:log3(log2x)=1,
即log2x=3,
转化为指数式则有x=23=8,
∴====.
8.3
解析 由题意得:logx9=2,∴x2=9,∴x=±3,
又∵x>0,∴x=3.
9.
解析 依据ax=N?logaN=x(a>0且a≠1),
有a=102.431 0,b=101.431 0,
∴==101.431 0-2.431 0=10-1=.
10.解 (1)①lg=-3;②log0.50.125=3;
③log-1(+1)=-1.
(2)①22.585 0=6;②3-0.203 1=0.8;③100.477 1=3.
11.解 A=·()=.
又∵x=a4,y=a5,∴A==1.
12.C [由loga3=m,得am=3,
由loga5=n,得an=5.
∴a2m+n=(am)2·an=32×5=45.]
13.解 (1)①因为log2x=-,所以x==.
②因为logx3=-,所以=3,所以x=3-3=.
(2)①log68=a.
②由6a=8得6a=23,即=2,所以log62=.
③由=2得=6,所以log26=.
