高中化学方程式总结
邱威严
注:由于反应条件不方便打出,因此在后面括号标出(未标表示没有条件)
第一部分 无机方程式
1、钠与空气常温下反应
4Na+O2==2Na2O
2、钠再空气中加热(过氧化钠为黄色固体)
2Na+O2==Na2O2(加热或点燃)
3、钠与水反应(现象浮、游、熔、响、红)
2Na+2H2O==2NaOH+H2↑
4、铁与水蒸气反应
3Fe+4H2O(g)==Fe3O4+4H2(加热)
5、铝与氢氧化钠溶液反应
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
2Al+2OH-+2H2O==2AlO-+3H2↑
6、氧化钠与水反应
Na2O+H2O==2NaOH
7、氧化钠与二氧化碳反应
Na2O+CO2==Na2CO3
8、过氧化钠与水反应(反应放出大量的热)
2Na2O2+2H2O==4NaOH+O2↑
9、过氧化钠与二氧化碳反应(应用于防毒面具与潜水艇制氧气)
2Na2O2+2CO2==2Na2CO3+O2
10、碳酸钠(俗称:苏打、纯碱)与盐酸反应(注意“互滴”时的现象)
少量盐酸:Na2CO3+HCl==NaCl+NaHCO3 CO32--+H+==HCO3-
NaHCO3+HCl==NaCl+H2O+CO2↑ HCO3-+H+==H2O+CO2↑
过量盐酸:Na2CO3+2HCl==2NaCl+H2O+CO2↑
CO32-+2H+==H2O+CO2↑
11、碳酸氢钠(俗称:小苏打)与盐酸反应
NaHCO3+HCl==NaCl+H2O+CO2↑
HCO3-+H+==H2O+CO2↑
12、向碳酸钠溶液中通入二氧化碳
Na2CO3+H2O+CO2==2NaHCO3
CO32-+H2O+CO2==2HCO3-
13、碳酸钠加热分解
2NaHCO3==Na2CO3+H2O+CO2↑(加热)
14、碳酸氢钠溶液加入氢氧化钠
NaHCO3+NaOH==Na2CO3+H2O
HCO3-+OH-==CO32-+H2O
15、氧化铝与盐酸反应
Al2O3+6HCl==2AlCl3+3H2O
Al2O3+6H+==2Al3++3H2O
16、氧化铝与氢氧化钠溶液反应
Al2O3+2NaOH==2NaAlO2+H2O
Al2O3+2OH-==2AlO2-+H2O
17、实验室制取氢氧化铝(用可溶性铝盐和氨水反应)
Al2(SO4)3+6NH3·H2O==2Al(OH)3↓+3(NH4)2SO4
Al3++ 3NH3·H2O ==Al(OH)3↓+3NH4+
18、氢氧化铝与盐酸反应
Al(OH)3+3HCl==AlCl3+3H2O
Al(OH)3+3H+==Al3++3H2O
19、加热氢氧化铝分解
2Al(OH)3==Al2O3+3H2O(加热)
20、偏铝酸钠溶液与盐酸反应
NaAlO2+HCl+H2O==NaCl+Al(OH)3↓
AlO2-+H++H2O==Al(OH)3↓
21、偏铝酸钠溶液中通入二氧化碳
二氧化碳少量:2NaAlO2+CO2+3H2O==Na2CO3+2Al(OH)3↓
2AlO2-+CO2+3H2O==CO32-+2Al(OH)3↓
二氧化碳过量:NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3
AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-
22、氧化亚铁与盐酸反应
FeO+2HCl==FeCl2+H2O
FeO+2H+==Fe2++H2O
23、氧化铁与盐酸反应
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+6H+==2Fe3++3H2O
24、四氧化三铁与盐酸反应
Fe3O4+8HCl==FeCl2+2FeCl3+4H2O
Fe3O4+8H+==Fe2++2Fe3++4H2O
25、硫酸亚铁与氢氧化钠反应
FeSO4+2NaOH==Fe(OH)2↓+Na2SO4
Fe2++2OH-==Fe(OH)2↓
26、实验室制取氢氧化铁(红褐色)
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
Fe3++3OH-==Fe(OH)3↓
27、氢氧化亚铁被氧化(现象:灰白色沉淀迅速变成灰绿色最终变成红褐色)
4Fe(OH)2+O2+2H2O==Fe(OH)3
28、Fe3+的检验(生成血红色物质 切记不是沉淀)
Fe3++3SCN-==Fe(SCN)3
29、铁离子与铜反应(常用于腐蚀印刷电路板)
2FeCl3+Cu==2FeCl2+CuCl2
2Fe3++Cu==2Fe2++Cu2+
30、铁离子与锌反应
锌少量:2FeCl3+Zn==2FeCl2+ZnCl2 2Fe3++Zn==2Fe2++Zn2+
锌过量:2FeCl3+3Zn==2Fe+3ZnCl2 2Fe3++3Zn==2Fe+3Zn2+
31、氯化铁溶液里加铁粉
2FeCl3+Fe==3FeCl2
2Fe3++Fe==3Fe2+
32、氢氧化铁加热分解
2Fe(OH)3==Fe2O3+3H2O(加热)
33、用氢氟酸雕刻玻璃
SiO2+4HF==SiF4↑+2H2O
34、二氧化硅与氢氧化钠反应(因此保存氢氧化钠溶液应用橡胶塞)
SiO2+2NaOH==Na2SiO3+2H2O
35、制取硅酸(硅酸钠水溶液成为水玻璃)
Na2SiO3+2HCl==H2SiO3(↓)+2NaCl(沉淀符号可加可不加,以学校为准)
SiO32-+2H+==H2SiO3(↓)
36、水玻璃中通入二氧化碳(可以验证碳酸酸性比硅酸强)
Na2SiO3+H2O+CO2==Na2CO3+H2SiO3(↓)
SiO32-+H2O+CO2==CO32-+H2SiO3(↓)
注意:若二氧化碳过量则生成碳酸氢盐
37、实验室制取氯气
MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O(加热)
38、磷与氯气反应
氯气少量:2P+3Cl2==2PCl3
氯气足量:2P+5Cl2==2PCl5
(PCl3为液态,PCl5为固态)
39、氯气与水反应
Cl2+H2O==HClO+HCl
40、氯气光照分解
2HClO==2HCl+O2↑(光照)
41、氯气通入氢氧化钠溶液中(生成物为84消毒液主要成分)
Cl2+2NaOH==NaClO+NaCl+H2O
Cl2+2OH-==ClO-+Cl--+H2O
42、将氯气通入石灰乳中制漂白粉(漂白粉主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙)
Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
43、漂白粉工作原理
Ca(ClO)2+2HCl==2HClO+CaCl2
ClO-+H+==HClO
44、漂白粉再空气中变质(可证明碳酸酸性强于次氯酸)
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
Ca2++2ClO-+CO2+H2O==CaCO3↓+2HClO
注意:若二氧化碳过量则生成碳酸氢盐
45、高锰酸钾与浓盐酸反应
2KMnO4+16HCl(浓)==2KCl+2MnCl2+5Cl2↑+8H2O
46、卤素之间的置换反应
Cl2+2Br-==Br2+2Cl-
Cl2+2I-==I2+2Cl-
Br2+2I-==I2+2Br-
47、硫与氧气点燃
S+O2==SO2(点燃)
48、二氧化硫溶于水
SO2+H2O==H2SO3(可逆号)
49、用氢氧化钠吸收二氧化硫
SO2+2NaOH==Na2SO3+H2O
SO2+2OH-==SO32-+H2O
50、向亚硫酸钠溶液中继续通入二氧化硫
Na2SO3+SO2+H2O==2NaHSO3
SO32-+SO2+H2O==2HSO3-
51、二氧化硫与氧化钙反应
SO2+CaO==CaSO3(高温)
52、氯水中通入二氧化硫,漂白性消失
Cl2+2H2O+SO2==H2SO4+2HCl
Cl2+2H2O+SO2==4H++SO42-+2Cl-
52、实验室制取二氧化硫
Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O
53、工业制硫酸
2SO2+O2==2SO3(可逆号)(催化剂、加热)
SO3+H2O==H2SO4
54、三氧化硫与氧化钙反应
SO3+CaO==CaSO4
55、用熟石灰吸收三氧化硫
SO3+Ca(OH)2==CaSO4+H2O
56、向硫化氢的水溶液(俗称氢硫酸)中通入二氧化硫
2H2S+SO2==3S↓+2H2O
57、硫化氢与氧气反应
氧气少量:2H2S+O2==2S↓+2H2O(点燃)
氧气足量:2H2S+3O2==2H2O+2SO2(点燃)
58、硫于氢氧化钠反应
3S+6NaOH==2Na2S+Na2SO3+3H2O
3S+6OH-==2S2-+SO32-+3H2O
59、二氧化硫和过氧化钠反应
SO2+Na2O2==Na2SO4
60、大气固氮(NO是无色无味气体,有毒)
N2+O2==2NO(高温或放电)
61、一氧化氮被氧化(NO2是红棕色有刺激性气味有毒气体)
2NO+O2==2NO2
62、二氧化氮溶于水
3NO2+H2O==2HNO3+NO
63、一氧化氮与氧气4:3溶于水
4NO+3O2+2H2O==4HNO3
64、二氧化氮与氧气4:1溶于水
4NO2+O2+2H2O==4HNO3
65、工业制氨气
N2+3H2==2NH3(可逆号)(高温高压催化剂)
66、氨气溶于水
NH3+H2O==NH3·H2O(可逆号)
67、氨气和氯化氢反应(产生白烟)
NH3+HCl==NH4Cl
68、碳酸氢铵(俗称碳铵)加热分解
NH4HCO3==NH3↑+H2O↑+CO2↑(加热)
69、硝酸铵与氢氧化钠混合加热
NH4NO3+NaOH==NaNO3+H2O+NH3↑(加热)
70、实验室制取氨气
2NH4Cl+Ca(OH)2==CaCl2+2H2O+2NH3↑(加热)
71、氨的催化氧化
4NH3+5O2==4NO+6H2O(催化剂、加热)
72、浓硫酸和铜反应
Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O(加热)
73、铁与浓硫酸加热
2Fe+6H2SO4(浓)==Fe2(SO4)3+3SO2↑+6H2O(加热)
74、碳与浓硫酸反应
C+2H2SO4(浓)==CO2↑+2H2O+SO2↑(加热)
75、硫于浓硫酸反应
S+2H2SO4(浓)==3SO2↑+2H2O(加热)
76、硫化氢与浓硫酸反应
H2S+H2SO4(浓)==2H2O+SO2+S↓(加热)
77、铜与浓硝酸反应
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
Cu+4H++2NO3-==Cu2++2NO2↑+2H2O
78、铜与稀硝酸反应
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
79、浓硝酸与碳反应
C+4HNO3==CO2↑+4NO2↑+2H2O(加热)
80、硝酸见光分解
4HNO3==4NO2↑+O2↑+2H2O(光照或加热)
81实验室制取氯化氢
NaCl+H2SO4(浓)==NaHSO4+HCl↑(加热)
82、制取水煤气
C+H2O(g)==CO+H2(高温)
83、铝热反应
3Fe3O4+8Al==4Al2O3+9Fe(高温)
84、向氯化亚铁中滴入氯水
2FeCl2+Cl2==2FeCl3
2Fe2++Cl2==Fe3+
第二部分 有机方程式(必修部分)
1、烃燃烧
CxHy+(x+y/4)O2→xCO2+y/2H2O(点燃)
2、甲烷与氯气发生取代反应
CH4+Cl2→CH3Cl+HCl(光照)
CH3Cl+Cl2→CH2Cl2+HCl(光照)
CH2Cl2+Cl2→CHCl3+HCl(光照)
CHCl3+Cl2→CCl4+HCl(光照)
2、乙烯与溴水加成
CH2=CH2+Br2→CH2BrCH2Br
3、乙烯和氢气加成
CH2=CH2+H2→CH3CH3(一定条件)
4、乙烯与氯化氢加成
CH2=CH2+HCl→CH3CH2Cl(一定条件)
5、乙烯和水加成
CH2=CH2+H2O→CH3CH2OH(一定条件)
6、乙烯的加举反应
 (一定条件)
(一定条件)
7、苯燃烧
2C6H6+15O2→12CO2+6H2O(点燃)
8、苯与液溴取代
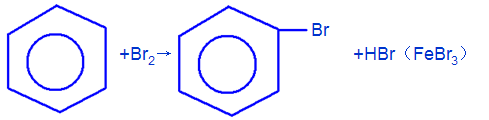
9、苯的硝化反应

10、苯与氢气加成

11、乙醇燃烧
CH3CH2OH+3O2→2CO2+3H2O(点燃)
12、乙醇与钠反应
2CH3CH2OH+2Na→2CH3CH2Na+H2↑
13、乙醇的催化氧化
2CH3CH2OH+O2→2CH3CHO+2H2O(Cu或Ag、加热)
14、乙醇与氧化铜反应
CH3CH2OH+CuO→CH3CHO+H2O(加热)
15、乙醇的消去反应(实验室制乙烯)
CH3CH2OH→CH2=CH2↑+ H2O(浓硫酸、170℃)
16、乙酸与镁反应
2CH3COOH+Mg→(CH3COO)2Mg+H2↑
17、乙酸与乙醇发生酯化反应
CH3COOH+ CH3CH2OH→CH3COOC2H5+H2O(可逆号)(浓硫酸、加热)
18、蔗糖水解
C12H22O11(蔗糖)+H2O→C6H12O6(葡萄糖)+C6H12O6(果糖)(稀硫酸、加热)
19、麦芽糖水解
C12H22O11(麦芽糖)+H2O→2C6H12O6(葡萄糖)(稀硫酸、加热)
20、淀粉水解
(C6H10O5)n(淀粉)+nH2O→nC6H12O6(葡萄糖)(稀硫酸、加热)
第三部分 电离水解方程式
1、醋酸的电离
CH3COOH==CH3COO-+H+(可逆号)
2、碳酸的电离
H2CO3==H++HCO3-(可逆号)
HCO3-== H++CO32-(可逆号)
3、氢氧化铁的电离
Fe(OH)3==Fe3++3OH-(可逆号)
4、碳酸根水解
CO32-+H2O==HCO3-+OH-
HCO3-+H2O==H2CO3+H2O
5、铁离子的水解
Fe3++3H2O==Fe(OH)3+3H+
6、碳酸根与铁离子双水解
3CO32-+2Fe3++3H2O==2Fe(OH)3↓+3CO2↑
7、碳酸氢根与铁离子双水解
3HCO3-+Fe3+==Fe(OH)3↓+3CO2↑
8、偏铝酸根与铝离子双水解
Al3++3AlO2-+6H2O==4Al(OH)3↓
9、水的电离
H2O==H++OH-(可逆号)
第四部分 电化学方程式
1、铜锌原电池(硫酸做电解液)
负极:Zn-2e-==Zn2+
正极:2H++2e-==H2↑
总反应:Zn+2H+==Zn2++H2↑
2、铅蓄电池(放电)
负极:Pb+SO42--2e-==PbSO4
正极:PbO+4H++SO42-+2e-==PbSO4+2H2O
总反应:PbO2+Pb+2H2SO4==2PbSO4+2H2O
3、铅蓄电池(充电)
阴极:PbSO4+2e-==Pb+SO42-
阳极:PbSO4+2H2O-2e-==PbO+4H++SO42-
总反应:2PbSO4+2H2O==PbO2+Pb+2H2SO4
4、氢氧燃料电池(酸性电解质溶液)
负极:H2-2e-==2H+
正极:O2+4e-+4H+==2H2O
总反应:2H2+O2==2H2O
5、氢氧燃料电池(碱性电解质溶液)
负极:H2-2e-+2OH-==2H2O
正极:O2+4e-+2H2O==4OH-
总反应:2H2+O2==2H2O
6、电解氯化铜溶液
阴极:Cu2++2e-==Cu
阳极:2Cl--2e-==Cl2↑
总反应:CuCl2== Cu+Cl2↑(电解)
7、电解氯化钠溶液(氯碱工业、工业制氯气)
阴极:2H++2e-==H2↑
阳极:2Cl--2e-==Cl2↑
总反应:2NaCl+2H2O==2NaOH+H2↑+Cl2↑(电解)
8、电解硫酸亚铁溶液
阴极:Fe2++2e-==Fe
阳极:4OH--4e-==O2↑+2H2O
总反应:2FeSO4+2H2O==2Fe+O2↑+2H2SO4(电解)
9、 电解氢氧化钠溶液
阴极:2H++2e-==H2↑
阳极:4OH--4e-==O2↑+2H2O
总反应:2H2O==2H2↑+O2↑(电解)
10、向铜上镀银(镀件做阴极,镀层金属做阳极,镀层金属盐溶液做电解质溶液)
阴极:Ag++e-==Ag
阳极:Ag-e-==Ag+
11、精炼铜反应(粗铜做阳极,精铜做阴极)
阴极:Cu2++2e-==Cu
阳极:Cu-2e-==Cu2+
12、析氢腐蚀
负极:Fe-2e-==Fe2+
正极:2H++2e-==H2↑
总反应:Fe+2H+==Fe2++H2↑
13、吸氧腐蚀
负极:2Fe-4e-==2Fe2+
正极:2H2O+O2+4e-==4OH-
总反应:2Fe+O2+2H2O==2Fe(OH)2
4Fe(OH)2+O2+2H2O==4Fe(OH)3
第五部分 选修三
1、制取银氨溶液
AgNO3+NH3·H2O==AgOH↓+NH4NO3
AgOH+2NH3·H2O==Ag(NH3)2OH+2H2O
Ag++ NH3·H2O===AgOH↓+NH4+
AgOH+2NH3·H2O==[Ag(NH3)2]2++2H2O+2OH-
2、制取四氨合氢氧化铜
Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3·H2O==[Cu(NH3)4]2++2OH-+4H2O
选修五方程式过于复杂,不方便打出,有需要的可以QQ和我联系!
甘城辉煌乐园救世主 (逃脱者)点兔
