高考总复习之高中化学方程式总结
(有下划线的方程式在信息题中会出现,不用死记,理解即可)
氯气

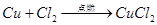
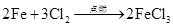

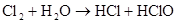

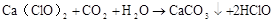
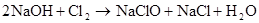
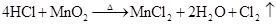 (制CI2)
(制CI2)
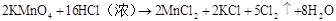

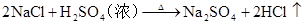
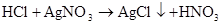
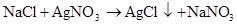

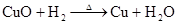
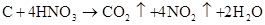
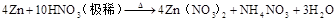

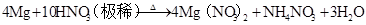
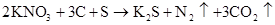
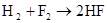
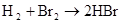
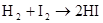
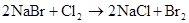
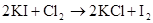
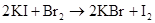
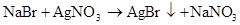
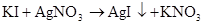

硫 硫酸
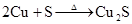
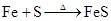

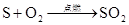
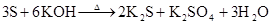
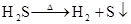
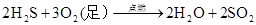



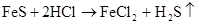 (制H2S)
(制H2S)
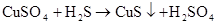
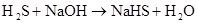
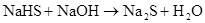
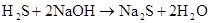 (前两个结合)
(前两个结合)
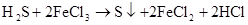
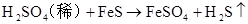 (制H2S)
(制H2S)

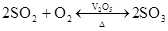
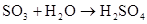
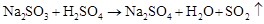 (制SO2)
(制SO2)
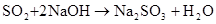
 (煤的脱硫)
(煤的脱硫)


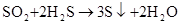

 (空气吹出法提溴)
(空气吹出法提溴)
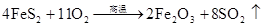
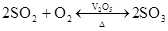
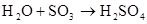 硫酸的工业制法(三步法)
硫酸的工业制法(三步法)
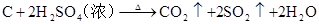
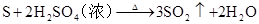

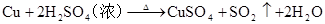
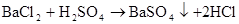
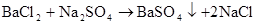
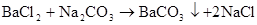

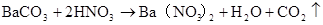
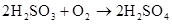

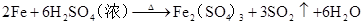
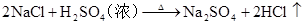
碱金属
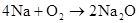
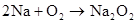

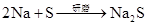
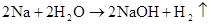
 (可分开写)
(可分开写)
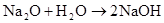
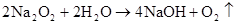
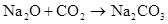
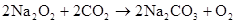

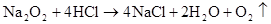

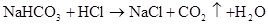

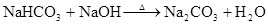

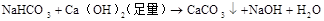
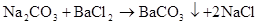

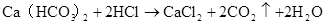
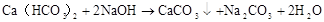

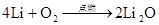
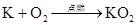
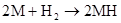 (M代表碱金属)
(M代表碱金属)
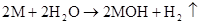
第六章 氮和磷
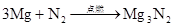
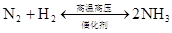
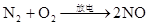
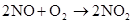
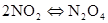 放热反应
放热反应

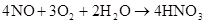
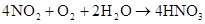

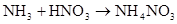
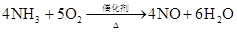
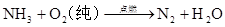
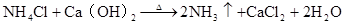
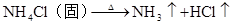

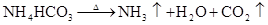

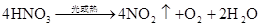


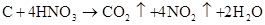
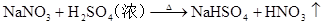
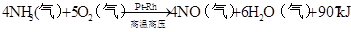
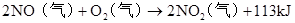
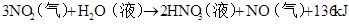
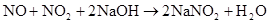
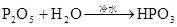
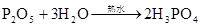
硅及其重要的化合物
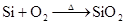
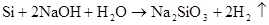
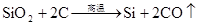
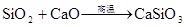
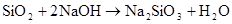
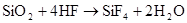 (HF酸腐蚀玻璃)
(HF酸腐蚀玻璃)
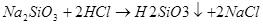

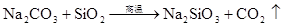
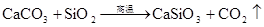
第二节 镁和铝的性质

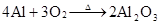

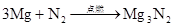
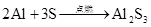
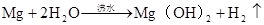
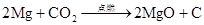

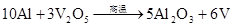
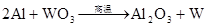


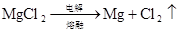
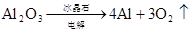

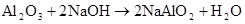
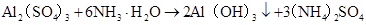
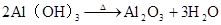
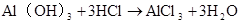
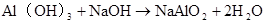
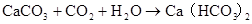
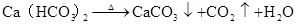
第一节 铁和铁的化合物
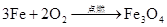
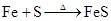

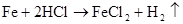
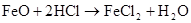
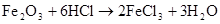
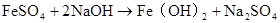
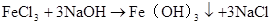
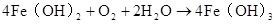
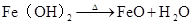
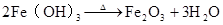
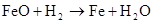
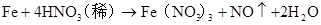
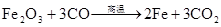
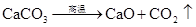
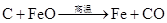
第二篇:高考化学方程式总结
高考常见化学方程式总结
非金属单质及其化合物
一、氯气及卤素的性质
1、F2、 Cl2的化学性质
F2 + H2 = 2HF (冷暗处 爆炸)
2F2 +2H2O=4HF+O2 (F2能置换O2 为较强的氧化剂)
(ClF+H2O==HF+HClO ClF属于类卤素,非氧化还原反应)
Cl2 + H2 2HCl (纯净H2在Cl2安静燃烧产物,遇空气形成酸雾,
混合点燃、加热、光照发生爆炸) 点燃 Cl2 + 2Na 2NaCl (白色的烟,溶于水为无色溶液) 点燃 3Cl2 + 2Fe
2FeCl3 (棕黄色的烟,溶于水呈黄色)
Cl2 + 2FeCl2 =2FeCl3 Cl2+2Fe2+===2Fe3++2Cl? 点燃 Cl2 + Cu
CuCl2 (棕黄色的烟,溶于水呈蓝绿色)
2Cl2+2NaBr=2NaCl+Br2 Cl2+2Br?=2Cl?+Br2
Cl2 +2NaI =2NaCl+I2 Cl2+2I?=2Cl?+I2
Cl2 +Na2S=2NaCl+S↓ Cl2+S2–=2Cl–+S↓
Cl2 +H2S =2HCl+S↓ Cl2+H2S=2H++2Cl–+S↓
Cl2+SO2 +2H2O=H2SO4 +2 HCl Cl2+SO2+2H2O=4H++SO42–+2Cl–
Cl2+H2O2=2HCl+O2 Cl2+H2O2=2H++Cl–+O2
Cl2+H2OHCl+HClO(加碱或光照促进歧化)
Cl2+H2OH++Cl–+HClO氯水成分:三分四离)
Cl2+2NaOH==NaCl+NaClO+H2O Cl2+2OH–=Cl–+ClO–+H2O
Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (漂白粉的制取)
3Cl2+6KOH(浓)5KCl+KClO3+3H2O
3Cl2+6OH–5Cl–+ClO3–+3H2O
Ca(ClO)2 + CO2 + H2O=CaCO3↓ + 2HClO(漂白原理)
Ca2++ 2ClO–+ CO2 + H2O=CaCO3↓ + 2HClO
2、氯气的制取
4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O 4H++2Cl–+MnO2Mn2++Cl2↑+2H2O
16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
16 H++10Cl-+2MnO4–=2Mn2++5Cl2↑+8H2O
6HCl+KClO3=KCl+3Cl2↑+3H2O
6H++5Cl–+ClO3–=3Cl2↑+3H2O
14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2↑+7H2O
14H++6Cl–+Cr2O72–=2Cr3++5Cl2↑+7H2O
3、次氯酸
不稳定性: 2HClO2HCl+O2↑(保存在棕色瓶中)
强氧化性:HClO+H2SO3=H2SO4+HCl
HClO+H2SO3=2H++SO42–+Cl–
二、碳和硅及其化合物
1、碳 点燃 点燃 2C+O2(少量) 2CO C+O2(足量) CO2 △ △ C+CO2 2CO C+H2O CO+H2(生成水煤气)
3C+CaOCaC2+CO↑ (工业上生产电石CaC2) △ 3C+SiO2 SiC+2CO↑ (工业上生产金刚砂SiC) △ C+2CuO Cu+CO2↑ (实验室还原氧化铜) △ C+2H2SO4(浓) CO2↑+2SO2↑+2H2O △ C +4HNO3(浓) 2↑+4NO2↑+2H2O
2、碳的氧化物 △ △ CO+CuO Cu+CO2 3CO+Fe2O3 2Fe+3CO2 点燃 2Mg + CO22MgO+C (CO2不能用于扑灭由Mg、Ca、Ba、Na、K等燃烧的火灾)
CO2+H2OH2CO3 H2CO3 H+ + HCO3– CO2+2NaOH(过量)==Na2CO3+H2O OH?+ CO2=CO32–+H2O
CO2(过量)+NaOH=NaHCO3 OH?+ CO2=HCO3–
CO2+Ca(OH)2(过量) =CaCO3+H2O Ca2++2OH?+CO2=CaCO3↓+H2O
2CO2(过量)+Ca(OH)2=Ca(HCO3)2 OH?+CO2=HCO3–
CO2+CaCO3+H2O=Ca(HCO3)2 CO2+CaCO3+H2O=Ca2++2HCO3–
CO2(不足)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3
CO2+3H2O+AlO2–=Al(OH)↓+CO32–
CO2(足)+NaAlO2+2H2O===Al(OH)3↓+NaHCO3
CO2+2H2O+AlO2– = Al(OH)3↓+HCO3– NaCl+NH3+ CO2 +H2O=
NaHCO3↓+NH4Cl (制碱法)
3、硅 △ 高纯硅的制取: 2C+SiOSi+2CO(制得粗硅) 2 △ △ Si(粗)+2Cl2 4 SiCl4+2H2 Si(纯)+4HCl) Si(粉)+O2 △SiO2 Si + F2=SiF4 Si +4HF=SiF4+2H2 Si+C △SiC(金刚砂) Si+2NaOH+H2O=Na2SiO3+2H2↑ Si+ 2OH?+H2O= SiO32― +2H2↑
4、二氧化硅 △ SiO2+4HF SiF4↑+2H2O (氢氟酸不能保存在玻璃瓶中)
SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)
SiO2+2OH? = SiO32― +H2O
SiO2+CaO高温CaSiO3 (炼钢造渣) 高温 SiO2+CaCO3 CaSiO3+CO2↑ (制取玻璃) 高温 SiO2+Na2CO3 Na2SiO3+CO2↑ (制取玻璃)
5、硅酸
H4SiO4H2SiO3+H2O H
2SiO3 SiO2↓+H2O
Na2SiO3 + 2 HCl= H2SiO3↓ + 2 NaCl SiO32― + 2 H+= H2SiO3↓
三、硫及其化合物
(1)硫
氧化性:S+H2H2S
S+Fe FeS (既能由单质制取,又能由离子制取)
S+2Cu Cu2S (只能由单质制取,不能由离子制取)
3S+2Al Al2S3 (只能由单质制取,不能由离子制取) 3S+6NaOH △
2Na2S+Na2SO3+3H2O (洗涤附着在试管上的硫) 3S+6OH?–2S2–+SO32–+3H2O
还原性: S+O2点燃SO2 S+6HNO3(浓)=H2SO4+6NO2↑+2H2O
S+4H++6 NO3?–=6NO2↑+2H2O+ SO42?
(2)二氧化硫
SO2 + 2H2S=3S↓+2H2O 2SO2+O22SO3
SO2+Ca(OH)2=CaSO3↓+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO2+ H2O2===H2SO4 SO2+ H2O2=2H++SO42?
2SO2+O2+2H2O=2H2SO4(SO2在大气中缓慢发生的环境化学反应)
(3)亚硫酸
SO2+H2OH2SO3 H
2SO3H2O+SO2↑(亚硫酸不稳定弱酸)
H2SO3+X2+H2O=H2SO4+2HX (X表示Cl2,Br2,I2)
H2SO3+X2+H2O=4H++SO42?+ 2X?
H2SO3+H2O2=H2SO4+H2O H2SO3+H2O2=2H++SO42?+H2O
2H2SO3+O2=2H2SO4 2H2SO3+O2=4H++SO42?
2Na2SO3+O2=2Na2SO4
(4)硫化氢(水溶液为氢硫酸,二元弱酸)
H2S H++HS? HS? H+ +S2? H2S H2+S
H2S+CuSO4=CuS↓+2HSO4 (唯一弱酸制取强酸, CuS极难溶于水)
2H2S+3O2(足量)=2SO2+2H2O (完全燃烧)
2H2S+O2(少量)=2S+2H2O (不完全燃烧)
(5)浓硫酸(酸性、吸水性、脱水性、强氧化性、高沸点性)
2H2SO4(浓)+CuCuSO4+SO2↑+2H2O
2H2SO4(浓)+CCO2 ↑ +2SO2↑+2H2O
2H2SO4(浓)+S=3SO2↑+2H2O
6H2SO4
(浓)+2FeFe2(SO4)3+3SO2↑+6H2O
(H2SO4(浓)、HNO3(浓)+Fe(Al) 室温或冷的条件下钝化)
H2SO4(
浓)+CaF2 CaSO4+2HF↑ (不挥发性酸制取挥发性酸)
四、氮 磷及其化合物
(1)氮气
自然固氮:N2+O2=2NO(放电) 2NO+O2=2NO2 (红棕色)
3NO2+H2O=2HNO3+NO(雷雨发庄稼原理) △ 催化剂 人工固氮: N2+3H2高温高压 2NH3 N2+3Mg Mg3N2
(2)氮氧化物
2NO+O2=2NO2 2NO2 (红色) N4O2 (无色)
NO+NO2+2NaOH=2NaNO2 (硝酸工业吸收尾气中的NO和NO2)
NO2+2KI+H2O=NO+I2+2KOH (不用淀粉KI溶液鉴别溴蒸气和NO2)
(3)氨气 +? NH3 + H2O △ NH·HONH + OH324 NH3·H2O NH3↑+H2O
2NH3+3CuO △ 3Cu+N2+3H2O (现象与氢气还原氧化铜一样)
2NH3+3Cl2=N2+6HCl 8NH3+3Cl2=N2+6NH4Cl
(化工生产中常用于检验 氯气管道是否漏气) 催化剂 4NH3+5O2△ 4NO+6H2O 2NH3+2Na=2NaNH2+H2
NH3+HCl=NH4Cl(白烟) NH3+HNO3=NH4NO3(白烟)
8NH3+ CaCl2=CaCl2 . 8NH3 (CaCl2不能干燥NH3)
NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl (侯氏制碱法)
2NH4Cl + Ca(OH)2 △CaCl2 + NH3↑ + H2O (4)铵盐 ( 易溶于水,不稳定受热易分解)
NH4ClNH3↑+HCl↑ NH4HCO3NH3↑+H2O+CO2↑ △ NH4+ + OH- NH3 + H2O (铵根离子的检验 ,湿润红色石蕊试纸变蓝) NH4Cl+H2ONH3·H2O+HCl (NH4+水解呈碱性)
NH4++H2OH++NH3·H2O
(5)硝酸
催化剂 催化剂 工业制取: N2+3H2
高温高压 2NH3 4NH3+5O2△ 4NO+6H2O
2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
不稳定性:4HNO3=4NO2+O2+2H2O (见光或受热分解,硝酸呈黄色)
4HNO3(浓)+CCO2↑+4NO2↑+2H2O
6HNO3(浓)+SH2SO4+6NO2↑+2H2O 4HNO3(浓)+Fe(足) Fe(NO3)2+NO2↑+2H2O 3+(先得到Fe,在Fe过量时再生成Fe2+的盐、常温钝化)
4HNO3(稀足)+FeFe(NO3)3+NO↑+2H2O
4H++NO3?+Fe=Fe3++NO↑+2H2O
Cu + 4HNO3(浓) =Cu (NO3)2+NO2↑+2H2O
Cu +4H++NO3?= Cu2++ NO2↑+2H2O
3Cu + 8HNO3(稀) = 3Cu (NO3)2+2NO↑+4H2O
3Cu +8H++2NO3?=3Cu 2++2NO↑+4H2O
金属单质 △
一、钠及其化合物
(1)钠
2Na+H2=2NaH NaH+H2O=NaOH+H2
4Na+O2=2Na2O 2Na2O+O2 △2Na2O2 △ 2Na+O2
Na2O2 2Na+S=Na2S(爆炸)
2Na+2H2O=2NaOH+H2↑
(2)钠的氧化物
Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+ O2↑
Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑
Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+2H2O+ O2↑
(3)钠盐
Na2CO3+HCl=NaHCO3+NaCl CO32?+ H+ =HCO3?
NaHCO3+HCl=aCl+H2O+CO2↑ HCO3?+H+=CO2↑+H2O?
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO32?+2H+=CO2↑+H2O
Na2CO3+BaCl2=CO3↓+2NaCl(沉淀溶于盐酸、沉淀消失)
CO32?+Ba2+=BaCO3↓ 2?2+Na2CO3+CaCl=CaCO↓+2NaCl CO+Ca=CaCO3↓ 233 △ 2NaHCO3 2CO3 + CO2↑+ H2O
Na2CO3+H2O+CO2=2NaHCO3 CO32?+H2O+CO2=2HCO3?
3NaHCO3+AlCl3=Al(OH)3↓+3CO2↑ (双水解反应)
3HCO3?+Al3+=2Al(OH)3↓+3CO2↑
3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl(双水解反应)
3AlO2?+Al3++6H2O=4Al(OH)3↓
NaHCO3+H2OH2CO3+NaOH HCO3–+H2OH2CO3+OH–
(NaHSO4不水解,NaHSO3电离大于水解)
Na2CO3+H2ONaHCO3+NaO 2–CO3+H2OHCO3–+OH– HCO3–+H2O H2CO3+OH–
(第一步远远大于第二步二步不能叠加)
二、铝及其化合物
1、铝 2Al+3Cl22AlCl3
4Al+3O2=2Al2O3 (常温生成致密氧化膜而钝化,在纯氧中燃烧)
2Al+Fe2O3Al2O3+2Fe (利用铝热反应焊接铁轨)
4Al+3MnO22Al2O3+3Mn (铝热反应制取高沸点金属)
2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2OH–+2H2O=2AlO2–+3H2↑
2、铝的氧化物 (Al2O3两性氧化物)
Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O
Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH―=2AlO2―+H2O
2Al2O3(熔融)4Al+2O2↑
3、铝的氢氧化物 ( Al(OH)3两性氧化物 )
碱式电离:Al(OH)3Al3++3OH?
酸式电离:Al(OH)3H++2AlO2―+H2O
Al(OH)3+ NaOH=NaAlO2+2H2O Al(OH)3+ OH–=AlO2–+2H2O
Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+ 3H+=2Al3++3H2O
2Al(OH)3Al2O3+3H2O
Al(OH)3的制取:
NaAlO2+CO2(足) +2H2O===Al(OH)3↓+NaHCO3
AlO2–+ CO2+2H2O=Al(OH)3↓+HCO3–
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
Al3++3NH3·H2O=Al(OH)2↓+3NH4+
3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl (双水解反应)
3AlO2–+Al3++6H2O=4Al(OH)3↓
2NaCl + 2H2O 电解 2NaOH + H2↑+ Cl2↑ (氯碱工业制取氯气) 电解 2Cl –+ 2H2O 2OH –+ H2↑+ Cl2↑
4、铝盐、偏铝酸盐
AlCl3+3NaOH=Al(OH)3↓+3NaCl Al3++ 3OH–= Al(OH)3↓
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl Al3++ 4OH–= AlO2–+2H2O
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
Al3++3NH3·H2O=Al(OH)3↓+3 NH4+
2AlCl3+3Na2CO3+3H2O=2Al(OH)3↓+3CO2↑+6NaCl
2Al3++3CO3 2?+3H2O=2Al(OH)3↓+3CO2↑
AlCl3+3H2OAl(OH)3+3HCl Al3++3H2OAl(OH)3+3H+
Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑ (碳化物 氮化物的水解)
三、铁及其化合物
(1)铁
2Fe+3Br2=2FeBr3 3Fe+2O
2 Fe3O4 Fe+I
2FeI2 Fe+SFeS (FeS既能由单质制备,又能由离子制备)
3Fe+4H2O(g)Fe3O4+4H2↑
Fe+CuCl2=FeCl2+Cu Fe+Cu2+=Fe2++Cu
Fe + 2FeCl3==3FeCl2 2Fe3++Fe=3Fe2+ 3+ (2)Fe 氧化性
2FeCl3+Cu =2FeCl2+CuCl2 2Fe3++Cu=2Fe2++Cu2+
2FeCl3+2KI =2FeCl2+2KCl+I2 2Fe3++2I-=2Fe2++I2
2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
2Fe3+ + SO2 + 2H2O =2Fe2++ SO42- + 4H+
Fe3+ + SCN― = [Fe(SCN)]2+ (Fe3+的检验,溶液变为血红色)
(3)、Fe2+的还原性:
6FeBr2+3Cl2=2FeCl 3+2FeBr3 (Cl2 少量时) 6Fe2+ + 3Cl2 = 6Fe3+ + 6Cl–
2FeBr2+3Cl2=2FeCl 3+2 Br2 (Cl2 少量时)
2Fe2 + 4Br― + 3Cl2=2Fe3+ +2Br2 +6Cl―
2FeCl2+3Cl2=2FeCl3 (在水溶液中不需加热) 2Fe2++Cl2=2Fe3++2Cl-
3FeCl2+4 HNO3=2FeCl3+ Fe(NO3)3+ NO↑ + 2H2O
3Fe2+ + NO3– + 4H+ = 3Fe3+ + NO↑ + 2H2O
(4)铁的氧化物
FeO+2HCl=FeCl2+3H2O FeO+2H –=Fe2++H2O +
FeO+4HNO3(浓)=Fe(NO3)3+NO2↑+2H2O
FeO+4H++ NO3–= Fe3+ +NO2↑+2H2O
Fe2O3+3H2=2Fe+3H2O (制还原铁粉)
Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+6H+=2 Fe3++3H2O △ Fe3O4+4H22O
Fe3O4+8HCl(浓) = FeCl2+2FeCl3+4H2O
Fe3O4+8H+= Fe2++2 Fe3++4H2O
(5)铁的氢氧化物
FeCl2+2 NaOH = Fe(OH)2↓ + 2NaCl Fe2+ + 2OH– = Fe(OH)2↓
FeCl3+3 NaOH = Fe(OH)3↓ + NaCl Fe3+ + 3OH–= Fe(OH)3↓
FeCl3+3NH3·H2O=Fe(OH)3↓+3NH4Cl Fe3+ + 3NH3·H2O= Fe(OH)3 ↓+ 3NH4+
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 △ 2Fe(OH)Fe2O3+3H2O 3
