Ⅱ实验内容
实验一 蛋白质的沉淀与凝固
蛋白质溶液是一稳定的亲水性溶胶液,其稳定的因素有二:一是蛋白质胶粒上的电荷使之相互排斥,不易凝集成团;二是胶粒表面的水化膜,它使胶粒与水融洽相依,又在胶粒之间起了隔离作用。如果上述两种稳定蛋白质溶液的因素被破坏,蛋白质将于溶液中沉淀析出。
促使蛋白质沉淀的因素很多,大致可分为两类:
第一类是可逆的沉淀反应。这时蛋白质的空间构象未受到很大改变,除去沉淀因素后,可以重新溶解,例如盐析和低温乙醇沉淀蛋白。
第二类是不可逆的沉淀反应,重金属盐类或生物碱试剂沉淀蛋白后,由于蛋白质结构发生重大改变,所以不再溶于水中。不可逆的蛋白质沉淀多表示蛋白质已经变性。变性的蛋白质在等电点附近加热时,蛋白质分子间相互盘绕而变成坚实的凝块。
一、 蛋白质的盐析
[原理]
高浓度的盐离子可与蛋白质胶粒争夺水化膜,同时盐又是强电解质,可抑制蛋白质的解离。因而用高浓度的中性盐,使蛋白质带电量减少,水化膜破坏而从溶液中沉淀出来。盐析沉淀蛋白一般不引起蛋白变性,故常用于分离各种天然蛋白质。
由于蛋白质的组成及性质不同,所以盐析时所需中性盐的浓度也不相同。例如半饱和的硫酸铵沉出球蛋白,饱和的硫酸铵则沉出清蛋白。
[操作]
1.取一试管,加入3ml 5%蛋白质溶液及3ml饱和硫酸铵溶液,摇匀静止数分钟后观察现象。
2.将试管内容物过滤,加硫酸铵粉末于滤液中,使达饱和状态,摇匀后观察现象。(注意固体硫酸铵若加到过饱和则有结晶析出,勿与蛋白质沉淀混淆。)
3.取上项浑浊液1ml,加水2ml,观察是否复容。
二. 乙醇沉淀蛋白质
[原理]
乙醇是脱水剂,可与蛋白质争夺水化膜;此外,加入乙醇可使水的介电常数变小,蛋白质解离度降低,带电量减少。故加入乙醇能破坏蛋白质的胶体性质而使蛋白质沉淀。用此法在低温下操作可使沉出的蛋白质保持其理化特性及其生物学活性,但室温中乙醇与蛋白质接触较久后,可使之变性,形成不可逆的沉淀。
[操作]
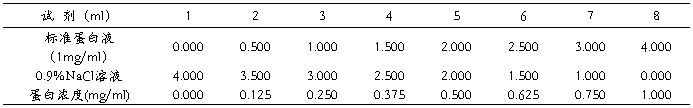
1. 取试管4支,标出1、2、3、4号码,按下表操作

2.将3管及4管置冰水中,放置5分钟,然后将第4管的冰乙醇倒入第3管中(此步最好在冰水中进行),混匀,同时向第1及第2管中各加入未冰浴的乙醇2ml混匀,观察各管的沉淀情况并立即向第1、2及3管中各加入蒸馏水10ml,混匀,比较各管变化并解释之。
三. 重金属盐沉淀蛋白
[原理]
在溶液的PH值大于蛋白质的等电点时,带负电荷的蛋白质与重金属离子(Ca2+、Hg2+、Ag1+、Pb2+等)结合成盐而沉淀。
[操作]
取试管4支,按下表操作。
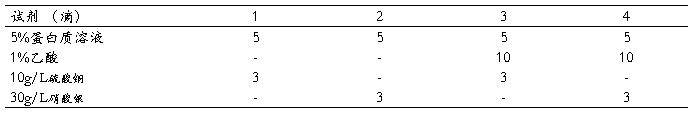
混合均匀,比较各管浑浊程度并解释之。
四. 生物碱试剂沉淀蛋白
[原理]
能沉淀生物碱(或植物碱)或与其产生颜色反应的物质称为生物碱试剂,如鞣酸、苦味酸、磷钨酸等。
在溶液的PH值小于蛋白质的等电点时,带正电荷的蛋白质与生物碱试剂的负离子结合成盐而沉淀。
[操作]
取试管3支,按下表操作。

混合均匀,比较各管浑浊程度并解释之。
五. 蛋白质的加热凝固
[原理]
蛋白质在其等电点附近加热,即发生变性凝固,在加热过程中,随着蛋白质变性作用的深化,使已变性的蛋白质分子间凝聚成凝胶状的蛋白块。但应注意,当蛋白质溶液远离等电点而带有很多同种电荷时,加热虽可使其变性,但因同种电荷的排斥作用并不发生凝固现象。
[操作]
取试管4支,按下表操作
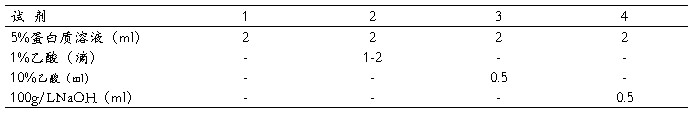
混匀后各管分别加热,观察有否沉淀析出及沉淀析出的多少、快慢并解释之。。另外在第2管加热蛋白沉出后再加入5ml蒸馏水,观察是否复溶,为什麽?
[试剂]
1.5%蛋白溶液:取出鸡蛋清用蒸馏水稀释5倍,搅匀后用纱布过滤。
2.饱和硫酸铵溶液。
3.硫酸铵结晶粉末。
4.95%乙醇。
5.1%乙酸和10%乙酸。
6.30g/L硝酸银溶液。
7.10g/L硫酸铜溶液。
8.100g/L氢氧化钠溶液。
9.苦味酸饱和溶液及鞣酸饱和溶液。
10.100g/L三氯乙酸溶液。
(李素婷)
实验三 微量凯氏定氮法
[原理]
蛋白质样品与浓硫酸共热时,分解出氮、二氧化碳和水,而氮转变为氨,氨与硫酸结合生成硫酸铵,再与纳氏试剂显色,与标准液比较,可求其含氮量。如测血清蛋白,可将总氮量减去非蛋白氮量,再乘以6.25即得蛋白质量。
[操作]
1.取血清或血浆0.2ml,以0.9%NaCl溶液稀释至10ml(稀释50倍)
2.取消化管1支,加入稀释血清0.5ml,50%硫酸0.5ml, 玻璃珠1枚,在电炉上消化。
3.当出现白雾并充满消化管时,消化管口加玻盖,再继续消化3分钟左右,冷却,加3%H2O21~2滴,再消化至出现白雾,加盖,继续消化至无色透明,完全冷却后加蒸馏水至17.5ml,再加纳氏试剂至25ml,混匀,与标准管比色。
4.标准管制备:取硫酸铵标准液(应用液)制备标准曲线,以蒸馏水作空白调零,500nm波长比色。
5.标准曲线制备:取硫酸铵标准液(应用液)制备标准曲线,取5支干净试管操作如下

混匀,各管加奈氏试剂1.5 ml, 以第1管为空白,用500nm波长比色得各管光密度值,以浓度为横坐标,测得各管光密度为纵坐标,作一标准曲线。
6.测得测定管的光密度值,于标准曲线上查出含氮量。
[计算]
蛋白质g %=含氮量´6.25´100
[试剂]
1.50%硫酸
2. 18N硫酸溶液:取比重1.84的分析纯浓硫酸50毫升慢慢加到50毫升蒸馏水中。
3. 3%H2O2
4. 0.9%NaCl
5. 奈氏试剂:
奈氏试剂贮存液:于500毫升锥形瓶内加入碘化钾150克,碘110克及蒸馏水100毫升和纯汞150克,振摇到碘色将变时(约15分钟),混合液发生高热,将锥型瓶放入冷水内继续振摇至棕红色的碘转变成带绿色的碘化钾汞溶液时为止。将上清液倾入2000毫升的量筒中,用蒸馏水洗涤瓶内壁及瓶内沉淀物数次,将洗液一并倾入量筒中,加蒸馏水至2000毫升。
奈氏试剂应用液:取10%氢氧化钠溶液700毫升,加入奈氏贮存液150毫升,摇匀,用蒸馏水稀释到1000毫升。如浑浊,可静止过夜,取上请液备用。
6.硫酸胺标准贮存液:(1毫升=1毫克氮)
取分析纯硫酸铵置烤箱中110oC,干燥半小时,取出置干燥器内待其冷却,准确称取干燥的硫酸铵4.716克,置1000毫升量瓶中,加蒸馏水300毫升使之溶解,加纯浓硫酸1毫升,再加蒸馏水至刻度。(NH4)2SO4分子量132.06;其氮占28。
故:132.06﹕28=4.716﹕X
X=1
即4.716克硫酸铵中含氮1克
7.硫酸铵标准应用液:
取硫酸铵标准贮存液1.0毫升,于100毫升容量瓶中,加纯硫酸0.1毫升,以蒸馏水稀释至刻度,于带磨口玻璃瓶中保存。
(周晓慧)
实验四 双缩尿法测定蛋白质含量
[原理]
凡含有两个以上肽键的化合物在碱性溶液中能与硫酸铜作用生成紫色或紫红色的复合物,这一反应称为双缩尿反应。蛋白质含有肽键,因而一切蛋白质均可与双缩尿试剂发生颜色反应,且颜色的深浅与蛋白质浓度成正比,经与同样处理的标准蛋白溶液相比,即可求出样品中的蛋白质含量。
[操作]
1.标准曲线的制备
取6支试管按下表配成不同浓度的标准蛋白液
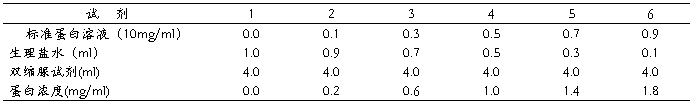
混匀后,于37℃水浴中保温15分钟,在520nm波长下比色,以第一管调零,测得各管的光密度。以各管的光密度值为纵坐标,以蛋白质浓度为横坐标,绘制标准曲线。
2.样品测定
取待测蛋白样品0.1ml,加生理盐水 0.9ml,再加双缩脲试剂4.0ml,于37℃水浴中保温15分钟,测其光密度,查标准曲线即可得出样品中的蛋白质含量。
[试剂]
1.10g/L标准蛋白溶液:准确称取经凯式定氮法校正的结晶牛血清蛋白或人血清蛋白10g,用生理盐水配成浓度为10mg /ml。
2.双缩尿试剂:称取CuSO4•5H2O 2.5g、蒸馏水100ml加热助溶。另取酒石酸钾钠10g、碘化钾5g,溶于500毫升蒸馏水中,再加200 g/L NaOH 300ml混合,然后将硫酸铜溶液倾入,加蒸馏水至1000 ml。
3.生理盐水
(周晓慧)
实验五 改良酚试剂法测定蛋白质含量
[原理]
蛋白质中所含酪氨酸和色氨酸等残基能在碱性条件下与酚试剂之磷钼酸、磷钨酸作用产生蓝色化合物,其颜色深浅与蛋白质含量成正比。
利用蓝色深浅与蛋白质浓度成正比的关系可绘制标准曲线,测定样品中蛋白质含量。
[操作]
(一)制作标准曲线
1.取试管6支分别编号,按下表加入试剂:

混匀后置于50°C水浴10分钟,冷却后各管加入试剂B 0.1ml,室温放置10分钟,各管加入试剂C 3ml,立即混匀,置37°C水浴箱恒温10分钟。冷却后以1号管为空白,在分光光度计上以波长650nm比色,读取光密度值。
2.以各标准样品蛋白质浓度为横坐标,各管光密度值为纵坐标作标准曲线。
(二)样品测定
取试管2支,按下表加入试剂
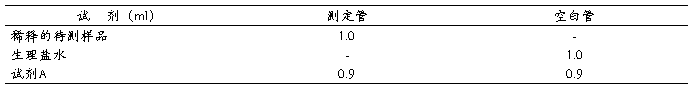
混匀后在50°C水浴箱中保温10分钟,取出冷却后,两管各加试剂B 0.1ml,室温放置10分钟,再各加试剂C 3ml,立即混匀,置37°C水浴箱保温10分钟,冷却后在分光光度计上以波长650nm比色读取光密度值。
[结果与计算]
根据测定管光密度值查标准曲线,由标准曲线计算样品蛋白质含量。
[注意事项]
1.测定蛋白质的浓度应在0.015~0.110mg/ml范围。
2.各管加酚试剂必须快速,并立即摇匀,不应出现混浊。
[试剂]
1.标准蛋白溶液:称量干燥的人血清白蛋白(BSA)或丙种球蛋白10mg,用生理盐水配制成1mg/ml的标准蛋白溶液。
2.试剂A:2g酒石酸钾钠及100g Na2CO3溶于500ml 1mol/L NaOH中,用蒸馏水稀至1000ml。
3.试剂B:2g酒石酸钾钠及1g CuSO4×5H2O分别溶解于少量水中,混合后加蒸馏水至90ml,再加10ml 1mol/L NaOH即成。
4.试剂C:
(1)市售的酚试剂,用1mol/L NaOH滴定相当于2.5 mol/L HCl,按1﹕10稀释即可。
(2)称取Na2WO4×2H2O 100g及Na2MoO4×2H2O 25g溶于700ml蒸馏水中,加入85% H3PO4 50ml,浓HCl 100ml混匀后,置圆底烧瓶中回流10小时,加入硫酸锂(Li2SO4×H2O)150g、蒸馏水50ml及浓溴水数滴,继续煮沸15分钟去溴,冷却后稀释至1000ml,过滤,溶液应为金黄色,置棕色瓶中保存,使用时稀释至1mol/L。
(周晓慧)
实验六 紫外分光光度法测定蛋白质含量
[原理]
蛋白质在280nm处的特征性吸收峰,是由于其中所含有的芳香族氨基酸:酪氨酸、色氨酸、苯丙氨酸所引起的,其光密度和蛋白质的浓度呈线性关系,可用于蛋白质的定量。对于同样浓度的不同蛋白质,如果酪氨酸、色氨酸及苯丙氨酸含量不同,其光密度值也不同,选用标准蛋白质时必须注意。若样品中含有其它具有紫外吸收的杂质,如核酸、核苷酸等,可产生较大的误差,故应作适当的校正。
蛋白质样品中含有核酸时,混杂的核酸在280nm处也有吸收,对此法有一定的影响。因此,一般情况下在测定A280的同时,测定A260,计算A280/A260 的比值。如果A280/A260≥1.5,可忽略不计核酸的影响,A280/A260<1.5时,需按下列公式计算蛋白质的浓度:
蛋白质浓度(mg/ml)=1.55A280-0.76A260
[操作]
1.标准曲线的制备:
取试管8支按下表加入试剂
混匀,选波长280nm,用1cm石英比色杯,第一管为空白,分别测定各管溶液光密度值。以蛋白浓度为横坐标,光密度值为纵坐标,绘制标准曲线。
2.样品测定:将待测的蛋白样品用0.9%NaCl溶液稀释,使其浓度在蛋白标准曲线范围之内,混匀后按上述方法测定光密度值,查标准曲线,得出样品的蛋白浓度。
[试剂]
1.标准蛋白液:准确称取结晶牛血清白蛋白 (精确0.001)用0.9% NaCl溶液配置成1mg/ml的溶液(需用凯氏定氮法校正)。
2. 0.9% NaCl溶液。
(周晓慧)
实验七 凝胶过滤层析分离血红蛋白与硫酸铜
[原理]
血红蛋白(分子量64500)与铜溶液混合物,通过葡聚糖凝胶G-25层析柱,以蒸馏水为洗脱剂,进行分离大分子的血红蛋白和小分子的硫酸铜。
[操作]
1.凝胶的准备:葡聚糖凝胶G-25 1g,置于锥形瓶中,加蒸馏水30ml,于沸水浴中煮沸2小时(或在室温放置6小时),待冷却至室温时装柱。
2.装柱:在层析管底部填少许玻璃棉,关闭玻管的出口。然后自顶部缓缓加入葡聚糖凝胶G-25悬液。
待底部凝胶沉积1~2cm时,打开出口。当凝胶上升至距柱顶3cm时即可。
3.样品的制备:
(1) 血红蛋白的制备:取草酸钾抗凝血2ml于离心管中,3000转/分离心5 分钟,弃去上清液,再用生理盐水洗血细胞两次。将血细胞用5倍体积蒸馏水稀释。
(2) 铜溶液的制备:将硫酸铜3.73g溶解于10ml热蒸馏水中,冷却后稀释到15ml。另取柠檬酸钠17.3g及碳酸钠(Na2CO3·H2O)10g,加水60ml,加热使之溶解,冷却后稀释到85ml。之后把硫酸铜溶液缓缓倾入柠檬酸钠-碳酸钠溶液中。
(3)取血红蛋白稀释液、铜溶液按2:3体积混合,作为样品。
4.加样:
(1)将层析柱出口打开,使床表面的蒸馏水流出,直到床面正好露出,再关闭出口。
(2)用小滴管将样品(约0.8ml)沿柱内壁缓缓地加于床面上,然后打开流出口,使样品进入床内,直到床面重新露出。
(3)用上述方法加入约2ml蒸馏水。当将近流干时,反复加入多量蒸馏水,进行洗脱,直至红蓝两条带分开为止。
[试剂]
1.葡聚糖凝胶G-25。
2.草酸钾。
3.生理盐水。
4.硫酸铜。
5.柠檬酸钠。
6.碳酸钠。
(王鲁华)
实验八 凝胶过滤层析分离血红蛋白与鱼精蛋白
[原理]
本试验使用交联葡聚糖凝胶(Sephadex G-50)将血红蛋白(红色,分子量为64500)与二硝基氟苯-鱼精蛋白,从混合液中分开。由于它们的分子量及颜色的不同,可以观察到血红蛋白洗脱较快,而鱼精蛋白洗脱较慢。
[操作]
1.凝胶的制备
称取Sephadex G-50 1g,置于锥形瓶中,加蒸馏水30ml,于沸水浴中煮沸1小时(此为加热法溶胀,如在室温溶胀,需浸泡3小时),取出冷却至室温后再行装柱。
2.装柱
取直径0.8~1.5cm,长度17~20cm的层析管,在底部填砂芯或少许玻璃棉,装上带有螺旋夹和细玻管的橡皮管,垂直置于铁架上,柱中先加入少量水,充满细玻璃管,并残留部分水于层析管下部,以排除层析柱底部及细玻管内的气泡。然后关闭玻管的出口,边轻轻搅拌以蒸馏水稀释的葡聚糖凝胶悬浮液,边将其自层析管顶部缓缓加入,待底部凝胶沉积1~2cm时,再打开出口,一面继续加凝胶,待凝胶上升至距玻管顶3cm左右即可停止,最后以蒸馏水平衡凝胶柱。加入凝胶时速度应均匀,并使凝胶均匀下沉,以免层析床分层,同时防止柱内有气泡。如层析床凝胶表面不平整,可在凝胶表面用细玻棒轻轻搅动,再让凝胶自然沉降,使表面平整。
3.样品的制备
(1)血红蛋白(Hb)溶液的制备:取草酸钾抗凝血2ml于离心管中,以2500r/min离心5分钟,弃去上层血浆,用0.9%NaCl 5ml洗血细胞,重复三次,每次要把血球搅起,以3500r/min离心5分钟后尽量弃去上清液。加蒸馏水5ml,充分混匀,放冰箱过夜使沉淀的血球充分溶血,备用。
(2)DNP-鱼精蛋白的制备:称取鱼精蛋白0.15g,溶于10%NaHCO3溶液1.5ml中(此时该蛋白质溶液pH应在8.5~9.0左右)。另取二硝基氟苯0.15g,溶于微热的95%乙醇3ml中,待其充分溶解后,立即倾入上述蛋白质溶液中。将此管置于沸水浴中,煮沸5分钟,冷却后加2倍体积的95%乙醇,可见黄色的DNP-鱼精蛋白沉淀。离心5分钟,弃去上清液,沉淀用95%乙醇洗2次,所得沉淀用1ml蒸馏水溶解,即为DNP-鱼精蛋白溶液,备用。
(3)取血红蛋白稀释液0.1ml,加DNP-鱼精蛋白溶液0.2ml,充分混匀,此混合液即为样品溶液。
4.加样
加样时先将层析管出口打开,使床表面蒸馏水流出,直到床面正好露出,用下口较大的滴管,将上述样品(约0.3ml)缓缓沿层析柱内壁小心地加于床表面,注意尽量不使床面搅动,然后打开出口,使样品进入床内,直到床面重新露出,重复上法加1~2倍于样品体积的蒸馏水,这样可使样品的稀释最小,而样品又完全进入床内。当少量蒸馏水将近流干时,加入蒸馏水使其充满层析柱上面空间,开始洗脱。
5.洗脱与收集
反复加入蒸馏水洗脱,调节出口处螺旋夹,使洗脱速度在0.5~1.0ml/分左右(约10~15滴/分)洗脱时可观察到黄、红两条区带逐渐分开,当红色的血红蛋白区带到达玻管下端时,用带刻度的离心管收集流出液,直至红色液全部流出为止,待测。再换以另一离心管,收集黄色的DNP-鱼精蛋白洗脱液,直至黄色液全部洗出为止,此液可回收重新使用。
[结果与计算]
取一试管吸取前述血红蛋白液0.1ml,加蒸馏水至5ml作为标准管(上柱前液),取收集的血红蛋白液加蒸馏水至5ml。以蒸馏水为对照,测得标准管及收集管液体在540nm波长处的光密度值,按下列公式计算血红蛋白的回收率。
血红蛋白回收率(%)=洗脱收集液光密度值/上柱前液光密度值 ×100%
[试剂]
1.Sephadex G-50
2.草酸钾抗凝血液
3.0.9%NaCl
4.鱼精蛋白
5.10%NaHCO3
6.2,4-二硝基氟苯
7.95%乙醇
(王鲁华)
实验九 血清蛋白醋酸纤维薄膜电泳
[原理]
血浆中的各种蛋白质,它们的等电点都在pH7.0以下,如将它们置于pH8.6的缓冲液中电泳时,它们都解离成负离子,向正极移动。在同一pH溶液中,由于各种蛋白质所带电荷的数量不同以及分子大小不同,因此它们在电场中的移动速度也有差别,利用这种性质可以把各种蛋白质分开。
醋酸纤维薄膜作为电泳支持物具有电渗小、分离速度快,区带清晰、操作简便等优点。醋酸纤维薄膜电泳可将血清蛋白分为白蛋白及α1-球蛋白、α2-球蛋白、β-球蛋白γ-球蛋白等5条区带。固定染色之后,不仅可看到清晰的色带,并可将各带染料溶于碱溶液中进行定量测定,从而计算出血清中各种蛋白质的构成比。
[操作]
1.准备与点样:
(1)将薄膜切成2×8cm的小条,在薄膜无光泽面距—端1.5cm处用铅笔画一横线,表示点样位置。
(2)将薄膜无光泽面向下,浸入巴比妥缓冲液中(缓冲液盛于培养皿中)。
(3)将充分渗透(指膜上没有白色斑痕)的膜条取出,用滤纸吸去多余的缓冲液,把膜条两端各贴于两块玻片上使点样线驾空。
(4)吸取少量血清滴于普通玻璃板上,用X光片或加样器的钢口蘸取样品,平直印于膜上,待血清全部渗入膜内,移开点样器。
2.电泳:将点样后的膜条置于电泳槽架上,放置时无光泽面(即点样面)向下,点样端置于阴极。槽架上四层纱布怍桥垫,膜条与纱布需贴紧,待平衡5分钟后通电,调节电压至90V,或电流为0.4~0.6mA/cm宽,通电1小时左右关闭电源。
3.染色:通电完毕后用镊子将薄膜取出,直接浸于盛有氨基黑10B的染色液中,染5分钟取出,首先用自来水冲洗一下,然后立即浸入盛有漂洗液的培养皿中,反复漂洗数次,直至背景变白为止。用滤纸吸干薄膜。
4.定量:
(1)取试管6支,编好号码,分别加入0.4mol/L氢氧化钠4ml。
(2)剪开薄膜上各条蛋白色带,另于空白部位剪—平均六小的薄牵,分别浸入上述试管内,不时摇动,使蓝色洗出。
(3)约半小时后,用分光光度计进行比色,在650nm波长下读取各管的光密度,用空白薄膜条洗出液为空白对照。
[计算 ]
光密度总和T=A+α1+α2+β+γ
各部分蛋白质的构成比为:
白蛋白=A/T;α1球蛋白=α1/T:依次类推。
[临床意义]
1.正常值:白蛋白为0.54~0.61;α1球蛋白为0.04~0.06;α2球蛋白为0.07~0.09;β球蛋白为0.10~0.13;γ球蛋白为0.17~0.22
2.肝硬化时,白蛋白显著降低,γ球蛋白升高2~3倍。肾病综合征时,白蛋白降低,α2、β球蛋白升高。
[试剂]
1.巴比妥缓冲液(pH8.6):巴比妥钠12.76g、巴比妥1.66g、蒸馏水加热溶解后再加水至1000ml(离子强度0.06)。
2,氨基黑10B染色液:氨基黑10B 0.5g、甲醇50 ml、冰醋酸10 ml、蒸馏水40 ml。
3.漂洗液:95%乙醇45 ml、冰醋酸5 ml、蒸馏水50 ml。
4.0.4mol/L NaOH。
(王文勇)
实验十一 血清γ-球蛋白的分离、纯化及鉴定
[原理]
为了研究蛋白质的性质、结构及功能,首先要从大分子体系中分离纯化这种蛋白质,并且须保持天然蛋白质原有的结构与生物学活性(即不变性)是比较复杂的,蛋白质分离主要是利用各种蛋白质性质的不同,尤其是蛋白质在不同酸、碱环境中的性质和电学性质的差异。分离蛋白质常用的方法有:盐析、层析、超离心、超过滤等,根据目的要求不同,可分别采用这些方法或几种方法配合使用。
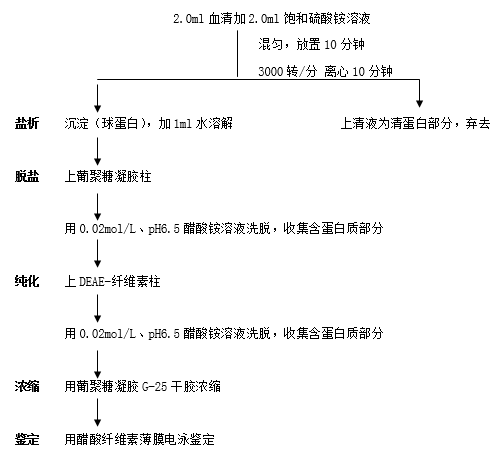
本实验以分离纯化血清γ-球蛋白为例,介绍一种蛋白质的分离纯化方法。过程包括:盐析、离心分离、凝胶层析、离子交换层析纯化、浓缩和电泳鉴定等几个步骤。
(一)盐析法粗提蛋白质
血清中含有清蛋白和球蛋白(a- b- g- 、球蛋白),由于它们所带电荷不同,分子量不同,在高浓度盐溶液中溶解度不同,因此,可利用它们在中性盐溶液中(常用硫酸铵、硫酸钠等)溶解度的差异而进行沉淀分离,此法称为盐析法。由于各种蛋白质分子的颗粒大小和亲水程度不同,故盐析所需的盐浓度不一,调节盐的浓度可使不同的蛋白质沉淀析出,达到分离目的。
本实验采用在血清中加入50%饱和度的硫酸铵,使球蛋白沉淀析出,清蛋白则仍溶解于溶液中,经离心分离获得沉淀部分,即为含有g-球蛋白的粗制品。
(二)凝胶过滤层析法脱盐
用盐析法分离而得到的蛋白质中含有大量的中性盐,会妨碍蛋白质的进一步纯化,因此必须首先去除。常用的方法有透析法、凝胶过滤层析法等。凝胶过滤层析法主要根据混合物中分子大小不同的各种物质,随流动相流经作为固定相的凝胶层析柱时,各种物质分子扩散移动速度不同使混合物中各种物质得到分离的技术。凝胶有多种,葡聚糖凝胶(Sephadex)是常用的一种人工合成的凝胶,脱盐用sephadexG-25层析柱,它的骨架是α-1,6-糖苷键联接成的直链葡聚糖,由环氧氯丙烷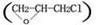 作交联剂制成的多孔网状结构的多聚物。结果大分子物质(蛋白质)直径大,不能进入凝胶颗粒的网孔中,垂直向下移动,速度快。而小分子物质(无机盐)可扩散入凝胶颗粒网孔中,流经的路程长、速度慢,从而使混合物中各组分按分子大小不同的顺序流出,蛋白质先流出,无机盐后流出,得到除去盐的蛋白质溶液
作交联剂制成的多孔网状结构的多聚物。结果大分子物质(蛋白质)直径大,不能进入凝胶颗粒的网孔中,垂直向下移动,速度快。而小分子物质(无机盐)可扩散入凝胶颗粒网孔中,流经的路程长、速度慢,从而使混合物中各组分按分子大小不同的顺序流出,蛋白质先流出,无机盐后流出,得到除去盐的蛋白质溶液
(三)离子交换层析纯化蛋白质
纯化蛋白质的方法很多,如各种层析方法:离子交换层析、凝胶层析、吸附层析及亲和层析等;各种电泳方法:可选用制备区带电泳、等电聚焦电泳及蛋白质结晶等。
本实验采用DEAE-纤维素[二乙基氨乙基,-CH2-CH2-N+H(CH2-CH3)2 ]离子交换层析法进一步纯化g-球蛋白。蛋白质是两性电解质,本实验所调整的溶液pH为6.5,此时溶液中的清蛋白pI 4.7、α-球蛋白pI 5.06、β-球蛋白pI 5.12皆带负电荷,而r-球蛋白pI 7.3带正电荷。DEAE-纤维素是一种阴离子交换树脂,本身带有正电荷,可与溶液中带负电荷的离子结合,如α-球蛋白、β-球蛋白等。而带正电荷的r-球蛋白则不能结合在树脂上,因而在洗脱的溶液中只留有r-球蛋白,以达到纯化的目的。
(四)浓缩
干燥的葡聚糖凝胶颗粒内部有孔隙容积。当把干燥的葡聚糖凝胶颗粒投入稀的高分子溶液中时水分和低分子量物质就会进入凝胶颗粒内部的孔隙直到充满为止,而高分子物质则排阻于凝胶颗粒之外,因此,经十几分钟后通过离心或过滤就可分离出膨胀的凝胶颗粒,得到浓缩了的高分子溶液。
利用葡聚糖凝胶G-25型干胶吸水膨胀,而不吸入蛋白质的特性,在已纯化的γ-球蛋白溶液中加入适量葡聚糖凝胶G-25型干胶。离心约5分钟(3000转/分)。上清液即为浓缩的γ-球蛋白溶液。
(五)电泳法鉴定(醋酸纤维素薄膜电泳法)
利用醋酸纤维素薄膜作为电泳支持物,将未分离纯化的原血清样品点样于膜上进行电泳时,可将血清蛋白分为清蛋白、α1、α2、 β及γ-球蛋白等5条区带,而用分离纯化后的γ-球蛋白溶液点样电泳,在γ-球蛋白相应位置仅呈现1条区带(电泳迁移率相同),将区带洗脱,或直接扫描,可计算出各种蛋白质的百分含量。
[操作]
(一)盐析粗提:
取正常人血清2.0ml于小试管中,边摇边缓慢加入饱和硫酸铵溶液2.0ml,使之成为半饱和溶液。混匀后室温放置10分钟,3000转/分,离心10分钟,弃去含有清蛋白的上清液。于沉淀中加蒸馏水1.0ml,振摇使之溶解,此液即为粗提的球蛋白溶液。
(二)脱盐:
1.凝胶处理:(老师准备),称取葡聚糖凝胶G-25型6.0g于小烧杯中,加100ml蒸馏水,置沸水浴1小时,并以玻璃棒轻轻搅动以使气泡逸出。冷却置室温,待凝胶大部下沉后,弃去含有细微悬浮凝胶颗粒的上清液。加蒸馏水约100ml轻轻搅动片刻,再弃去含有细微颗粒的上清液。加0.02mol/L pH 6.5醋酸铵溶液100ml。轻搅拌片刻,待大部分凝胶下沉后,弃去含有细微颗粒的上清液,再加醋酸铵溶液100ml重复处理一次,最后加入醋酸铵溶液20ml,此即为已溶胀备用的凝胶溶液。
2.装柱:取一层析管(1.5´20cm 或25ml碱式滴定管),垂直夹于铁架台上,关闭玻管出口,先加入醋酸铵溶液约10ml,,打开出口让硫酸铵溶液充满下部容器然后排出,以排除空气。关闭出口,自玻管顶部缓慢加入溶胀后的葡聚糖凝胶混悬液,边加边搅拌,保持凝胶均匀连续地沉降,当混悬液达玻管顶部时,打开出口,以螺旋夹控制流速10-20滴/分,继续加混悬液,待凝胶面上升至距玻管顶口3cm左右时即可停止,柱床面留一层液体。
3.平衡:用螺旋夹控制流速8-10滴/分,用醋酸铵溶液( pH6.5)流洗平衡几分钟后,即可使用。凝胶管柱上端平衡液始终不少于1cm高度,不得出现干胶和断层,并应保持凝胶面平整。
4.上样:即样品上柱,待层析液(醋酸铵溶液 pH 6.5)上端的液面刚好下降至凝胶表面时(切勿进入空气)将凝胶层析管下端的螺旋夹拧紧,这时将盐析所得的球蛋白溶液用滴管小心加入层析柱内,打开螺旋夹,用试管收集流出的液体,当球蛋白溶液恰好完全进入凝胶柱上端面内时,立即用2ml醋酸铵溶液小心冲洗管壁上的蛋白质,然后再重复冲洗一次。
5.洗脱:反复加入多量醋酸铵溶液进行洗脱,洗脱速度为10滴/分,每当试管内收集到1ml(约15滴)液体时,应取1滴置磁反应板上加入200g/L磺基水杨酸试剂检验有无蛋白质流出,如有则呈白色混浊。每收集1ml换一试管,并不断检查蛋白质,直到反应呈阴性为止。再分别从每个试管各取出1滴蛋白液置磁反应板上加入50g/L醋酸钡,直至检查出现白色的BaSO4沉淀为止,将含蛋白质而无硫酸铵的溶液合并,此即为已脱盐的球蛋白溶液,待进一步纯化。
6.凝胶的再生与保存:葡聚糖凝胶可柱内再生,故凝胶层析柱可重复使用,每次用完后以醋酸铵溶液进行充分洗涤,留待再用。为防止凝胶霉变,可用含0.02%叠氮化钠的醋酸铵溶液进行流洗后再放置。长时间不用,宜将凝胶从柱内倒出,以湿态保存,只要在其中加适当的抑菌剂如0.02%叠氮化钠置4oC冰箱内,可放置几个月至一年,不需要干燥。如凝胶柱有轻微污染,则可用0.2mol/LNaOH和0.5mol/LNaCl的混合液处理。
(三)纯化
1.DEAE-纤维素处理:称取DEAE-纤维素3.0g,加0.5mol/L盐酸溶液45ml,搅拌后放置30分钟,加蒸馏水250ml,搅匀,待纤维素大部分下沉后,弃去含有细微颗粒的上层液体,如此反复2-3次,用蒸馏水洗至流出液pH4.0,再加0.5mol/L氢氧化钠溶液45ml,搅拌后放置30分钟,弃取上层液体,再用蒸馏水洗至pH7.0,弃上层液体后加醋酸铵溶液约200ml,用1mol/L的醋酸调至pH6.5(约5ml),留待装柱。
2.装柱:与葡聚糖凝胶层析装柱法相同。
3.平衡:用pH6.5醋酸铵溶液、平衡的方法、时间同葡聚糖凝胶层析。
4.上样:将脱盐收集的球蛋白溶液上柱,方法过程与脱盐法相同。
5.洗脱:用pH 6.5醋酸铵溶液反复加入多量进行洗脱,流速20-30滴/分,方法与上述脱盐法相同,同样用200g/L磺基水杨酸检查有无蛋白流出。此次收集的即为纯化的γ-球蛋白溶液,留待浓缩及鉴定。
6.DEAE-纤维素的再生与保存:先用1.5mol/L NaCl-0.3mol/L NH4Ac溶液流洗几遍,再用0.02mol/L醋酸铵溶液(pH6.5)洗涤平衡后可重复使用。
(四)浓缩
将纯化后的γ-球蛋白溶液量其体积,每毫升加葡聚糖凝胶G-25干胶颗粒0.25g,吸收水分,摇动2-3分钟,离心5分钟(3000转/分),上清液即为浓缩的γ-球蛋白溶液,用吸管吸至另一个小试管中,留待电泳鉴定。
(五)电泳法鉴定
1.准备:在2´8cm醋酸纤维薄膜无光泽面距一端1.5cm处用铅笔轻划一条线,表示点样的位置。
2.浸泡醋酸纤维薄膜:将薄膜无光泽面向下,漂浮于巴比妥缓冲液面上,使膜条自然浸湿下沉,浸泡一般要大于2小时,最好过夜,充分浸透至膜上没有白色斑痕。
3.点样:将充分浸透的膜条取出,用滤纸吸去多余的缓冲液,吸取少量血清滴于玻片上,用X光片或加样器的钢口蘸取血清,平直印在点样线上,待血清完全浸入薄膜后移开。另点样一条膜条,吸取少量已纯化的γ-球蛋白溶液滴于玻片上,其它操作同上述血清点样。注意点样位置与血清薄膜一致,以便比较迁移率。
4.电泳:将点样膜条置于电泳槽上,使点样面向下,点样端置于阴极,槽架上用四层滤纸或两层纱布作桥架,膜条与滤纸需贴紧,平衡约5分钟后接通电源,调节电压100-110V,稳定电流为0.4-0.6mA/cm宽膜条,通电50-60分钟后关闭电源停止电泳。
5.染色:用镊子将电泳后的膜条取出,浸于盛有氨基黑10B 的染色液中,染色5分钟取出,先用蒸馏水冲一下,立即按顺序浸入不同杯的漂洗液中漂洗4-5次,直至薄膜背景漂净为止,用滤纸吸干薄膜。对照观察血清薄膜与γ-球蛋白薄膜两者的电泳区带分析结果。
血清γ-球蛋白分离、纯化及鉴定操作流程
[注意事项]
1.由于醋酸铵是挥发性盐类,故溶液配置时不得加热,配好后必须密封保存,以防pH及浓度发生改变,否则会影响所分离蛋白质纯度。
2.用HCl处理DEAE-纤维素时,时间不宜过长,否则DEAE-纤维素会发生变质。
[试剂]
1. 0.3mol/L醋酸铵溶液(pH 6.5):称取醋酸铵23.13g,加蒸馏水约800ml溶解,用酸度计准确调制节至pH6.5(用稀氨水或稀乙酸),再加蒸馏水定容至1000ml。
2. 0.02mol/L醋酸铵溶液(pH 6.5):取1液用蒸馏水稀释15 倍,在准确调整至pH6.5。
3. 1.5mol/L NaCl-0.3mol/L NH4Ac溶液:称取NaCl 87.7g,溶于0.3mol/L NH4Ac(pH6.5)中定容至1000ml。
4. 饱和硫酸铵溶液:称取固体硫酸铵850g,加入1000ml蒸馏水中,在70-80oC搅拌促溶,室温放置过夜,瓶底析出白色结晶,上清液即为饱和硫酸铵溶液。
5. 200g/L磺基水杨酸
6. 50g/L 醋酸钡:3.5ml HAc + 2.6g Ba(OH)2 + 蒸馏水至100ml。
7.0.5mol/L HCl溶液
8. 0.5mol/L NaOH溶液
9. pH8.6巴比妥缓冲液:称取巴比妥钠12.76g,巴比妥,1.66g 用蒸馏水加热溶解后,再加蒸馏水至1000ml。
10.氨基黑10B染液:称取氨基黑10B 0.5g 溶解于50ml甲醇中,再加冰醋酸10ml及蒸馏水40ml。
11.漂洗液:量取95%乙醇45ml,加冰醋酸5ml,蒸馏水50ml混匀。
12.葡聚糖凝胶G-25 (SephadexG-25)。
13.DEAE- 纤维素。
14.正常血清。
(周晓慧)
实验十二 动物肝组织中核酸的提取和鉴定
[原理]
动物组织中的核糖核酸(RNA)与脱氧核糖核酸(DNA)大部分与蛋白质结合形成核蛋白。肝组织中的核蛋白可用水提取,再用酚破坏核酸与蛋白质之间的结合键,并用乙醚抽提除去蛋白质及其它杂质,最后用乙醇将核酸沉淀。
核酸(RNA,DNA)可被硫酸水解产生磷酸、有机碱(嘌呤和嘧啶)及戊糖(核糖或脱氧核糖)。此三类化合物可用下列方法鉴定:
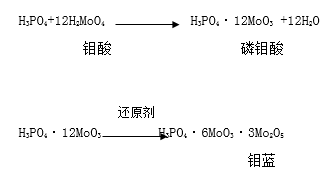
磷酸 能与钼酸试剂作用生成磷钼酸,后者在还原剂的作用下还原形成钼蓝,常用的还原剂有氨基苯磺酸、氯化亚锡、维生素C等。
嘌呤碱 能与苦味酸作用形成针状结晶。
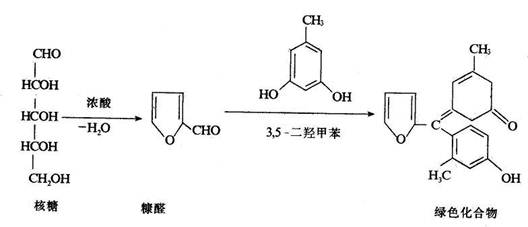
核糖 经与强酸(盐酸或硫酸)共热生成糠醛,后者与3,5-二羟甲苯(5-甲基-1,3-苯二酚,苔黑酚orcinol)反应,缩合而成绿色化合物。
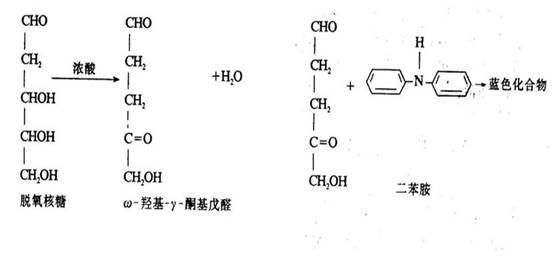
脱氧核糖 在强酸中加热可生成ω-羟基-γ-酮基戊醛,后者与二苯胺作用生成蓝色化合物。
[操作]
(一)动物肝组织中核酸的提取
1.将两只小白鼠处死,剖腹取出肝脏,用清水除去血液后置于研钵中(或用兔肝2-5g)加入净砂少许,研磨至糊状,再加蒸馏水3ml继续研磨3分钟。
1.再加入90%苯酚5ml,研磨10分钟后倒入一圆底离心管中,离心5分钟(约250r/min)。
3.将上层液体移于另一圆底离心管中,加乙醚2ml,管口覆盖聚乙烯薄膜后用拇指将管口按住,用力振摇1-2分钟(或用玻璃棒搅拌)。离心5分钟后吸取全部下层液体于另一圆底离心管中。
4.于该管中加入95%乙醇2ml,并用玻璃棒搅拌约2分钟,离心3分钟后倾去上清液,沉淀即为核酸。
(二)核酸的水解 在核酸沉淀管内加入5%硫酸4ml摇匀,置沸水浴中加热15分钟,即得核酸水解液。用流水冷却后进行下列定性实验。
(三)核酸组分的定性鉴定
1.磷酸的鉴定:取试管2支,编号,按下表加入试剂,摇匀,于沸水浴中2-3分钟,观察两管颜色之变化。

2.嘌呤碱的鉴定:取试管1支,加入饱和苦味酸约2ml,再加入核酸水解液4-6滴,摇匀,静置于室温中,观察有无黄色针状结晶出现。
3.核糖的鉴定:取试管两支,编号,按下表操作。

摇匀,于沸水浴中加热5分钟后,观察两管颜色的变化。
4.脱氧核糖的鉴定:取试管两支,编号,按下表操作。

摇匀,于沸水浴中加热10分钟,观察两管颜色的变化。
[注意事项]
1.在制备肝匀浆时要充分研磨,破坏肝组织。
2.肝组织可取自小鼠、家兔或猪肝,但以兔肝效果较好。以2公斤家兔计,兔肝重70g左右,每实验室仅需1只家兔。
3.实验中使用乙醚、乙醇等易燃溶剂,又要使用沸水浴,如用明火加热者应注意防火,以防发生事故。
[试剂]
1.90%苯酚溶液。
2.乙醚。
3.95%乙醇。
4.5%硫酸。
5.4%维生素C溶液(已氧化变质的维生素C不能用)。
6.钼酸试剂:钼酸铵5g溶于100ml蒸馏水中,再加入浓硫酸15ml。冷却后加蒸馏水至1000ml,冷处保存(一个月内不变质)。
7.饱和苦味酸溶液 苦味酸约1.3g,溶于100ml蒸馏水中,静置过夜。临用前取上清液。
8.拜耳(Bial)氏试剂 称取1.5g3,5-二羟甲苯,加入浓盐酸500ml,再加10%氯化高铁20至30滴。临用前配制,冰箱保存。
9.二苯胺试剂 取二苯胺1g溶于100ml冰乙酸(A.R.),加入2.75ml浓硫酸。临用前配制,储于棕色瓶中。
(王鲁华)
实验十三 动物组织中DNA的提取
[原理]
动物组织中的基因DNA均以脱氧核糖核蛋白的形式存在。在浓氯化钠(1~2mol/L)溶液中,脱氧核糖核蛋白的溶解度很大,而核糖核蛋白的溶解度很小。在稀氯化钠(0.14mol/L)溶液中,脱氧核糖核蛋白的溶解度很小,而核糖核蛋白的溶解度很大。因此,可利用不同浓度的氯化钠溶液,将脱氧核糖核蛋白和核糖核蛋白从样品中分别抽提出来。
将抽提得到的脱氧核糖核蛋白用SDS处理,使DNA与蛋白质分开,再用氯仿-异丙醇将蛋白质沉淀除去,而DNA溶于上层水相中,加入适量的95%乙醇,DNA钠盐即沉淀析出。为防止DNA酶解,提取时应加入EDTA二钠(乙二胺四乙酸)。
得到的样品中DNA含量可用二苯胺法定量测定。DNA分子中的脱氧核糖基,在酸性溶液中转变成ω-羟基-γ-酮基戊醛,与二苯胺试剂作用生成蓝色化合物,可用比色法测定。
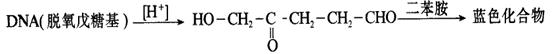

[操作]
1.DNA的分离纯化:
(1)将10只小白鼠迅速杀死,取出肝脏,用0.14mol/L NaCl-0.15mol/L EDTA二钠溶液洗去血液,剪碎,加入50ml 0.14mol/L NaCl-0.15mol/L EDTA二钠溶液,置于匀浆器中研磨,待成糊状后,将糊状物离心10分钟(4000r/min)弃去上清液,沉淀用0.14mol/L NaCl-0.15mol/L EDTA二钠溶液洗二三次。即重复加入50ml 0.14mol/L NaCl-0.15mol/L EDTA二钠溶液,搅匀,离心。所得沉淀为脱氧核糖核蛋白粗制品。
(2)向上述沉淀物加入0.14mol/L NaCl-0.15mol/L EDTA二钠溶液,使总体积为44ml,然后滴加25% SDS溶液3ml,边加边搅拌。加毕,置60oC水浴中保温10分钟(不停搅拌),溶液变得粘稠并且略透明,取出冷至室温。此步骤使核酸与蛋白质分离。
(3)加入5mol/L NaCl溶液10ml,使NaCl最终浓度为1mol/L,搅拌10分钟,加入约一倍体积氯仿-异丙醇混合液,振摇20分钟,离心10分钟(4000r/min)。沉淀与下层液弃去,取上层液加入1.5倍体积95%乙醇,边加边用玻棒搅拌,DNA丝状物即缠在玻棒上。
(4)将DNA粗品置于27ml 0.015mol/L NaCl-0.0015mol/L柠檬酸三钠溶液中,再加入3ml 1.5mol/L NaCl-0.15mol/L柠檬酸三钠溶液,搅匀。待丝状DNA重新溶解后,加入一倍体积氯仿-异丙醇混合液,振摇10分钟,离心(4000r/min)10分钟。可用氯仿-异丙醇反复抽提,直至界面处不再出现蛋白质凝胶为止。取出上层液加入1.5倍体积的95%乙醇,边加边搅拌,DNA丝状物即缠在玻棒上。
(5)取出丝状DNA,依次用80%、95%及无水乙醇各洗一次,真空干燥。留待定量测定。
2.鉴定
(1)标准曲线的绘制:
取干试管6支,编号,按下表加入试剂:
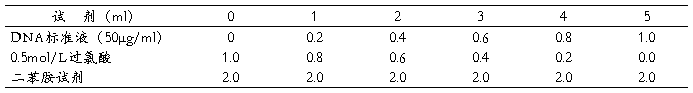
混匀,60oC恒温水浴中放置1小时。冷却后,于600nm波长处进行比色。以各管光密度为纵坐标,DNA含量为横坐标作图。
(2)样液测定:称取干燥的样品DNA 5mg溶于5ml 5mmol/L NaCl 溶液中,再按标准DNA溶液同法处理。然后,取1.0ml样液,加二苯胺试剂2.0ml,置60oC恒温水浴1小时,测定光密度。对照标准曲线求得DNA量。
[结果与计算]
按下式计算样品中DNA的百分含量:

[注意事项]
1.本实验也可用新鲜兔肝10g进行DNA的提取,本法提取的DNA已有一定程度的解聚。
2.其它糖及糖的衍生物、芳香醛、羟基醛和蛋白质等,对二苯胺显色反应有干扰,测定前应尽量除去。
3.样液中DNA含量应控制在50μg/ml左右。
4.如无匀浆器,可用研钵研磨破碎组织。
[试剂]
1.5 mol/L NaCl溶液:将29.23g NaCl溶于蒸馏水,稀释至100ml。
2. 0.14mol/L NaCl-0.15mol/L EDTA二钠溶液:溶8.18g NaCl及55.83g EDTA二钠于蒸馏水,稀释至1000ml。
3.25% SDS溶液:溶25g十二烷基硫酸钠于100ml 45% 乙醇。
4.氯仿-异丙醇混合液:氯仿:异丙醇=24﹕1(V/V)
5.1.5mol/L NaCl-0.15mol/L柠檬酸三钠溶液:氯化钠8.77g及柠檬酸三钠4.41g溶于蒸馏水,稀释至100ml。
6.0.015mol/L NaCl-0.0015mol/L柠檬酸三钠溶液:取10ml试剂5,稀释至1000ml。
7.80%乙醇。
8.95%乙醇。
9.无水乙醇。
10.二苯胺试剂:
A液:二苯胺(如不纯,需在10%乙醇中重结晶2次)1.5g,溶于100ml冰乙酸(A.R.),再加浓硫酸1.5ml,贮于棕色瓶。
B液:16mg乙醛溶于1.0ml蒸馏水,随用随配。
临用时,将20ml A液与0.1ml B液混合即得。
11.1mol/L过氯酸溶液:将10ml 过氯酸(70%)用蒸馏水稀释至110ml。
12.0.5mol/L过氯酸溶液:取50ml 1mol/L过氯酸,用蒸馏水稀释至100ml。
13.5mmol/L NaOH溶液:NaOH 0.02g溶于蒸馏水,稀释至100ml。
14.标准DNA母液:准确称取DNA5mg,溶于5ml 5mmol/L NaOH溶液中。4oC可保存6个月。
15.标准DNA溶液:吸取母液1.0ml加上1mol/L过氯酸1.0ml,70oC保温10分钟,冷却,离心(4000r/min),取1.0ml上清液,用0.5mol/L过氯酸稀释10倍,即得50μg/ml DNA标准溶液。
(王鲁华)
实验十四 动物组织中核酸含量的测定
核酸分子中含有戊糖、磷酸和含氮碱。一般测定核酸的方法,是测定三者中的任何一种成分即可计算核酸的含量。下面分别介绍测磷法、测糖法和紫外吸收法。
一、测磷法
[原理]
核酸的量可以用核酸的磷含量(RNA-P,DNA-P)来表示。纯的核酸含磷量为9%(RNA的磷含量为8.5~9.0%;DNA的磷含量为9.2%)。测得了核酸中磷的含量,即可求出核酸的含量。
用强酸使核酸分子中的有机磷消化成无机磷,与钼酸铵作用生成磷钼酸铵,再被还原剂还原成钼蓝,用比色测定。
在一定浓度范围内,蓝色的深浅和磷含量成正比,以此为定量依据。
样品中如有无机磷,应减去。
[操作]
1.磷标准曲线的绘制:取试管7支,按下表操作。

混匀,于45oC水浴中保温20分钟,冷却,在660nm波长下测定各管光密度。以磷含量为横坐标,光密度为纵坐标绘制出磷标准曲线。
2.核酸中总磷量的测定:取1ml被测样品液(约含2.5~5mg核酸,也可取固体样品)置于消化瓶中,加入1ml浓硫酸及50mg催化剂,在消化炉上加热至发白烟,样品由黑变成淡黄色,取下稍冷,加数滴30%过氧化氢液,继续加热至溶液呈无色或淡蓝色为止,稍冷却,加1ml水,于100oC加热10分钟,使焦磷酸转变为磷酸。冷至室温,用蒸馏水定容到50ml。与样品消化的同时做空白对照,空白瓶中不加样品,用水代替,其它完全相同。
取稀释后的消化液1ml,加水2ml,定磷试剂3ml,摇匀,45oC放置20分钟,于660nm处测定光密度值。空白对照同样操作。
3.样品中无机磷含量的测定:
取未消化的核酸样品液1ml用水定容到50ml。从中取1ml,加2ml水,3ml定磷试剂,摇匀后保温,然后测定光密度。
[计算]
有机磷的光密度值OD660 = 总磷OD660-无机磷OD660
以有机磷的光密度值从标准曲线上查出对应的磷含量μg,按下式计算样品中核酸的百分含量。
样品中核酸含量%=有机磷含量(μg)÷测定时的取样量(ml)×稀释倍数÷核酸的磷含量÷样品重量(μg)×100
[试剂]
1.标准磷试剂(含磷5μg/ml):准确称取恒重(105oC)的KH2PO4 0.4389g,用水定容到100ml,此液的浓度为1mg/ml,用前再稀释200倍,即为5μg/ml。
2.定磷试剂:
(1)6mol/L硫酸:取17ml浓硫酸(比重1.84)缓缓加入83ml水中。
(2)2.5%钼酸铵:2.5g钼酸铵溶于100ml水中。
(3)10%抗坏血酸溶液:取10g抗坏血酸溶于100ml水中。棕色瓶4 oC贮存。溶液应为淡黄色,深黄或棕色则不能用。
临用前,将6mol/L硫酸:2.5%钼酸铵:10%抗坏血酸溶液:水=1﹕1﹕1﹕2(V/V)混匀即可,用棕色瓶贮存。
3.催化剂:硫酸铜(CuSO4·5H2O):硫酸钾(K2SO4)=1:4(W/W),研成细末。
4.30%过氧化氢、浓硫酸。
二、测糖法
RNA含有核糖,DNA含有脱氧核糖,二种糖有不同的颜色反应,经过呈色反应后,所呈现的颜色深浅在一定范围内与样品中所含的糖量成正比。由于常用的测糖法只能测定核酸中与嘌呤相连接的糖,而不同来源的核酸含嘌呤、嘧啶的比例各不相同,故把测定的糖量来统一换算成核酸的含量很不正确。一般要求用与被测核酸同一来源的纯核酸作标准曲线,通过标准曲线再查出被测样品的核酸含量,这样可以把误差减到最小。
(一)RNA的定量测定(改良苔黑酚法)
[原理]
RNA和浓盐酸共热生成嘌呤碱基、核糖和嘧啶核苷酸。而核糖在浓酸中脱水环化生成糠醛,糠醛与苔黑酚(3,5-二羟甲苯)生成绿色化合物,在670nm处有最大光吸收。RNA浓度在5~50μg//ml范围内其含量与光密度值成正比。
样品中有蛋白质或粘多糖或大量DNA时对测定有干扰。其中蛋白质可用5%三氯乙酸沉淀后再行测定。有大量DNA存在时,加入适量的CuCl2·H2O可减少DNA的干扰。
[操作]
1.标准曲线的制作:取试管6支,按下表加入试剂。
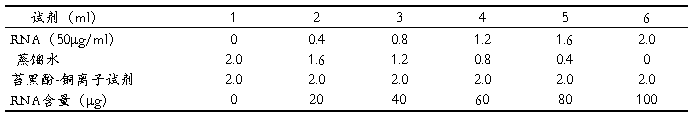
摇匀后于沸水浴中保温35分钟,冷却,在670nm波长下以1号管调零测定各管光密度OD670,以OD670 为纵坐标,RNA含量(μg)为横坐标作标准曲线。
2.样品中RNA含量的测定:取待测溶液2ml,加苔黑酚-铜离子试剂2ml,于沸水浴中保温35分钟,冷却,测其光密度。从标准曲线上查出待测样品中RNA的含量。
[试剂]
1.苔黑酚试剂:取5g苔黑酚溶于10ml95%乙醇中,此溶液为深红色,称为贮备液;取0.75g氯化铜(CuCl2·2H2O)溶于500ml 12mol/L HCl中,溶液呈深黄色。用前取贮备液2ml与100ml铜离子溶液混匀即可。
2.RNA标准溶液:用1mmol/LNaOH作溶剂,将RNA配成50μg/ml。
(二)DNA的定量测定(二苯胺法)
[原理]
DNA酸解后生成嘧啶核苷酸、嘌呤、磷酸和脱氧核糖。脱氧核糖在酸性条件下脱水生成ω-羟基-γ-酮基戊醛,它能与二苯胺反应生成蓝色复合物,其最大光吸收在595nm,可用比色法测定。样品中DNA浓度在50~500μg/ml范围内,其光密度值与DNA含量成正比。样品中若有少量RNA对测定结果影响不大,但镁盐、蛋白质、多糖及其衍生物、芳香醛对测定有干扰。
[操作]
1.标准曲线的制作:取试管6支编号,分别加入DNA标准溶液(500μg/ml)0,0.2,0.4,0.6,0.8,1.0ml,用水补足到1.0ml,再各加二苯胺试剂2.5ml,摇匀后置100oC水浴中保温10分钟,冷却后测OD595。以OD595为纵坐标,纯DNA含量(μg)为横坐标,绘制出标准曲线。
2.待测样品中DNA的测定:取DNA待测液1ml,加二苯胺试剂2.5ml,其余操作同上,测其OD595。从标准曲线上查出DNA的含量。
[试剂]
1.二苯胺试剂:取1g二苯胺溶于98ml冰醋酸中,加18mol/L H2SO4 2ml,冰箱4oC保存,当天使用。
2.DNA标准溶液,500μg/ml,可用水或5mmol/L NaOH作溶剂。其准确含量需用定磷法确定。
3.DNA待测溶液:可配成100~400μg/ml。
三、紫外吸收法
[原理]
核酸及其衍生物、核苷酸、核苷、嘧啶和嘌呤均有紫外吸收的性质。其吸收高峰在260nm波长处。核酸的摩尔消光系数用ε(P)来表示,ε(P)为 每升溶液中含有1克原子核酸磷的光吸收值(即A值,见下表)。测得未知浓度核酸溶液的A260值,即可计算出其中RNA或DNA的含量。该法操作简便、迅速,对样品无损。
核酸摩尔消光系数及相关值
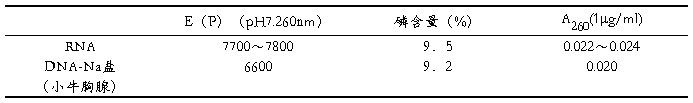
蛋白质和核苷酸等也有紫外吸收。通常蛋白质的吸收高峰在280nm处,在260nm处的吸收值仅为核酸的1/10或更低,因此对于含有微量蛋白质的核酸样品,测定误差较小。当样品中含有大量的蛋白质和核苷酸等紫外吸收物质时,应设法除去。
[操作]
1.准确称取样品若干,加入少量0.01mol/L NaOH调成糊状,再加适量水,用5%~6%氨水调至pH7.0,最后加水配成每毫升含5~50μg核酸的溶液,于紫外分光光度计上测定A260,计算核酸浓度。
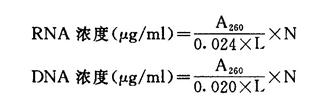
式中A260为260nm波长处光吸收值;
L为比色杯厚度,即光径,1cm;
N为稀释倍数;
0.024为每毫升溶液含1μg RNA的A260值;
0.020为每毫升溶液含1μg DNA的A260值。
2.如果待测溶液中含有酸溶性核苷酸或可透析的低聚多核苷酸,需在测定时加钼酸铵和过氯酸溶液沉淀剂,去除大分子核酸,上清液的A260值作为对照。
准确称取待测核酸样品0.50g,加少量0.01mol/L NaOH调成糊状,再加适量水,用5%~6%氨水调至pH7.0,定容至50ml。
取两支离心管,甲管加入2ml样品溶液和2ml蒸馏水,乙管加入2ml样品溶液和2ml沉淀剂,混匀,在冰浴上放置30分钟,以3000rpm离心10分钟。从甲、乙管中分别吸取0.5ml上清液,用蒸馏水定容至50ml,选光程为1 cm的比色杯,于260nm波长处测A260值。
[计算]

[试剂]
1.钼酸铵-过氯酸沉淀剂:取3.6ml 70%过氯酸和0.25g钼酸铵溶于96.4ml水中,即成0.25%钼酸铵-2.5%过氯酸溶液。
2.5%~6%氨水。
3.测试样品:RNA或DNA干粉。
(王鲁华)
实验十五 质粒的提取及酶切鉴定
一、质粒的提取(碱裂解法)
[原理]
在pH l2.0-12.6碱性环境中,线性的大分子量细菌染色体DNA变性,而共价闭环(CC)质粒DNA仍为自然状态。将pH调至中性并有高盐浓度存在的条件下,染色体DNA之间交联形成不溶性网状结构。大部分DNA和蛋白质在去污剂SDS的作用下形成沉淀,而CC质粒DNA仍然为可溶状态。通过离心,可去除大部分细胞碎片、染色体DNA、RNA及蛋白质,质粒DNA尚在上清中,再用酚、氯仿抽提进一步纯化质粒DNA。最后用乙醇将质粒从溶液中沉淀出来,并将质粒溶于蒸馏水中待用。
[操作]
1.收集细菌:取1.5ml菌液放入1.5ml的Eppendorf离心管中,12000g,离心30秒;或3500rpm,离心3分钟,将上清小心转移到专用烧杯中。
2.将细菌沉淀悬浮于100 μl冰预冷的溶液I中,强烈振荡混匀。
3.加入200 μl溶液Ⅱ,盖严管盖颠倒微型离心管5次以混合内容物。不要强烈振荡,放置冰上3分钟左右(根据不同菌株,可适当缩短)。
4.加入150 μl溶液Ⅲ,可以将管盖朝下温和振荡10秒钟,冰上放置3~5分钟。
5.12000g,4 oC下离心5分钟,取上清移至1个新Eppendorf管中。
6.加入等体积氯仿-异戊醇(24:1),振荡混匀,12000g,4 oC下离心2分钟,取上清移至另1个Eppendorf管中。
7.加入2倍容积乙醇(室温),振荡混匀,室温下放置2分钟(不要在-20 oC沉淀,否则有较多盐析出)。
8.12000g,4 oC离心10分钟。
9.弃上清,加入l ml 70%乙醇振荡漂洗沉淀(4oC), 12000g,离心2分钟(4 oC)。
10.弃上清,用消毒的滤纸小条小心吸净管壁上的乙醇水珠,将管倒置放在滤纸上,室温下蒸发痕量乙醇10~15分钟,或真空抽干乙醇2分钟。
11.用30~50μl TE或蒸馏水溶解质粒。
[试剂]
1.STE:
0.1mol/LNaCl
lOmmol/LTris·Cl(pH8.0)
lmmol/LEDTA
2.溶液I:
50mmol/L葡萄糖
25mmol/LTris·Cl(pH8.0)
10mmol/LEDTA
该溶液可配制成100ml,6.76×104Pa消毒15分钟,4oC贮存
3.溶液Ⅱ(新鲜配制):
0.2N NaOH
1%SDS
4.溶液Ⅲ:5mol/LKAc 60ml
冰醋酸11.5ml
水28.5ml
配制好的溶液III含3mol/L钾盐、5mol/L醋酸(pH4.8)、酚、氯仿、乙醇、TE.Rnase。
二、质粒的酶切急电泳鉴定
[原理]
提取出来的质粒有三种状态:共价闭环(CC)、开环(OC)和线形(L),它们在电泳时由于与荧光染料溴乙锭(EB)结合能力不一样,故泳动的速度是不同的,所以在凝胶中可以出现三条带,其中CC质粒在最前,L 质粒在最后。单酶切后,均为线形分子,电泳是只出现一条带。
[操作]
1.限制性酶切:取10 μl质粒提取液,放入Eppendorf 离心管中,加入5 μl 酶切缓冲液,加入 1 μl 具有单一切点的限制性核酸内切酶,用蒸馏水调至50μl,37 oC水浴保温一小时。
2.用热水或微波炉将事先制备好的琼脂糖凝胶融解,等凝胶的温度降至60 oC左右时,加入终浓度为0.5μg/ml的溴乙锭,制备0.6~0.8cm厚的平板胶,待凝固后使用。
3.将胶平放在电泳槽架上,到入电泳缓冲液,使液面稍稍没过胶面,拔出梳子。
4.分别取未酶切和酶切的质粒20μl,各加入4μl 6倍的上样缓冲液,混匀。
5.用微量移液器将溶液加入点样孔中。220V,电泳45~60分钟。
6.在紫外透射仪或手提式紫外灯下观察结果。
[试剂]
1.5×电泳缓冲液(TBE):
54g Tres碱;27.5g硼酸;20ml 0.5 mol/L EDTA(PH:8.0)
2.6×上样缓冲液:
0.25%溴酚蓝
40%(W/V)蔗糖溶液
3.10 mg/ml 溴乙锭
(王文勇)
实验十七 食物中维生素C的提取和定量
[原理]
维生素C又称抗坏血酸,食物和人体内有两种类型即还原型抗坏血酸和脱氢抗坏血酸。其中以还原型为主,新鲜水果和蔬菜中含量较为丰富。
维生素C溶于水,在空气中不稳定,遇碱、热和重金属离子易被氧化破坏,故常用无氧化作用的稀酸溶液作为提取液。
维生素C具有强还原性,能使2,6-二氯酚靛酚还原褪色。因此利用氧化型2,6-二氯酚靛酚可滴定还原型抗坏血酸的量,在酸性溶液中其终点为微红色。
反应式如下:
还原型抗坏血酸+氧化型2,6-二氯酚靛酚(碱性下蓝色,酸性下红色)
 脱氢抗坏血酸+还原型2,6-二氯酚靛酚(无色)
脱氢抗坏血酸+还原型2,6-二氯酚靛酚(无色)
[操作]
1.提取:取新鲜样品(白菜)10g,置研钵中,加20g/L草酸少许,充分研磨提取,如此研磨提取3~4次,几次提取液通过两层纱布滤入50ml的容量瓶中,最后用20g/L草酸稀释至刻度。如仍有浑浊可用滤纸再过滤一次。
2.脱色:如用有色样品,则需将提取液倒入干燥锥形瓶中,加白陶土一匙,充分振荡约5分钟,过滤。白陶土吸附生物样品中的色素,有利于终点的观察。
3.滴定:取三角瓶两个,各加脱色的的滤液10ml,用0.5mmol/L 2,6-二氯酚靛酚溶液滴定,直至出现微红色半分钟不褪为止,记录两份样品滴定的ml数,取其平均值。
[计算]
维生素C的含量(mg/100g样品)=滴定用2,6-二氯酚靛酚ml数×0.088×5×10
[注意事项]
1.提取液中尚含其它还原性物质如鞣质、半胱氨酸、谷胱甘肽等,均可与二氯酚靛酚反应,只因含量较少,可略而不计。
2.滴定宜迅速,以减少还原型抗坏血酸的氧化。
[试剂]
1.20g/L草酸。
2.白陶土
3.0.5mmol/L 2,6-二氯酚靛酚(每ml≡0.088mg维生素C):称取2,6-二氯酚靛酚2.5g溶于1000ml蒸馏水中,加碳酸氢钠2.1g,放置过夜。临用前过滤,用标准维生素C标定其浓度。
标准维生素C溶液(1ml ≡ 0.5mg):称取维生素C 25mg,溶于4%盐酸25ml,再用蒸馏水稀释到50ml。
吸取标准维生素C液1.0ml,加2%盐酸1ml,用配制的2,6-二氯酚靛酚滴定。然后将2,6-二氯酚靛酚稀释为每ml≡ 维生素C 0.088mg,贮于棕色瓶中。
(王鲁华)
实验十八 影响酶促反应的因素
一. 温度对酶活性的影响
[原理]
温度对酶的活性有显著影响。温度降低,酶促反应减弱或停止,温度升高,反应速度加快。当上升至某一温度时,酶促反应速度达最大值,此温度称为酶的最适温度。温度继续升高,反应温度反而迅速下降,至80℃时,酶活性几乎完全丧失。
本实验以唾液淀粉酶为例。唾液淀粉酶催化淀粉水解生成各种糊精和麦芽糖。
(C6H10O5)n→(C6H10O5)m→C12H22O11
淀粉 糊精m〈n 麦芽糖
淀粉溶液属胶体溶液,具有乳样光泽,与碘反应呈蓝色。糊精根据分子大小,与碘反应呈蓝、紫、红等不同的颜色。因此,可以用碘检查淀粉是否水解及其水解程度,间接判断淀粉酶是否存在及其活性大小。
[操作]
1.收集唾液:用少量蒸馏水漱口,收集唾液约2ml,用蒸馏水稀释5-10倍(根据各人的酶活性而定)。取小漏斗一支,垫小块脱脂棉,过滤稀释唾液,滤液备用。
2.取试管两支,各加稀释唾液2 ml,一管直接加热煮沸,另一管置冰浴中预冷5分钟,放置备用。
3.另取试管4支,编号,按下表操作。
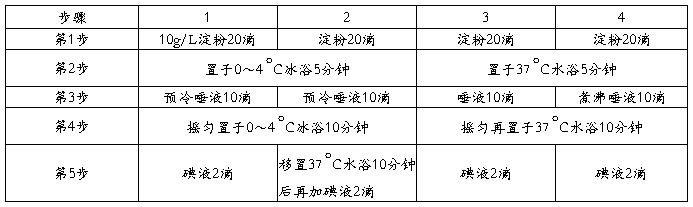
注意:加唾液后应混匀各管。加碘液后摇匀,观察并解释结果。
[试剂]
1.10g/L淀粉液。
2.碘液:称取碘1克,碘化钾2克,同溶于100ml蒸馏水中,贮于棕色瓶。
二. 激动剂和抑制剂对酶活性的影响
[原理]
酶的活性在某些物质的作用下可以增高或降低,反能提高酶活性的物质称为酶的激动剂;凡能降低或抑制酶活性但并不使酶变性的物质称为酶的抑制剂。以唾液淀粉酶为例,氯离子使酶活性增强,铜离子强烈抑制酶活性。
[操作]
1.收集唾液。
2. 取洁净试管4支,编号,按下表操作。
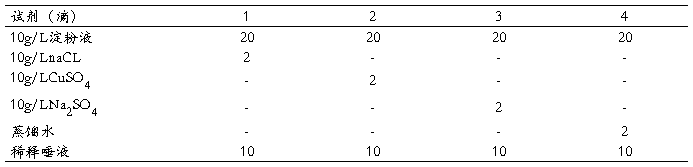
将各管混匀,置37℃水浴中,取瓷比色盘一个,预先加一排碘液,各凹处加1-2滴。每间隔2分钟从第1管吸取保温液一滴,测碘反应,直至第1管不与碘呈色(即浅棕色)时,向各管加碘液2滴,摇匀观察并解释结果。
[试剂]
1.10g/L淀粉液。
2.10g/LNaCL。
3.10g/LCuSO4
4.10g/LNa2SO4
5.碘液: 称取碘1克,碘化钾2克,同溶于100ml蒸馏水中,贮于棕色瓶。
三. pH对酶活性的影响
[原理]
环境的pH值显著影响酶活性。pH值既影响酶蛋白也影响底物的解离度,从而改变酶与底物的结合和催化作用。在某一pH时,酶活性达最大值,这一PH称酶的最适PH,不同的酶最适pH不尽相同。以唾液淀粉酶为例,该酶最适pH为6.9,过酸过碱均可使酶活性显著降低。判断PH对酶活性的影响,可用底物即淀粉消失的快慢来衡量酶活性的高低,可用淀粉与碘的呈色反应来判断。
[操作]
1.收集唾液。
2.取试管3支,编号,按下表加试剂。

将各管混匀,置37℃水浴中,取瓷比色盘一个,预先在各池分别加1滴稀碘液。每隔1分中从第2管吸取保温液1滴,加到已有碘液的比色盘小池中,直至此管不与碘呈色(即浅棕色)时,向各管加碘液2滴,摇匀观察并解释结果。
[试剂]
1.10g/L淀粉液。
2,稀碘液。(同温度对酶活性的影响)。
3,磷酸盐缓冲液:
PH5.0: 0.2mol/L磷酸氢二钠PH计下以0.2mol/L盐酸调节至PH5.0.
PH6.8: 1/15mol/L磷酸氢二钠49.6ml加入1/15mol/L磷酸氢二钾50.4ml.
PH8.0: 1/15mol/L磷酸氢二钠94.7ml加入1/15mol/L磷酸氢二钾5.3ml.
(李素婷)
实验二十一 胰岛素和肾上腺素对血糖浓度的影响
[原理]
人和动物体内,血糖浓度受各种激素调节而维持恒定,胰岛素能降低血糖,其它很多激素则有升高血糖的作用,其中以肾上腺素作用较为迅速而明显。胰岛素通过(1)促进葡萄糖进入细胞内;(2)增加血糖去路(氧化供能,合成糖原等), 减少血糖来源(糖原分解,糖异生等)等作用降低血塘。肾上腺素促进肝糖原分解和糖异生而增高血糖。此实验主要是观察家兔注射胰岛素和肾上腺素前后的血糖浓度变化。
血糖的测定方法(邻甲苯胺法):葡萄糖在热醋酸溶液中与邻甲苯胺缩合,脱水生成蓝色的醛亚胺(schiff碱),最大吸收峰在630nm,其颜色深浅与葡萄糖含量成正比。
[操作]
一、取血和注射:
1.称量家兔体重并记录。
2.剪去兔耳缘上的毛,用二甲苯棉球擦耳缘静脉处,用粗针头刺破,迅速取血0.5ml放入一个离心管中。3000 转/分离心10分钟。
3.取血后,将家兔分为两组,按体重分别腹部皮下注射胰岛素或肾上腺素注射。
胰岛素(1ml含40单位):每公斤体重注射1单位。
肾上腺素注射液(1﹕1000):每公斤体重注射0.4ml。记录注射时间,之后每隔30分钟由耳缘静脉取血一次,共三次,分别放入离心管中,3000转/分离心10分钟。
二、血糖的测定:
取3只试管按下表操作
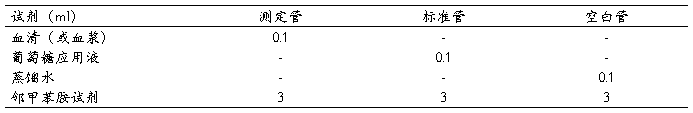
混匀,沸水浴中煮沸12分钟,取出后流水冷却5分钟。分光光度计波长630nm,以空白管调零、比色。
[计算]
血糖(mmol/L)= ×5
×5
参考值:空腹血糖为3.89-6.11mmol/L
[注意事项]
1.加热温度、时间等应严格掌握,否则会影响显色强度。
2.邻甲苯胺试剂中醋酸浓度很高,比色时切勿将比色液流入比色计内。
3.高脂血标本的终反应偶见浑浊,可向3ml显色液中加入1.5ml异丙醇,充分混匀,最后将测得的吸光度乘以1.5。
[临床意义]
1.生理性高血糖:摄入高糖膳食后,或情绪紧张而引起肾上腺素分泌增加时。
2.病理性高血糖:主要见于糖尿病,另外见于甲状腺机能亢进、皮质醇增多症、肝硬化及慢性肝炎等。
3.生理行低血糖:饥饿和剧烈运动。
4.病理行低血糖:胰岛β细胞瘤,垂体前叶、肾上腺皮质或甲状腺机能减退等。
[试剂]
1.邻甲苯胺试剂:称硫脲1.5克,溶于940ml冰醋酸中,加邻甲苯胺60ml,放置24小时后使用。
2.12mmol/L苯甲酸溶液:900ml蒸馏水中加入苯甲酸1.4克,加热助溶,冷却后定溶为1L.
3.葡萄糖标准贮存液(100mmol/L):无水葡萄糖80烤箱内干燥至恒重,移至于干燥器内保存)1.802克,溶于12mmol/L苯甲酸溶液80ml中,再定溶至100ml.
4.葡萄糖标准应用液(5mmol/L):取标准贮存液50ml,加12mmol/L苯甲酸至100ml.
5.胰岛素注射液:
6.肾上腺素注射液。
7.二甲苯。
(李素婷)
实验二十二 血清脂蛋白琼脂糖电泳
[原理]
琼脂糖电泳与薄膜电泳的原理基本是一致的,它们的区别主要是电泳支持物的不同。琼脂糖是从海洋植物琼脂中提取出来的一种聚合链线状分子,加水后可以制成具有多孔网状结构的凝胶。 本次实验是用琼脂糖为支持物分离血清脂蛋白。
血清中的脂类物质均与血清蛋白质结合成水溶性的脂蛋白形式存在,各种脂蛋白中,所含的蛋白质种类和数量不同,脂蛋白颗粒大小亦不同,这些因素使它们在电场中的移动速度各异,因而可以通过电泳使不同的脂蛋白一一分开。
样品先经脂类染料染色,通电后脂蛋白在凝胶板上的移动量可以肉眼观察。区带宽窄及染色深浅反映各种脂蛋白的量。
琼脂糖电泳可将血清脂蛋白分出3条区带(α-脂蛋白、前β—脂蛋白和β-脂蛋白)。
[操作]
1.预染血清:血清0.2ml加苏丹黑染色液0.016ml于小试管中,混合后置37oC水浴染色30分钟。然后每分钟2000转,离心约5分钟。
2.制备琼脂糖凝胶板:已配制的5g/L琼脂糖凝胶于沸水浴中加热融化。用吸管吸取凝胶溶液流注载玻片,每片约3ml。静置约半小时后凝固(天热时需延长,可放冰箱数分钟加速凝固)。
3.点加血清:在将要凝固的琼脂糖凝胶板距一端约2cm处,放一个1.5 × 10mm的金属棒,向下压使之接触载玻片,用吸铁石将小棒吸出。以小片滤纸吸干小槽中水分,用毛细管或微量注射器吸取经过预染的血清约15μl,注入凝胶板上的小槽内。
4.电泳:将加过血清的凝胶板平行放于电泳槽中,样品放于阴极一端。两块三层纱布于巴比妥缓冲液中浸湿,然后轻轻紧密贴在凝胶板两端,纱布的另一端浸于电泳槽内的巴比妥缓冲液中,接通电源, 电压为100V,每片电流为3~4mA,约经电泳45~55分钟,即可见分离之色带。
[临床意义]
1.正常人血清脂蛋白可出现3条区带,从阴极到阳极依次为β-脂蛋白(最深)、前β-蛋白(最浅),α-脂蛋白(比前β-脂蛋白略深些),在原点处应无乳糜微粒。
2.如果前β-脂蛋白比α-蛋白深,结合血清甘油三酯明显升高和胆固醇正常或略高,可以确定为Ⅳ型高脂蛋白血症。
3.如果β-脂蛋白区带比正常血清明显深染者,同时结合血清总胆固醇明显增高,甘油三酯正常者为Ⅱa型,若结合血清总胆固醇增高而甘油三酯略高和β略深者为Ⅱb型。
4.如果β-和前β—两区带分离不开连在一起称“宽β区带”结合血清甘油三酯和胆固醇均有所增高,可定为Ⅲ型。
5.如果原点出现乳廉微粒,β、前β均正常或减低,结合血清甘油三酯明显升高,可定为Ⅰ型
[试剂]
1.巴比妥缓冲液(pH8.6):用于电泳槽者离子强度0.075,巴比妥钠15.458g、巴比妥2.766g、加水至1000ml。
配制琼脂糖凝胶者离子强度0.05,巴比妥钠10.3g、巴比妥1.84g、加水至1000ml。
2. 5g/L琼脂糖凝胶:称取琼脂糖0.5g,加入巴比妥缓冲液(离子强度0.05)100ml,置沸水浴中溶解,分装于试管中,冰箱保存。
3.固定液:冰醋酸5ml与75%乙醇95ml混合。
4.染色液:苏丹黑0.1g溶于异丙醇10ml中。
5.漂洗液:60%乙醇溶液。
