编号:
贴标、包装工序风险评估
起草: 日期:
审阅: 日期:
批准: 日期:
实施日期:
复印数:
分发部门:
XXXXXXXXXXX有限公司
目 录
一 目的...................................................................... 3
二 范围...................................................................... 3
三 责任 ...................................................................... 4
四 内容....................................................................... 4
1 引言..................................................................... 4
1.1 概述.............................................................. 4
1.2 目的............................................................... 4
1.3 评估小组成员及职责................................................. 4
2 贴标和包装工序........................................................... 4
2.1 操作描述........................................................... 4
2.2 操作过程........................................................... 4
2.3包装材料的领取使用.................................................. 4
2.4包装管理............................................................ 4
3 风险识别:.............................................................. 4
3.1 污染............................................................... 4
3.2 交叉污染........................................................... 4
3.3 混淆............................................................... 4
3.4 差错............................................................... 4
4风险评估:............................................................... 4
4.1发生的可能性分为五级................................................ 4
4.2危害的严重性........................................................ 4
5针对存在的质量风险,已有的措施效益评估:................................. 4
6结论..................................................................... 4
一 目的:通过质量风险评估,确认目前采取的各项控制措施可以将产品在包装过程中产生的质量风险控制在可以接受的范围内。
二 范围:需要在包装间进行包装的全部产品:
三 责任 工程动力部 生产部 质保部
四 内容
1 引言
1.1 概述:根据《药品生产质量管理规范》20##年修订第二章第十四条规定:应当根据科学知识及经验对质量风险进行评估,以保证产品质量。本报告是对药品贴标及外包装工序所进行的质量风险评估。
1.2 目的:利用风险管理方法和工具,对贴标与包装工序影响药品生产质量的各要素,进行分析评估以确定确认及验证范围及程度,最大可能降低造成的产品生产风险。
1.3 评估小组成员及职责
1.3.1 评估小组成员
1.3.2 职责
1.3.2.1质保部
1.3.2.1.1 根据GMP和质量管理的要求,提出贴标和包装工序的风险分析和控制要求。
1.3.2.1.2 对风险评估报告的审核和批准。
1.3.2.2 工程动力部
1.3.2.2.1从工程设计和管理的角度提出贴标和包装工序的风险分析和控制要求。
1.3.2.2.2 负责本报告的起草编写。
1.3.2.2.3 对贴标和包装工序的相关的风险进行分析评估并提出控制要求。
1.3.2.2.4对风险评估报告的审核。
1.3.2.3 生产部
1.3.2.3.1根据生产工艺提出生产过程中关键工艺控制点对贴标和包装工序风险控制要求。
1.3.2.3.2从操作及安全角度提出对贴标和包装工序风险控制要求。
1.3.2.3.3 对风险评估报告的审核。
2 贴标和包装工序
2.1 操作描述:
2.1.1 ***贴标、包装工序:本工序操作过程是将分装轧盖后***传送出来的待包装产品进行贴标、在线对标签打印批号、装盒、装箱打包等。
2.1.2 **包装工序:将分装成小袋的**通过传递窗进入外包间进行装盒、装箱打包。
2.2 操作过程:
2.2.1待包装的小儿止咳糖浆小瓶从灌装旋盖间通过传送带送到包装间。传送带直接与自动贴标机相连。因此产品可以被直接送贴标。贴标和标签打印生产日期、有效期是同步自动完成的。贴标后产品送入转运塑料筐中送包装台装塑托,再连同说明书一起放入已打印批号、生产日期、有效期、箱号的彩盒中。彩盒折好后放入外箱内,再放入质保部签发的合格证和检验报告,封箱打包即得。彩盒打印批号在独立的批号打印间进行。
2.2.2 带包装的镇咳宁糖浆经过灯检机后送入贴标岗位进行贴标。贴标和标签打印生产日期、有效期是同步自动完成的。贴标后产品送入转运塑料筐中送包装台装塑托,再连同说明书一起放入已打印批号、生产日期、有效期、箱号的彩盒中。彩盒折好后放入外箱内,再放入质保部签发的合格证和检验报告,封箱打包即得。彩盒打印批号在独立的批号打印间进行。
2.2.3 经过分装的**通过传递窗送入外包间,进行装小盒,装说明书,贴标签,装箱打包。
2.3包装材料的领取使用:
标签、说明书、彩盒等印刷包装材料的领取、发放、使用流程:全部印刷包装材料由车间包装组长根据《批包装指令》开具领料单,交公司物料主管签字同意后到仓库领取。标签均为切割式,成卷状,每卷数量由印刷厂控制。入库、发放时无法核实准确数量,因此发料数量一般会多于申请领用数量。彩盒和说明书凭领料单计数发放。发放的印刷包装材料由库房填写《包装材料信息卡》,随同物料一起交包装班。领取的标签、说明书直接送包装班待用。领取的彩盒则移交给打码间,由领取人和打码人办理书面交接手续。打码人员打印批号时一人编辑生产日期等信息,一人复核信息是否和包装指令相符。核对无误后开始打印。打印批号和剩余未打印批号的彩盒再由打码人员移交给包装班,交接手续同为彩盒打印批号记录。批号等打印错误的彩盒由打码人员在QA监督下销毁。包装人员自行领取彩盒、说明书、已贴标产品和外箱等按标准操作规程包装。每箱包装结束到QA处领取合格证,并在合格证上签上包装人自己的名字,放在箱内药品上交打包人员。打包人员核对数量无误后,放入质保部发放的成品检验合格报告后封箱打包。
2.4包装管理:
每次包装操作结束后都会清场。清场结果由QA检查确认并签发清场合格证。包装前会检查确认待包装产品品名、规格、批号等主要信息,检查确认印刷包装材料及打印的信息和待包装产品一致。包装过程中QA会检查产品包装质量。包装人员会随时查看待包装产品贴标情况、标签上的打印信息、彩盒上印刷及打印的信息等。
3 风险识别:
3.1 污染:包装过程中可能会因为操作不小心,待包装产品从桌面滚落到地面而有可能造成西林瓶破裂,从而带来污染风险。
3.2 交叉污染:包装过程中不会造成交叉污染。
3.3 混淆:包装过程中可能出现的混淆包括前次包装产品混入本批产品中;其它品种的标签、说明书、彩盒混入本产品的标签中;
3.4 差错:包装过程中可能产生的差错包括标签打错或漏打批号、有效期;彩盒打错或漏打批号、生产日期、有效期;漏放说明书;
4风险评估:
4.1发生的可能性分为五级:没听说过;不太可能发生;可能发生;有多次发生的可能;普遍,每周、日都有。
4.2危害的严重性:根据药品因为包装原因导致的质量问题对人的伤害分为五级:多人死忙、个人死亡、主要的、轻微的、可忽略的。
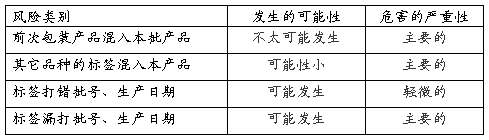
5针对存在的质量风险,已有的措施效益评估:

