实验二十一 可溶性总糖的测定(蒽酮比色法)
一、目的
掌握蒽酮法测定可溶性糖含量的原理和方法。
二、原理
强酸可使糖类脱水生成糠醛,生成的糠醛或羟甲基糖醛与蒽酮脱水缩合,形成糠醛的衍生物,呈蓝绿色,该物质在 620 nm 处有最大吸收 . 在 10 -100ug 范围内其颜色的深浅与可溶性糖含量成正比。
这一方法有很高的灵敏度,糖含量在 30ug 左右就能进行测定,所以可做为微量测糖之用。一般样品少的情况下,采用这一方法比较合适。
三、仪器、试剂和材料
1 .仪器
( 1) 分光光度计
(2 )电子顶载天平
(3 )三角瓶: 50m1 X 1
( 4 )大试管: 9 支
( 5) 试管架,试管夹
( 6 )漏斗,漏斗架
( 7 )容量瓶: 50rnl X 2
( 8 )刻度吸管: 1m1X3 , 2m1X1 , 5mlX1
( 9 )水浴锅
2 .试剂
( 1) 葡萄糖标准液: l00ug/ml
(2 )浓硫酸
(3) 蒽酮试剂 :0.2g 蒽酮溶于 100 ml 浓 H2SO4 中当日配制使用。
3 .材料
小麦分蘖节。
四、操作步骤
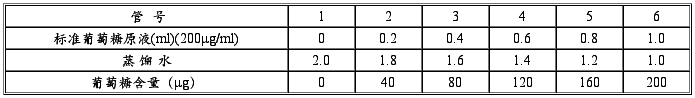
1 .葡萄糖标准曲线的制作
取 7 支大试管,按下表数据配制一系列不同浓度的葡萄糖溶液:
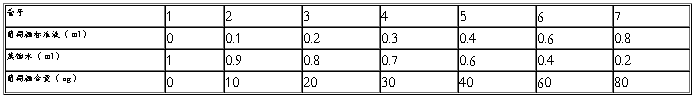
在每支试管中立即加入蒽酮试剂 4.0m1 ,迅速浸于冰水浴中冷却,各管加完后一起浸于沸水浴中,管口加盖玻璃球,以防蒸发。自水浴重新煮沸起,准确煮沸 l0min 取出,用流水冷却,室温放置 10min ,在 620 nm 波长下比色。以标准葡萄糖含量( ug) 作横坐标,以吸光值作纵坐标,作出标准曲线。
2 .植物样品中可溶性糖的提取
将小麦分蘖节剪碎至 2mm 以下,准确称取 Ig, 放入 50m1 三角瓶中,加沸水 25m1 ,在水浴中加盖煮沸 10min ,冷却后过滤,滤液收集在 50m1 容量瓶中,定容至刻度。吸取提取液 2m1 ,置另一 50m1 容量瓶中,以蒸馏水稀释定容,摇匀测定。
…… …… 余下全文