有机化合物的结构与性质
有机化学能充分体现出“结构决定性质,性质反映结构”的规律。有机化合物的结构与碳原子的成键方式有关。碳原子最外层4个电子,得失电子都不容易,主要以共价键与其它原子结合。依据共用电子对数可将碳原子形成的共价键分为单键、双键、三键这三类;依据共用电子对是否有偏向可分为极性键和非极性键;依据原子轨道重叠成键的方式又分为σ键、π键,有的还存在大π键。碳原子成键方式的多样性决定有机化合物大多存在同分异构现象,常见的同分异构有碳骨架异构、官能团位置异构、官能团类别异构。官能团决定有机化合物的化学特性,官能团的相互影响会使有机化合物具有某些特性。
【重点难点】
重点:不同类有机物中碳原子不同的成键方式和同分异构体。
难点:有机物的结构与碳原子成键方式的关系及如何书写有机物的同分异构体。
【知识讲解】
烃分子中有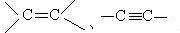 ,烃的衍生物中有-x、-OH、
,烃的衍生物中有-x、-OH、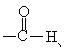
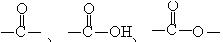 等不同的官能团,这些官能团决定了有机化合物具有各自典型的性质。学习有机化合物,必须明确“结构决定性质,性质反映结构”。有机化合物的结构是以分子中碳原子结合成的碳骨架为基础的,故首先要研究碳原子的结合方式——成键情况。
等不同的官能团,这些官能团决定了有机化合物具有各自典型的性质。学习有机化合物,必须明确“结构决定性质,性质反映结构”。有机化合物的结构是以分子中碳原子结合成的碳骨架为基础的,故首先要研究碳原子的结合方式——成键情况。
一、碳原子的成键方式
上节已把有机物分为链状有机化合物和环状有机化合物,这就是根据碳骨架的形状来分的,烃中又有烷烃、烯烃和炔烃,这是根据碳原子形成不同的碳碳键来分的。
1、单键、双键和三键
碳原子最外层4个电子,要形成最外层8个电子的稳定结构,每个碳原子需共用4对电子。若每个碳原子分别与4个碳原子各形成一对共用电子,形成的该共价键为单键。若两个碳原子间共用两对电子的共价键称为双键,用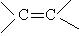 表示。若两个碳原子间共用三对电子的共价键称为三键,用
表示。若两个碳原子间共用三对电子的共价键称为三键,用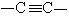 表示。下面介绍几种常见有机物的成键情况。
表示。下面介绍几种常见有机物的成键情况。
(1) 中碳原子成键情况和空间构型
中碳原子成键情况和空间构型
 的电子式为
的电子式为 ,结构式为
,结构式为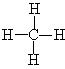 ,空间构型为正四面体,键角为109.5°(或109°28′)。
,空间构型为正四面体,键角为109.5°(或109°28′)。
C原子的轨道表示式为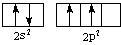 ,参与成键时,形成杂化轨道。
,参与成键时,形成杂化轨道。 中分子中C原子形成sp3杂化轨道:
中分子中C原子形成sp3杂化轨道: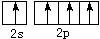 ,形成了四个完全相同的杂化轨道,分别与H原子的原子轨道重叠,形成了空间构型为正四面体形的分子。
,形成了四个完全相同的杂化轨道,分别与H原子的原子轨道重叠,形成了空间构型为正四面体形的分子。
烷烃分子中碳原子的成键方式都与 分子中的碳原子相似,碳原子无论形成碳碳单键还是碳氢单键,任意两个键间的夹角都接近109.5°,故烷烃分子中的碳链为折线形。
分子中的碳原子相似,碳原子无论形成碳碳单键还是碳氢单键,任意两个键间的夹角都接近109.5°,故烷烃分子中的碳链为折线形。
(2) 分子的成键情况和空间构型
分子的成键情况和空间构型
 的电子式为
的电子式为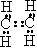 ,结构式为
,结构式为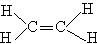 。与
。与 相比,出现了碳碳双键,空间构型不是正四面体,而是平面形分子,键角接近120°。
相比,出现了碳碳双键,空间构型不是正四面体,而是平面形分子,键角接近120°。
 的电子式为
的电子式为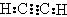 ,结构式为
,结构式为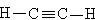 。
。 分子中出现了碳碳三键,空间构型为直线形,键角为180°。
分子中出现了碳碳三键,空间构型为直线形,键角为180°。
(3)σ键、π键
从原子轨道重叠成键的方式分析,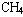 分子中碳原子形成sp3杂化轨道,烷烃分子中,无论是碳碳单键,还是碳氢单键,都是以“头碰头”方式重叠成键,叫做σ键。该键比较稳定,决定了
分子中碳原子形成sp3杂化轨道,烷烃分子中,无论是碳碳单键,还是碳氢单键,都是以“头碰头”方式重叠成键,叫做σ键。该键比较稳定,决定了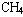 及其它烷烃分子的化学性质比较稳定,不能发生加成反应,主要发生取代反应。
及其它烷烃分子的化学性质比较稳定,不能发生加成反应,主要发生取代反应。
 中的碳碳双键中,只有一对电子形成σ键,另一对电子只能以“肩并肩”方式重叠,形成π键。故
中的碳碳双键中,只有一对电子形成σ键,另一对电子只能以“肩并肩”方式重叠,形成π键。故 分子的双键中有一个为σ键、一个为π键,
分子的双键中有一个为σ键、一个为π键, 分子的三键中有一个为σ键、二个π键。由于σ键的重叠程度大于π键,故σ键的键能通常比π键高。已知碳碳单键、双键、三键的键能分别为347kJ/moL,614kJ/moL、839kJ/moL,可知碳碳双键、三键的键能分别比单键键能的2倍、3倍要小,也充分说明了σ键的键能比π键高,故
分子的三键中有一个为σ键、二个π键。由于σ键的重叠程度大于π键,故σ键的键能通常比π键高。已知碳碳单键、双键、三键的键能分别为347kJ/moL,614kJ/moL、839kJ/moL,可知碳碳双键、三键的键能分别比单键键能的2倍、3倍要小,也充分说明了σ键的键能比π键高,故 、
、 分子中的π键易断裂,
分子中的π键易断裂, 、
、 比
比 性质活泼,易发生加成反应,如二者常温下能使溴水褪色。
性质活泼,易发生加成反应,如二者常温下能使溴水褪色。
苯分子也是平面形分子,键角约120°。苯分子中六个碳原子通过σ键形成正六边形的碳环,每个碳原子各自还提供一个电子,以“肩并肩”方式重叠后形成一个特殊的共价键,叫做大π键。该键决定了苯看似高度不饱和,实际上与烯烃、炔烃性质并不接近。
除了用电子对数把碳原子形成的共价键进行分类外,根据原子对电子的吸引程度是否相同,把共价键也进行分类,这就时极性键和非极性键。
2、极性键和非极性键
(1)极性键:
成键双方为不同元素的原子,吸引电子的能力不同,使共用电子对偏向吸引电子能力强的一方,这样的共价键叫极性共价键,简称极性键。如有机物中的碳氢键、碳氧键、碳氮键、氢氧键等。
从电负性角度分析,两元素中电负性越大的元素,对电子的吸引能力越强。电负性差值很大的元素原子之间形成的化学键主要是离子键,差值小的非金属元素原子之间形成的为极性共价键,电负性相同的非金属元素原子间形成的为非极性共价键。
(2)非极性键
成键两原子相同时,吸引共同电子的能力相同,共用电子对谁也不偏向,这样的共价键是非极性共价键,简称非极性键。如碳碳单键、双键、三键都为非极性键。非极性键中,共用电子对不偏向于成键原子的任何一方,故参与成键的两原子都不显电性。
碳原子成键方式的多样性导致了有机化合物中普遍存在同分异构现象。
二、有机化合物的同分异构现象
1、同分异构体:
分子组成相同而结构不同的现象称为同分异构现象,这些结构不同的有机化合物互称为同分异构体。
同分异构体的研究对象是有机化合物,注意与同位素、同素异形体、同系物等概念的区分。
2、同分异构体的书写
(1)碳骨架异构:
书写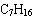 的同分异构体。
的同分异构体。
ⅰ:无支链: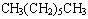
ⅱ:去一碳,做甲基
甲基先放在中间: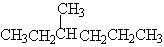
往一边挪动甲基:
ⅲ:去两碳,做乙基: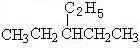
做两个甲基:两甲基在同一个碳原子上: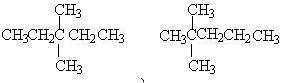
两甲基处于两个不同碳原子上:处于相邻位置:
处于相间位置: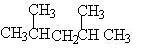
ⅳ:去三碳,做三个甲基: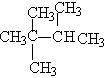
(若碳原子数多,还可做一个丙基,或一个乙基和两个甲基)。
(2)官能团位置异构:书写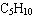 的链状异构体。
的链状异构体。
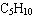 的链状异构就是属于烯烃的同分异构体,除正常的烷烃的碳骨架异构外,还要注意双键位置移动出现的同分异构体。
的链状异构就是属于烯烃的同分异构体,除正常的烷烃的碳骨架异构外,还要注意双键位置移动出现的同分异构体。
ⅰ:双键在1,2两个碳原子上

ⅱ:双键在2,3两个碳原子上
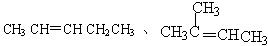
炔烃及烃的衍生物的同分异构体的书写也要注意官能团位置移动引起的同分异构体,除官能团位置移动外,还有官能团发生变化产生的同分异构体,即官能团的类别异构。
(3)官能团的类别异构
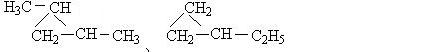
不同类的有机物之间也有可能出现类别异构,如同碳原子数的环烷烃与烯烃、二烯烃与炔烃、醇与醚、醛和酮、羧酸与酯之间出现的同分异构体。这些以后学习烃的衍生物时,还会涉及到,下面分析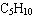 的环烷烃的同分异构体,书写原则仍遵循一般的碳骨架异构的规律。
的环烷烃的同分异构体,书写原则仍遵循一般的碳骨架异构的规律。
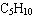 的环烷烃同分异构体有:
的环烷烃同分异构体有: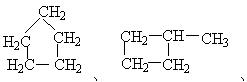
以上三种异构属于有机化合物中的结构异构,还有一类是立体异构,是指有相同的组成和结构,而原子在分子中的空间排列情况不同引起的同分异构现象,常见的有顺反异构和对映异构。
(4)顺反异构:
含碳碳双键的化合物中,双键不像单键那样能沿着键轴旋转,故形成双键的两个碳原子中,每个碳原子所连的另外两个原子或基团不同时,就存在顺反异构现象。如2-丁烯存在顺反异构。
(5)对映异构
当有机化合物分子中的饱和碳原子连接着四个不同的原子或原子团时,就会形成像人的左、右手一样的看似相同却不能完全重叠的两种物质,它们为对映异构体,乳酸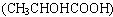 分子存在对映异构。
分子存在对映异构。
人们将连有四个不同基团的碳原子形象地称为手性碳原子,手性碳原子普遍存在于一些与生命现象有关的有机化合物中,属于热点问题。
三、有机化合物结构与性质的关系:
结构决定物质的性质。若已知某有机物的结构,先找出含有的官能团,根据该官能团的性质,碳原子的饱和程度,分析该有机化合物可能具有的性质,这是考试中考查有机化合物的重点内容。
1、官能团与有机化合物性质的关系。
官能团能决定有机化合物的特性,主要有以下两方面的原因。
(1)一些官能团含有极性较强的键,易发生相关的化学反应。如:醇的官能团为-OH,有较强的极性,是醇分子中最活泼的基团,故醇的化学性质主要由-OH决定,其余的碳碳键、碳氢键对其性质影响不大。
(2)一些官能团含有不饱和键,易发生相关反应,如:烯烃、炔烃分子中的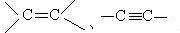 ,使得它们容易发生加成反应等。
,使得它们容易发生加成反应等。
官能团中键的极性和碳原子的饱和程度对有机化合物的性质影响较大。从熟悉的有机化合物的官能团,联系未知物中的相同官能团,可预测它们的性质有相近之处。学习每类有机物时,必须熟练掌握官能团如何决定它们的化学性质。
2、不同基团间的相互影响与有机化合物性质的关系。
有机化合物中往往不止一种官能团,分子中的邻近基团之间往往存在着相互影响,性质也就发生变化。如苯与甲苯相比,甲苯中的 使得苯环上邻位、对位碳原子上的氢原子易被取代,甲苯比苯取代反应容易进行。同时,甲苯中的
使得苯环上邻位、对位碳原子上的氢原子易被取代,甲苯比苯取代反应容易进行。同时,甲苯中的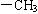 能被酸性
能被酸性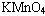 氧化,苯不具备该性质。烃的衍生物中这种影响会更多。学习有机化合物时,必须分析每类有机化合物中官能团如何决定性质,各官能团之间又会怎样相互影响,这样,学习时目的就比较明确了。
氧化,苯不具备该性质。烃的衍生物中这种影响会更多。学习有机化合物时,必须分析每类有机化合物中官能团如何决定性质,各官能团之间又会怎样相互影响,这样,学习时目的就比较明确了。
【例题分析】
例1:某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( )
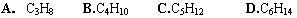
分析:本题考查对烷烃的同分异构体的分析能力。
解法一:找出烃中氢原子的种类,有几种不同的氢原子就有几种一氯代物。
氢原子种类的判断:①同一碳原子上的氢原子为同一类;②同一碳原子上所连甲基中的氢原子为同一类;③处于对称位置上的氢原子为同一类。
A选项中: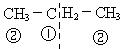 2种氯代物。
2种氯代物。
B选项中: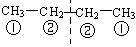 2种,①-①,②-②的氢原子处于对称位置,
2种,①-①,②-②的氢原子处于对称位置, ,连在同一碳上的甲基中的 H 为一类。
,连在同一碳上的甲基中的 H 为一类。
C、D也用此法逐一分析,得出C选项中, 只有一种一氯代物。上述解法非常繁琐。
只有一种一氯代物。上述解法非常繁琐。
解法二:此题应掌握10个碳原子以内的烷烃的一氯代物只有一种的物质有: 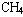 ;
; 四种,对照此题的选项只有C符合。
四种,对照此题的选项只有C符合。
答案:C。
例2:烷烃分子可以看成由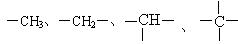 等基团或原子团结合而成。如果某烷烃分子中同时存在这4种基团,最少应为含有_____个碳原子的烷烃,其结构简式有_____种,它们分别是____。
等基团或原子团结合而成。如果某烷烃分子中同时存在这4种基团,最少应为含有_____个碳原子的烷烃,其结构简式有_____种,它们分别是____。
解析:按照题目要求,可将4种基团逐一排列如下式,构成主链: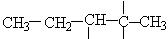
其中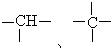 的剩余价键上必须连接
的剩余价键上必须连接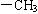 ,否则就不能保持该基团的形式,例如:
,否则就不能保持该基团的形式,例如: 上若连接一个H原子,则为
上若连接一个H原子,则为 。这样可以计算出最少碳原子数应为8,即:
。这样可以计算出最少碳原子数应为8,即: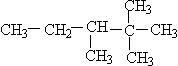
其同分异构体中仍保持有4种特定基团的还有以下两种:
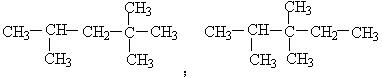 。
。
因此,结构简式共有3种,分别如以上所示。
【达标练习】
1、判断下列说法下确的是 ( )
A、符合同一通式的有机物一定互为同系物。
B、分子组成上相差一个或若干个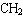 原子团的有机物一定互为同系物。
原子团的有机物一定互为同系物。
C、相对分子质量相同的有机物一定互为同分异构体。
D、同分异构体中各元素的含量相同,但组成元素含量相同的有机物不一定互为同分异构体。
2、下列各对物质中属于同分异构体的是 ( )
A、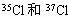 B、白磷和红磷
B、白磷和红磷
C、 D、
D、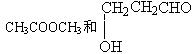
3、下列有机物其一氯代物的结构可能只有一种的是 ( )

4、下列数据是有机物的式量,可能互为同系物的一组是 ( )
A、16、30、58、72 B、16、28、40、52
C、16、32、48、54 D、16、30、42、56
5、相对分子质量为100的烷烃,主链上有5个碳原子的同分异构体有 ( )
A、3种 B、4种 C、5种 D、6种
6、已知二氯苯的同分异构体有三种,从而推知四氯苯的同分异构体的数目为 ( )
A、一种 B、二种 C、三种 D、四种
7、下列四种烃类:①乙烷、②乙烯、③乙炔、④苯中碳原子之间键长由长到短的顺序是 ( )
A、①>②>③>④ B、①>④>②>③
C、②>①>③>④ D、④>③>②>①
8、甲苯分子被溴原子取代一个氢原子后,可能形成的同分异构体数目是 ( )
A、3个 B、4个 C、5个 D、6个
9、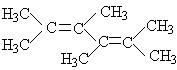 中有可能在同一平面上的C原子数最多为( )个。
中有可能在同一平面上的C原子数最多为( )个。
A、7 B、8 C、9 D、10
10、白磷、2,2-二甲基丁烷、氯气、2-甲基戊烷、液氯、2-甲基丁烷、红磷、环丙烷、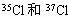 中,互为同系物的是____;互为同分异构体的是____;互为同素异形体的是____;是同位素的有____;是同一物质的是____。
中,互为同系物的是____;互为同分异构体的是____;互为同素异形体的是____;是同位素的有____;是同一物质的是____。
11、某化合物,A的分子式为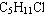 ,分析数据表明,分子中有两个
,分析数据表明,分子中有两个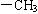 。两个
。两个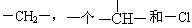 。它的可能结构只有四种。请写出这四种可能的结构简式。
。它的可能结构只有四种。请写出这四种可能的结构简式。
(1)_______。 (2)_______。
(3)_______。 (4)_______。
12、烷烃分子中,与碳原子相结合的氢原子有3个、2个、1个等不同情况,分别用伯氢、仲氢、叔氢加以区别,如下式所示:
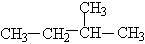
在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同。现将n mol 2-甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢,则:
(1)反应中生成溴化氢的物质的量为_____mol。
(2)将反应生成的四种一溴代物的混合气体充分燃烧,生成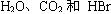 ,此时需消耗氧气______mol。
,此时需消耗氧气______mol。
【参考答案】
1、D 2、D 3、A D 4、A 5、C 6、C 7、B 8、B 9、D
10、答案:2-甲基丁烷与2-甲基戊烷(或2,2-二甲基丁烷);2-甲基戊烷与2,2二甲基丁烷;白磷与红磷; 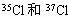 ;氯气与液氯。
;氯气与液氯。
11、解析:
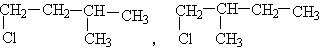
12、解析:(1)n (2)7.5n
