





复印推断题一份
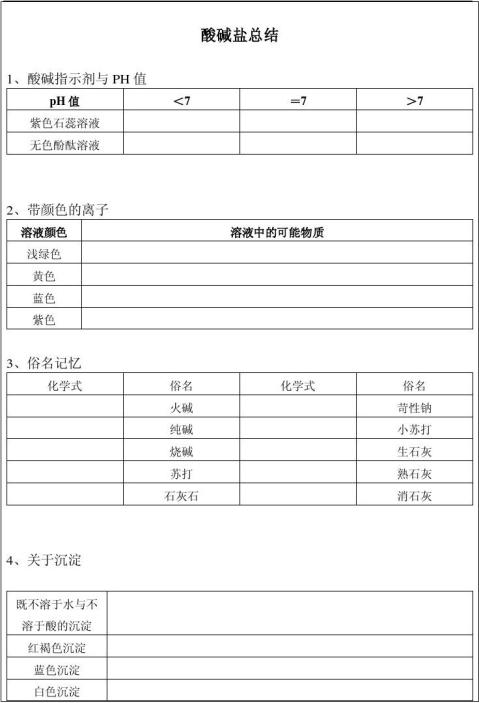
第二篇:九年级化学酸碱盐知识点总结
初三化学知识点总结—酸、碱、盐
一.酸碱盐的组成与性质
酸、碱、盐的组成:
酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3) 碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O) 盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子) 1.酸
(1)浓盐酸、浓硫酸的物理性质、特性、用途
(2)酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+) ① 与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色 ②金属+酸→盐+氢气
③碱性氧化物+酸→盐+水
④碱+酸→盐+水
⑤盐+酸→另一种盐+另一种酸(产物符合复分解条件) (3).三种离子的检验
⑴氢氧化钠、氢氧化钙的物理性质、用途
⑵碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)
①碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色 ②酸性氧化物+碱→盐+水
③酸+碱→盐+水
④盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件) 注:a.难溶性碱受热易分解(不属于碱的通性) 如Cu(OH)2ΔCuO+H2O 2Fe(OH)3ΔFe2O3+3H2O
B.常见沉淀:AgCl↓BaSO4↓Cu(OH)2↓F e(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓ C.复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。 3.酸性氧化物与碱性氧化物
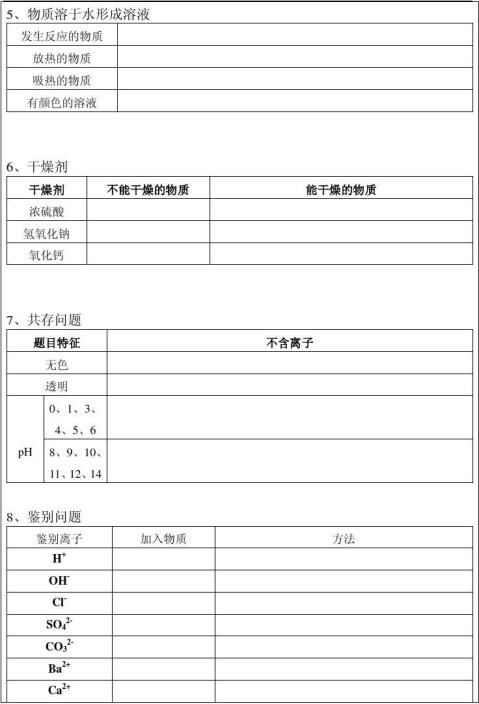
4.中和反应溶液酸碱度的表示法--pH
⑴定义:酸与碱作用生成盐和水的反应 ⑵应用:
①改变土壤的酸碱性 ②处理工厂的废水 ③用于医药
⑶溶液酸碱度的表示法--pH ①
②pH的测定:最简单的方法是使用pH试纸
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)
③酸雨:正常雨水的pH约为5.6(因为溶有CO2)
pH<5.6的雨水为酸雨初三化学:有关酸碱盐的化学方程式
二.单质、氧化物、酸、碱、盐的相互关系
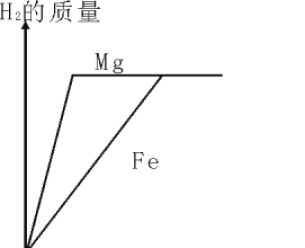
(1)金属单质+酸---盐+氢气(置换反应) 1.锌和稀硫酸Zn+H 2SO4=ZnSO4+H 2 ↑(最常用)
(实验室制H2用的金属有Zn,Fe,Mg,Al,酸有稀H2SO4和稀HCl) (2)金属单质+盐(溶液)---另一种金属+另一种盐 2.铁和硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu
3.铝和硝酸银溶液反应:Al+3AgNO3=Al(NO3)3+3Ag (3)碱性氧化物(金属氧化物)+酸---盐+水
4.氧化铁和稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H 2 O
5.氧化钙和稀盐酸反应:CaO+2HCl=CaCl2+H 2 O (4)酸性氧化物(非金属氧化物)+碱--------盐+水
6.苛性钠暴露在空气中变质:2NaOH+CO2=Na2CO3+H 2 O 7.消石灰放在空气中变质:Ca(OH)2+CO2=CaCO3↓+H 2 O (5)酸+碱--------盐+水(中和反应)
8.盐酸和烧碱反应:HCl+NaOH=NaCl+H2O
9.盐酸和氢氧化钙反应:2HCl+Ca(OH)2=CaCl2+2H 2 O
10.氢氧钠和硫酸反应:2NaOH + H2SO4==Na2SO4+2H2O 3 2 4 (6)酸+盐--------另一种酸+另一种盐
11.大理石与稀盐酸反应:CaCO3+2HCl=CaCl2+H 2 O+C O 2 ↑(实验室制CO2) 12.碳酸钠与稀盐酸反应:Na 2CO3 +2HCl=2NaCl+H 2 O+CO 2 ↑ 13.硫酸和氯化钡溶液反应:HSO4+BaCl2=BaSO4↓+2HCl (7)碱+盐---另一种碱+另一种盐
14.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
15.硫酸铜溶液与氢氧化钡:CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓ (8)盐+盐---两种新盐
16.氯化钠溶液和硝酸银溶液:NaCl+AgNO3=AgCl↓+NaNO3
17.硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2NaCl
复分解反应必须生成沉淀,气体或水生成才能发生,且生成物的元素化合价不变。 +1价:HClO;NaClO;Ca(ClO)2. +5价:HClO3;KClO3.
+7价:HClO4;KClO4.
