酸、碱、盐复习(1)
班级______________姓名______________序号_____________
一、回忆酸碱盐的性质,并在每种反应后各举一例
使石蕊_________
与酸碱指示剂 使酚酞 _________
酸 与活泼金属→_____________________
与金属氧化物→_____________________
(碱性氧化物)
与碱→___________________________ (中和反应)
与盐→___________________________
使石蕊 __________
与酸碱指示剂 使酚酞 __________
碱 与非金属氧化物→_____________________(非复分解反应) (酸性氧化物,如_______、________、________)
与酸→_________________________
与盐→_________________________
与金属→_______________________
盐 与酸→________________________
与碱→________________________
与盐→_________________________
二、写出符合下列要求的物质的化学式
不溶于水也不溶于硝酸的盐___________、_________;蓝色的沉淀___________; 红褐色的沉淀_____________;黄色溶液__________________________________; 浅绿色的溶液________________________;蓝色溶液_______________________; 有吸水性的酸___________;有挥发性的酸_________________;白色不溶于水的碱_____________________;白色不溶于水的碳酸盐_______________________。 一般不参与复分解反应的盐是__________________;显碱性的盐是___________。
三、判断下列置换反应能否进行,能反应的写出方程式,不能进行的请说明理由。
1、 铁与稀硫酸_____________________________________________________
2、 钠与盐酸_______________________________________________________ 1
3、 铜与盐酸_______________________________________________________
4、 锌与硝酸_______________________________________________________
5、 铁与硝酸银_____________________________________________________
6、 铜与硝酸汞_____________________________________________________
7、 铝与氯化铜_____________________________________________________
8、 铜与硫酸锌_____________________________________________________
9、 镁与硫酸亚铁___________________________________________________
10、钠与硫酸铜___________________________________________________
11、锌与氯化银___________________________________________________
12、钾与稀硫酸____________________________________________________
四、判断下列复分解反应能否进行,能反应的写出方程式,不能进行的请说明理由。
1、 氧化铜与硝酸____________________________________________________
2、 碳酸钾与硫酸____________________________________________________
3、 氢氧化铝与盐酸__________________________________________________
4、 盐酸与硫酸铜____________________________________________________
5、 氢氧化钠与氯化铁________________________________________________
6、 碳酸钡与硝酸____________________________________________________
7、 氢氧化铁与硫酸铜________________________________________________
8、 碳酸钠与氢氧化钡______________________________________________
9、 硝酸钾与氯化镁________________________________________________
10、碳酸钙与硝酸铜_______________________________________________
11、碳酸钾与硝酸钙_______________________________________________
12、硫酸镁与氯化钡_______________________________________________
五、判断下列反应能否进行,能反应的写出方程式,不能进行的请说明理由。
1、 二氧化硫与火碱____________________________________________________
2、 氢氧化钡与二氧化碳________________________________________________
3、 氢氧化铜与二氧化碳________________________________________________
4、 氢氧化钾与三氧化硫________________________________________________
5、 氢氧化钙与纯碱____________________________________________________
6、 硫酸铵与氢氧化钾__________________________________________________
7、 氧化钠与水________________________________________________________
8、 氧化铜与水________________________________________________________
2
五、写出制取硫酸镁的反应方程式:
_________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________
六、写出制取氯化锌的反应方程式:
_________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________
七、用化学方程式除去下列物质中的杂质(括号内为杂质)
1、HCl(H2SO4)________________________________________________________________
2、HNO3(HCl)______________________________________________________________
3、BaCl2(MgCl2)______________________________________________________________
4、NaCl(Na2CO3)____________________________________________________________
5、NaOH(Na2CO3)____________________________________________________________
6、MgSO4(CuSO4)____________________________________________________________
7、KCl(NH4Cl)_______________________________________________________________
8、KNO3(CuSO4)____________________________________________________________
9、CaO(CaCO3)________________________________________________________________
10、CO(CO2)________________________________________________________________
11、CO2(CO)________________________________________________________________
12、BaCl(_______________________________________________________________ 2NaCl)
八、写出下列物质间能发生的反应方程式
Fe CO2 Fe2O3 HCl NaOH CuSO4
_____________________________________、_______________________________________ _____________________________________、_______________________________________ _____________________________________、_______________________________________ Cu SO2 KOH Cu(OH)2 H2SO4 MgCl2
_____________________________________、_______________________________________ _____________________________________、_______________________________________
九、练习
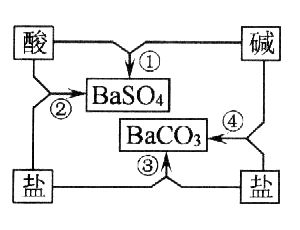
1、右图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式:酸 、碱 。
3
(2)写出图中反应②和④的化学方程式:
②
④
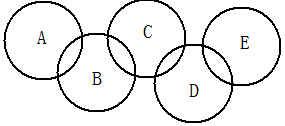
2、如图,A、B、C、D、E各代表铁、水、二氧化碳、硫
酸铜溶液、氢氧化钡溶液中的一种物质。常温下,相连
环物质间能发生反应,不相连环物质间不能发生反应,
且B的相对分子质量大于D。请填空:
(1)写出下列物质的化学式:A ,B ,D 。
(2)相连环物质间发生的反应,没有涉及的基本反应类型是______________________。
3、两种溶液混合,生成了一种沉淀。用酸碱盐的知识回答下列问题。
(1)若两种溶液均为无色,生成的白色沉淀不溶于稀硝酸,则两种溶液中的溶质可能是 和 ;
(2)若两种溶液均为无色,生成的白色沉淀溶于稀硝酸且有气体产生,则两种溶液中的溶
质可能是 和 ;
(3)若一种溶液有色,另一种无色,生成的沉淀溶于稀盐酸且无气体产生,沉淀可能是_______
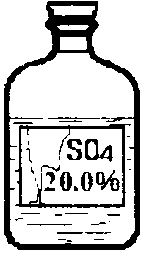
4、小兵同学在化学实验室发现一瓶盛有无色溶液的试剂瓶,其标签严重破损
(如右图所示)。老师告诉他,这瓶试剂可能是硫酸、硫酸钠、硫酸镁溶
液中的一种。小兵同学通过查阅资料得知,常温下这三种物质的溶解度
如下表:
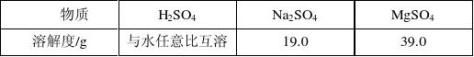
小兵同学根据上述信息.分析认为此溶液一定不是 溶液。为确定其成分,
该同学对此溶液进行如下实验探究:
。
【实验验证】

4
第二篇:酸碱盐知识点总结及汇总
酸碱盐知识点总结
一、酸及酸的通性
+酸的定义,电离时生成的阳离子全部都是H。酸是由氢离子和酸根离子构成。
1
2.酸的通性: 盐 酸 HCl 硫 酸 H2SO4
酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气 Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑
碱性氧化物+酸→盐+水 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 碱+酸→盐+水 NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O
盐+酸→另一种盐+另一种酸 AgNO3+HCl=AgCl↓+HNO3 BaCl2+H2SO4=BaSO4↓ +2HCl 注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;指在金属活动顺序表中排在‘氢’前面的活泼金属排在‘氢’后不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
二、碱及碱的通性
-定义:电离时生成的阴离子全部是OH离子。碱是由金属离子(或铵根离子)和氢氧根离
子构成。
1
碱使紫色石蕊试液变蓝,使无色酚酞试液变红。 氢氧化钠使紫色石蕊试液变蓝,无色酚酞试液变红。 氢氧化钙使紫色石蕊试液变蓝,无色酚酞试液变红。
酸性氧化物+碱→盐+水 2NaOH+CO2=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O
酸+碱→盐+水 NaOH+HCl=NaCl+H2O Ca(OH)2+H2SO4= CaSO4+2H2O
盐+碱→另一种盐+另一种碱 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
注意:(1)只有可溶性碱才能跟一些非金属氧化物发生反应,这些非金属氧化物是酸性氧化物。酸性氧化物多数能溶于水,跟水化合生成酸。
(2)盐和碱反应时,必须两者都是可溶的,且生成物之一是沉淀,反应才能进行。
(3)书写碱跟某些金属氧化物反应的化学方程式
关于这类反应化学方程式的书写有人感到很困难,为此,可先写出非金属氧化物跟水反应,生成含氧酸的化学方程式,再以含氧酸和碱相互交换成分写出生成物。两式合并成一个化学方程式。如,三氧化硫跟氢氧化钠反应:
三、常见的盐及盐的性质
+1、常见的盐 定义:能解离出金属离子(或NH4)和酸根离子的化合物。
注:此时的盐不是指食盐,食盐的主要成分是NaCl。
2、精盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
(1)、实验步骤:溶解、过滤、蒸发
过滤 蒸发
注意:① 蒸发皿是可以直接加热的仪器,液体体积不能超过蒸发皿2/3.
② 溶解时用玻璃棒搅拌,目的是加快溶解。
③ 加热时用玻璃棒搅拌,防止局部温度过高造成液滴飞溅
④ 待蒸发皿中出现较多固体时停止加热,利用余热使滤液蒸干,不能将滤液完全蒸干才停对于止加热。
3.盐的化学性质:
盐溶液+金属→盐ˊ+金属ˊ CuSO4+Zn= ZnSO4+Cu
盐+酸→盐ˊ+ 酸ˊ BaCl2+H2SO4=BaSO4↓ +2HCl
盐溶液+碱溶液→盐ˊ+碱ˊ 3NaOH+FeCl3=3NaCl+Fe(OH)3 ↓
盐溶液+盐溶液→盐ˊ+盐ˊ AgNO3+NaCl=AgCl↓+NaNO3
注意:在金属活动顺序表中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来。但K、Ca、Na三种金属与盐溶液的反应特殊,这里不要求。
四、明确复分解反应发生的本质,掌握酸碱盐反应的规律
1.复分解反应及其发生的条件
复分解反应的定义是:由两种化合物相互交换成分,生成另外两种化合物的反应。 通式:AB+CD=AD+CB
发生的条件:两种物质在溶液中相互交换离子,生成物中如果有沉淀析出、气体放出或有水生成,复分解反应均可以发生。
3.碱与酸性氧化物反应不属于复分解反应
五、熟记酸、碱、盐的溶解性
酸、碱、盐的溶解性记忆口诀:碱中氨、钾、钠、钡、钙可溶
钾钠铵盐硝酸盐, 全部都属可溶盐。
硫酸盐不溶钡和铅;氯化物不溶银亚汞, 碳酸盐除钾钠铵溶,其它不溶。
六、几个常见离子的检验
-1.Cl离子的检验
实验操作 实验现象 实验结论 化学方程式
取少量样品于试管中,滴加AgNO3溶液和稀HNO3 有不溶于稀硝酸的白色沉淀生成 样品含
-有Cl AgNO3+KCl=AgCl↓+KNO3
2-2.SO4离子的检验:取少量样品于试管中,滴加Ba(NO3)2溶液和稀HNO3 有不溶于稀硝酸
2- 的白色沉淀生成 样品含有SO4Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
2-3. CO3离子的检验 :取少量样品于试管中,滴加稀HCl,将生成的气体通入澄清石灰水
2-有无色气体生成,该气体使澄清石灰水变浑浊 样品含有CO3
K2CO3+2HCl=2KCl+ CO2↑+H2O CO2+Ca(OH)2= CaCO3↓+ H2O
4、 检验NH4:取少量待检物于洁净的试管中,滴入适量NaOH溶液并加热,有使湿的红色石蕊试纸变成蓝色的气体产生。
5、 鉴别稀盐酸和稀硫酸——分别取少量待检液体于两支洁净的试管中,各滴入几滴BaCl2溶液,有白色沉淀产生的原溶液是稀硫酸,无现象产生的原溶液是稀盐酸。
七、熟记常见元素和原子团的化合价口诀:
(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘; 负二价:氧和硫。(可变正价):一二铜汞,二三铁,二四碳,四六硫。
(原子团的化合价)
负一价:氢氧根(OH),硝酸根(NO3),氯酸根(ClO3),高锰酸根(MnO4); 负二价:硫酸根(SO4),碳酸根(CO3),亚硫酸根(SO3),锰酸根(MnO4); 负三价:磷酸根(PO4); 正一价:铵根(NH4)。
八、熟记常见物质的俗称、主要成分和化学式:
生石灰—— CaO 熟石灰——Ca(OH)2 石灰石、大理石—— CaCO3 食盐——NaCl 火碱、烧碱、苛性钠—— NaOH 纯碱、苏打——Na2CO3 小苏打—— NaHCO3 铁锈、赤铁矿——Fe2O3 赤铁矿—— Fe3O4 金刚石、石墨—— C 干冰——CO2 冰—— H2O 天然气(甲烷)——CH4 酒精(乙醇)—— C2H5OH 醋酸(乙酸)——CH3COOH 九常见物质的颜色:
红色的固体——Cu、Fe2O3 、P(红磷)
黑色的固体——C、CuO、Fe3O4、FeO、MnO2
白色的固体——KClO3、P2O5、P(白磷)、CuSO4(无水硫酸铜)、KCl、NaCl等 暗紫色的固体——KMnO4 黄色的固体—— S
蓝色的固体——CuSO4?5H2O 蓝色沉淀——Cu(OH)2
红褐色沉淀——Fe(OH)3 常见不溶于酸的白色沉淀——BaSO4、AgCl
溶于酸并放出使澄清石灰水变浑浊的气体的白色沉淀——BaCO3、CaCO3溶于酸但不产生气体的白色沉淀——Mg(OH)2、Al(OH)3等不溶性碱的沉淀
2+蓝色的溶液—— CuSO4、CuCl2、Cu(NO3)2等含Cu溶液
2+浅绿色的溶液——FeSO4、FeCl2等含Fe溶液
3+黄色的溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3等含Fe溶液
◎补充下列反应方程式:
1、 氢氧化铜跟稀盐酸反应: Cu(OH)2 + 2HCl = CuCl2 + 2H2O 蓝色沉淀消失
2、 氢氧化铜跟稀硫酸反应: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O 变成蓝色溶液
3、 氢氧化钠跟硫酸铜溶液反应:2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 ↓ 有蓝色沉淀产生
4、 氢氧化钠跟氯化铁溶液反应:3NaOH + FeCl3 = Fe(OH)3↓ +3NaCl 有红褐色沉淀产生 ◎判断溶液的酸碱性——用指示剂,溶液的酸碱度——用pH来表示。
◎干燥剂的选择:
1、浓硫酸可干燥:酸性气体(如:CO2、SO2、SO3、NO2、HCl、)中性气体(如:H2、O2、N2、CO) ※不能干燥碱性气体(如:NH3)
2、氢氧化钠固体、生石灰、碱石灰可干燥:碱性气体(如:NH3)
中性气体(如:H2、O2、N2、CO) ※不能干燥酸性气体(如:CO2、SO2、SO3、NO2、HCl、)
3、无水硫酸铜固体遇水由白色变蓝色,可检验水的存在,并吸收水蒸气。 +
