实验七铅、铋混合液中铅、铋含量的连续测定教案
课程名称:分析化学实验B
教学内容:以二甲酚橙为指示剂连续测定铅、铋混合液中铅、铋含量
实验类型:验证
教学对象:化工、环境工程、药学、生物科学、应用化学、医学检验、制药、复合材料、生物工程、生物技术
授课地点:中南大学南校区化学实验楼302
授课学时:4学时
一、教学目的与要求
1、练习巩固移液管、滴定管的正确使用;
2、了解铅、铋混合液中铅、铋含量连续测定的意义;
3、巩固EDTA标准溶液的配制与标定;
4、学习利用酸效应曲线进行混合液中金属离子连续滴定的条件选择;
5、掌握铅、铋连续测定的原理、方法和计算;
6、熟悉二甲酚橙(XO)指示剂终点颜色判断和近终点时滴定操作控制
二、知识点
配位反应、化学计量点、金属指示剂、指示剂的僵化和封闭现象、滴定终点、酸效应曲线、标准溶液、移液管、酸式滴定管、实验报告的撰写(数据处理三线表表格化)、有效数字
三、技能点
玻璃器皿的洗涤、移液管的使用、酸式滴定管的使用、标准溶液的配制与标定
四、教学重点及难点
重点:锌标准溶液标定EDTA标准溶液;控制酸度的办法进行金属离子连续滴定的原理;络合滴定中缓冲溶液的作用
难点:控制酸度的办法进行金属离子连续滴定的原理
五、教学方法
任务驱动法、分组讨论法、阅读指导法、现场讲解指导等
六、复习引入
1、复习配位滴定法有关知识,提问学生:
(1)二甲酚橙指示剂在滴定终点的颜色如何变化的?(由紫红色变成黄色)
(2) EDTA配位滴定法测定铋和铅时,溶液的pH值分别控制在多少?(1和5~6)
(3)EDTA配位滴定法测定铋和铅时,分别用什么溶液控制溶液的pH值?(硝酸和六次甲基四胺)
[引入] EDTA配位滴定法的应用:以二甲酚橙为指示剂连续测定铅、铋混合液中铅、铋含量
[引言] 铅铋合金是一种重要的材料,在许多的领域中得到应用。在医疗领域,用做特定形状的防辐射专用挡块;在模具制造领域,用作铸造制模,模具装配调试等;在电子电气、自动控制领域,用作热敏元件、保险材料、火灾报警装置等;在折弯金属管时,作为填充物;在做金相试样时,作为嵌镶剂以及液力偶合器用。合金中各元素的含量直接影响合金的性能,铅铋含量的高低成为评价其产品质量的主要指标。
[新授]课题:铅、铋混合液中铅、铋含量的连续测定
[提出任务]教师提出本课题的学习任务:
1、铅、铋混合液中铅、铋含量的连续测定的基本原理是什么?
2、以二甲酚橙为指示剂,用Zn2+标定EDTA浓度的实验中,溶液的pH为多少?
3、铅、铋混合液中铋、铅含量的连续测定的操作方法。
[任务探索]
1、铅、铋混合液中铅、铋含量的连续测定的基本原理是什么?
根据有关学习资料,思考下列问题:
(1) 络合滴定中,准确分别滴定的条件是什么?
(2) 滴定Pb2+时要调节溶液pH为5~6,为什么加入六亚甲基四胺而不加入醋酸钠?
(3) 能否取等量混合试液两份,一份控制pH≈1,滴定Bi3+,而另一份控制pH为5~6滴定Pb2+、Bi3+总量?为什么?
[归纳]引导学生归纳总结出铅、铋含量的连续测定的基本原理
Bi3+、Pb2+均能与EDTA形成稳定的络合物,其lgK值分别为27.94和18.04,两者稳定性相差很大,ΔpK=9.90>5。因此,可以用控制酸度的方法在一份试液中连续滴定Bi3+和Pb2+。在测定中,均以二甲酚橙(XO)作指示剂,XO在pH<6时呈黄色,在pH>6.3时呈红色;而它与Bi3+、Pb2+所形成的络合物呈紫红色,它们的稳定性与Bi3+、Pb2+和EDTA所形成的络合物相比要低;而且KBi-XO> KPb-XO。测定时,先用HNO3调节溶液pH=1.0,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为滴定Bi3+的终点。然后加入六次甲基四胺溶液,使溶液pH为5~6,此时Pb2+与XO形成紫红色络合物,继续用EDTA标准溶液滴定至溶液由紫红色突变为亮黄色,即为滴定Pb2+的终点。反应如下:
pH=1.0
滴定前:XO + Me(Bi3+) = Me-XO
(黄色) (紫红色)
滴定开始至化学计量点前:H2Y2- + Bi3+ = BiY- + 2H+
计量点时:H2Y2- + Bi-XO = BiY- + XO + 2H+
(紫红色) (黄色)
pH=5.5
滴定前:XO + Me(Pb2+) = Me-XO
(黄色) (紫红色)
滴定开始至化学计量点前:H2Y2- + Pb2+ = PbY2- + 2H+
计量点时:H2Y2- + Pb-XO = PbY2- + XO + 2H+
(紫红色) (黄色)

以含 Bi 3+、Pb 2+的物质的量浓度(mol·L -1)表示Bi 3+、Pb 2+含量,可由下式计算:
[学生回答]
(1)络合滴定中,准确分别滴定的条件是什么?
[讲解]络合滴定中,准确分别滴定的条件是△lgcK≥5。
(2) 滴定Pb2+时要调节溶液pH为5~6,为什么加入六亚甲基四胺而不加入醋酸钠?
[讲解] 在选择缓冲溶液时,不仅要考虑它的缓冲范围或缓冲容量,还要注意可能引起的副反应。在滴定Pb2+时,若用NaAc调酸度时,Ac-能与Pb2+形成络合物,影响Pb2+的准确滴定,醋酸钠生成醋酸和硝酸钠难于控制溶液的酸度,所以用六亚四基四胺调酸度。加入六亚甲基四胺避免了上述问题,六亚甲基四胺和质子化的六亚甲基四胺组成缓冲溶液控制溶液的酸度,调节溶液pH为5~6。
(3) 能否取等量混合试液两份,一份控制pH≈1,滴定Bi3+,而另一份控制pH为5~6滴定Pb2+、Bi3+总量?为什么?
[讲解] 不能取等量混合试液两份,一份控制pH≈1,滴定Bi3+,而另一份控制pH为5~6滴定Pb2+、Bi3+总量,因为pH为5~6,Bi3+已发生水解生成沉淀,不被EDTA溶液滴定。只有Pb2+被滴定,因而不能测出Pb2+、Bi3+总量。
2、以二甲酚橙为指示剂,用Zn2+标定EDTA浓度的实验中,溶液的pH为多少?
[讲解]: 六次甲基四胺与盐酸反应为:
(CH2)6N4+HCl==(CH2)6NH+·Cl-
(0.01000锌标准溶液的配制是:准确称取基准氧化锌0.2035克,用10mL6mol/L盐酸溶解定容至250mL,分取25.00mL锌标准溶液标定EDTA溶液的准确浓度)
反应中盐酸的物质的量:
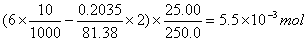
六次甲基四胺的物质的量:(六次甲基四胺加入量一般为10mL)
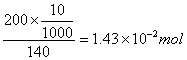
故六次甲基四胺过量。
缓冲体系中剩余六次甲基四胺的浓度为:
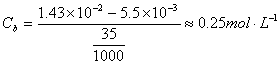
六次甲基四胺盐的浓度为:

根据一般缓冲溶液计算公式:
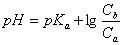
得:



(六次甲基四胺pKb=8.85)
3、铅、铋混合液中铋、铅含量的连续测定的操作方法。
[阅读] 指导学生阅读实验报告中的实验步骤。
[讨论] 四个学生一组,归纳测定操作要点。
[提问] 学生代表小组发言:水的总硬度测定步骤
(1) 0.01mol/L EDTA标准溶液的标定
准确移取25.00ml浓度为0.01000 mol·L-1Zn2+标准溶液3份, 置于250ml 的锥形瓶中,加入二甲酚橙指示剂2~3滴,滴加200g·L-1六次甲基四胺溶液至溶液显示紫红色后再过量5mL,用欲标定的EDTA溶液滴定到由紫红色变为黄色即为终点,记录消耗的EDTA溶液体积,根据滴定时用去的EDTA溶液体积计算EDTA溶液的准确浓度。
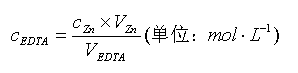
(2) 铅、铋混合液中铋、铅含量的连续测定
用移液管移取20.00ml Bi3+、Pb2+ 混合试液于已加入10ml 0.10mol·L-1 HNO3的250ml锥形瓶中,加2滴二甲酚橙,用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记取V1(ml),然后滴加200g·L-1六次甲基四胺溶液至溶液显示紫红色后再过量5mL,补加二甲酚橙指示剂2~3滴,继续用EDTA标准溶液滴定溶液由紫红色突变为亮黄色,即为终点,记下V (ml),并计算V2=V-V1。平行测定三份,计算混合试液中Bi3+和Pb2+ 的含量(mol·L-1)。
(3) 数据记录与处理及结论
1、EDTA溶液的标定
表1 EDTA标准溶液的浓度

 序号 V(Zn2+)/ml V(EDTA)/ml C(EDTA)/(mol·L-1) 平均值 RSD
序号 V(Zn2+)/ml V(EDTA)/ml C(EDTA)/(mol·L-1) 平均值 RSD
1
2
 3
3
结论:EDTA标准溶液的浓度c=
95%置信度下平均值的置信区间c=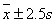
2、铅、铋混合液中铅、铋含量的连续测定
表2 混合液中铋的含量
 序号 混合液体积/ml V1/ml CPb/ mol ?L-1 CPb平均值 RSD
序号 混合液体积/ml V1/ml CPb/ mol ?L-1 CPb平均值 RSD
 1
1
2
 3
3
结论:混合液中铋的浓度c=
95%置信度下平均值的置信区间c=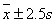
表3 混合液中铅的含量
 序号 混合液体积/ml V2/ml CBi/ mol ?L-1 CBi平均值 RSD
序号 混合液体积/ml V2/ml CBi/ mol ?L-1 CBi平均值 RSD
 1
1
2
 3
3
结论:混合液中铅的浓度c=
95%置信度下平均值的置信区间c=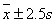
[小结] 用EDTA标准溶液滴定连续测定铅、铋含量常应用于铅铋合金中铋和铅的分析方法。在pH=l.0的硝酸强酸性缓冲溶液中,以二甲酚橙为指示剂,用EDTA标准溶液滴定铅、铋样品溶液由紫红色变黄色(约带橙色)为终点,记录EDTA标准溶液消耗体积计算铅、铋样品溶液中铋的含量;之后,用六次甲基四胺调节溶液的pH值,在pH=5~6的六次甲基四胺缓冲溶液中,以二甲酚橙为指示剂,继续用EDTA标准溶液滴定铅、铋样品溶液由紫红色变亮黄色为终点,记录EDTA标准溶液消耗体积计算铅、铋样品溶液中铅的含量。
[演示] 学生代表上讲台演示测定操作过程,其余学生观察其操作。
[讲解、示范] 教师点评学生演示操作过程的正误之处并讲解示范操作要点:
(1) 取样的方法:取样量20.00mL,取样仪器:移液管
(2) 移液管的操作:吸液、调整液面的方法、放液
(3) 酸式滴定管的操作:左手的用法,防止管尖和两侧漏液
(4) 终点判断:待滴定至溶液为紫红色变浅时即接近终点,要注意每加一滴EDTA都需充分摇匀,最好每滴间隔2-3s,滴到黄色即为终点。
[讲解注意事项]
1、慢滴强摇,勿过头。
2、滴定终点:
标定EDTA----紫红色突变为亮黄色
测定Bi----紫红色变为黄色(微带橙)
测定Pb----紫红色变为亮黄色
3、测Bi3+时,滴定前及滴定初期,不要多用水冲洗锥形瓶口,以防Bi3+水解。
4、标定EDTA溶液和测定Pb2+含量时,终点不明显可加热至50~60℃,使终点易于辨别。测Pb2+含量时,在滴定Bi3+后调节pH值,滴加EDTA溶液至近终点再加热,然后小心滴至铅的终点。否则,可能出现白色沉淀,影响终点的判断。
[学生分组] 以每个同学一组分为24~30个小组
[学生实训] 连续测定铅、铋混合液中铋、铅含量并完成实验报告。教师巡回指导
[交流讨论] 引导学生说出自己完成任务的情况 (成功或失误之处)
[试验小结] 教师小结本课题实验完成情况。
1、酸式滴定管的规范操作:克服漏液的现象;
2、近终点时颜色判断和操作:近终点慢滴多摇,控制半滴操作;
3、分析误差产生原因:滴定速度控制不当;终点判断不准确;读数误差;酸式滴定管管尖和两侧漏液等因素。
[布置作业]:根据你的测定,我们本地区的所应用的铅铋合金属于那个级别?(写出测定实验操作步骤、实验数据和测定结果)
第二篇:铋混合液中铅、铋含量的连续测定
EDTA标准溶液的配制和标定及铅、铋混合液中铅、铋含量的连续测定
四川农业大学生命科学与理学院指导老师:吴明君
傅宏铭(20122987)全昌乾(20122988)
摘要:在EDTA标准溶液的配制和标定实验中,学习EDTA标准溶液的配制和标定方法;掌握配位滴定的原理,了解配位的特点。称取一定质量的乙二胺四乙酸二钠固体(AR)配成溶液,用ZnO基准物标定,并用二甲酚橙作为指示剂来标定EDTA的浓度。平行进行5次滴定,测得 EDTA的浓度为0.01978mol/L.接着再用标定的EDTA溶液测量铅、铋混合液中铅、铋的含量。平行进行5次滴定,测得铋的浓度为0.009627 mol/L,铅的浓度为0.009611 mol/L。
关键词:EDTA;基准物;连续测定;二甲酚橙
EDTA preparation and calibration of standard solution and lead, bismuth, lead, bismuth content in the mixed solution of continuous determination
College of life and basic science, Sichuan Agricultural University
Directed by Wu mingjun
Fu hongming(20122987) Quan changqian(20122988)
Abstract: In the EDTA standard solution preparation and calibration experiments, the preparation and calibration method study of EDTA standard solution; master the principle of coordination titration, understand the characteristics of coordination. Take the quality of ethylenediaminetetraacetic acid two sodium (AR) solid solution with ZnO, calibration with the base material , and two xylenol orange as indicator to calibrate the EDTA concentration. Parallel 5 titration, the measured EDTA concentration of 0.01978mol/L. followed by EDTA calibration solution measurements of lead, bismuth in the mixed solution of lead, bismuth content. Parallel 6titration, the measured concentration of bismuth is 0.009627 mol/L, the lead concentration is 0.009611mol/L.
Keywords: EDTA; standard substance; continuous measurement; two xylenol orange
EDTA配合物特点:广泛配位性:它几乎能与所有Mn+配位形成螯合物;稳定性:5个五元环螯合物→稳定、完全、迅速;具6个配位原子,与金属离子多形成1:1配合物,能溶于水;与无色离子形成无色配合物;与有色金属离子形成颜色更深的同色配合物。标定EDTA溶液常用的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4?7H2O、Hg、Ni、Pb等。本文采用ZnO为基准物,二甲酚橙作为指示剂来标定EDTA的浓度。测定Pb2+和 Bi3+均以二甲酚橙为指示剂。二甲酚橙属于三类甲烷类指示剂,易溶于水,它有七级酸式解离,其中H7In至H3In4?呈黄色、H2In5?至In7?呈红色。所以它在溶液中的颜色随酸度而变,在pH<6.3时呈黄色,pH>6.3时呈红色。二甲酚橙与Pb2+和 Bi3+的配合物呈紫红色,它们的稳定性与Pb2+与 Bi3+和EDTA所呈配合物的相比要弱一些。
1 实验方法
1.1 仪器与试剂
50ml酸、碱式滴定管各一支;250mL容量瓶一只;25mL移液管一支;10mL移液管2支、250mL锥形瓶若干;量筒;分析天平,精密pH试纸(0.5~5)。
ZnO基准物(AR);二甲酚橙指示剂;200g?L?1六亚甲基四胺溶液;0.1 mol/LHNO3溶液;0.5 mol/LNaOH溶液,1+1HCl;Bi3+、Pb2+混合液(Bi3+、Pb2+各约为0.010mol?L-1含HNO30.15mol?L-1)。
1.2 实验方法及步骤
EDTA标准溶液的配制:量取3.7227gEDTA于棕色瓶中,加入温热的蒸馏水稀释至500mL左右溶解,摇匀。
ZnO基准物的配制:置ZnO基准物基准物于称量瓶中,准确称取0.5862g与烧杯中,加水润湿,再从杯嘴边逐滴加入数毫升1+1HCl至完全溶解,,然后转移250mL容量瓶中,稀释至刻度,摇匀。
EDTA的标定:用移液管移取25mL锌标准溶液于锥形瓶中,加4滴二甲酚橙指示剂,然后滴加200g?L?1六亚甲基四胺溶液呈稳定的紫红色后再3mL,接着用EDTA溶液滴定至溶液由紫红色变为亮黄色,即为终点。
铋离子的滴定:移取25ml试液六份,分别置于250ml锥形瓶中。取一份做初步实验,先以pH为0.5到5范围的精密pH试纸试验试液的酸度,一般来说不带沉淀的含铋离子的试液其pH应在1以下,为此以0.5mol/L的氢氧化钠溶液调解之遍滴边搅拌,并时时以精密pH试纸试之,至溶液pH达到1为止,记下所加的氢氧化钠的体积。接着加入10ml0.1mol/L的硝酸溶液及四滴二甲酚橙指示剂,用EDTA滴定至溶液由紫红色变为棕红色,再加一滴突变为亮黄色,即为终点,记下粗略读数,开始正式滴定。取另一份25ml试液,加入初步实验中,调节酸度时所需的相同体积的氢氧化钠溶液,接着再加十毫升0.1mol/L硝酸溶液及四滴二甲酚橙指示剂,用EDTA标准溶液滴定至终点变化同上,在离终点一至两毫升前可滴加得快一些,近终点时则应忙些,没加一滴摇动并观察是否变色。
铅离子的滴定:在滴定的铋离子的溶液中滴加两百克每升的六亚甲基四按至溶液呈紫红色,再过量五毫升,以EDTA标准溶液滴定至溶液由紫红色突变为亮黄色为终点。记下读数。
2 结果与讨论
2.1 EDTA标准溶液的标定
EDTA标准溶液的标定数据处理见表一。
表一 EDTA标准溶液的标定
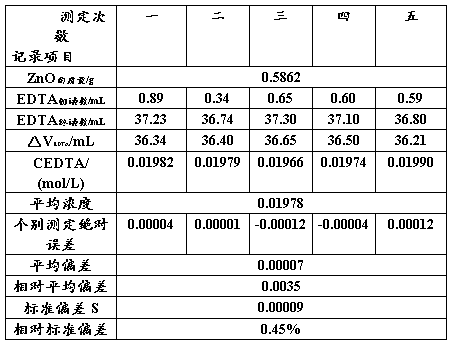
用Q检验法进行检验,可疑值为0.01974,Q=(0.01974-0.01966)-(0.01990-0.01966)=0.33。
由Q值表[7]得置信度为90%时,测定5次的Q表=0.64,Q大于Q表,这个数据应保留。
2.2铅、铋混合液中铅、铋含量的连续测定
铅、铋混合液中铅、铋含量的连续测定数据处理见表二。
表二铅、铋混合液中铅、铋含量的连续测定
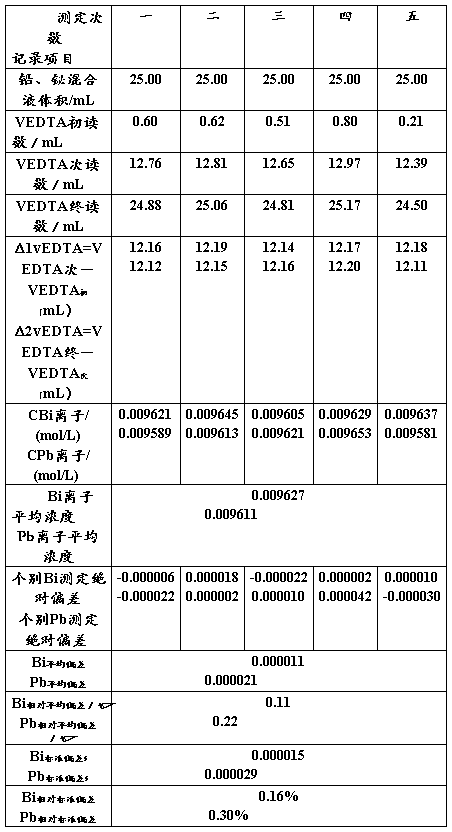
对铋进行检验:用Q检验法进行检验,可疑值为0.009621,Q=(0.009621-0.009605)-(0.009649-0.009605)=0.36。由Q值表[7]得置信度为90%时,测定5次的Q表=0.64,Q大于Q表,这个数据应保留。
对铅进行检验:用Q检验法进行检验,可疑值为0.009653,Q=(0.009653-0.009621)-(0.009653-0.009581)=0.0.44。由Q值表[7]得置信度为90%时,测定5次的Q表=0.64,Q大于Q表,这个数据应保留。
2.3 指示剂的选择及用量
本次实验以二甲酚橙为指示剂。二甲酚橙属于三类甲烷类指示剂,易溶于水,它有七级酸式解离,其中H7In至H3In4?呈黄色、H2In5?至In7?呈红色。所以它在溶液中的颜色随酸度而变,在pH<6.3时呈黄色,pH>6.3时呈红色。二甲酚橙与Pb2+和 Bi3+的配合物呈紫红色,它们的稳定性与Pb2+与 Bi3+和EDTA所呈配合物的相比要弱一些。因此选择二甲酚橙,还有就是本次试验的指示剂可以把用量调大一点,以增加显色。
2.4注意事项
a.测定Bi3+时若酸度过低,Bi3+将水解,产生白色浑浊,会使终点过早出现,而且产生回红现象,此时放置片刻,继续滴定至透明的稳定的亮黄色,即为终点。
b.指示剂应做一份加一份。
c.滴定速度要慢,并且充分摇动锥形瓶。
致谢四川农业大学吴明君老师的指导和四川农业大学11教分析实验室所提供的试剂与仪器。
参考文献
[1] 四川大学化工学院,浙江大学化学系编. 分析化学实验.第三版.北京:高等教育出版社,2003.6(2009重印):101-103
[2] 武汉大学,中国科学技术大学,中山大学,吉林大学编.分析化学.第五版(上册).北京:高等教育出版社,2006.7(2010重印):67
[3] 王仁国编.无机及分析化学实验.北京:中国农业出版社,2007.9:134-137
