一、实验目的
1. 理解电位窗口的意义;
2. 掌握阴极极化曲线和阳极极化曲线的使用方法;
3. 测量玻碳电极在酸性、中性和碱性溶液中的阳极和阴极极化曲线。
二、实验原理
水溶液电位窗口:溶液中,电极的析氧电位与析氢电位的差值,称为该电极在水溶液中的电位窗口(Potential Window)。
研究水溶液电位窗口的意义:电化学窗口越大,特别是阳极析氧过电位越高,对于在高电位下发生的氧化反应和合成具有强氧化性的中间体更有利。另外,对于电分析性能来说,因为电极上发生氧化还原反应的同时,还存在着水电解析出氧气和氢气的竞争反应,若被研究物质的氧化电位小于电极的析氧电位或还原电位大于电极的析氢电位,在电极达到析氧或者析氢电位前,被研究物质在阳极上得以电催化氧化或者还原,可以较好的分析氧化或还原过程。但若氧化或还原过程在电极的电势窗口以外发生,被研究物质得到的信息会受到析氢或析氧的影响,得不到最佳的研究条件甚至根本无法进行研究。
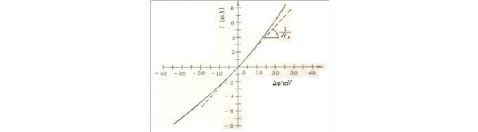
电位窗口的测定:可以应用阴极极化曲线和阳极极化曲线来测定。图1是某惰性电极在水溶液中的阴极极化(析氢)曲线)和阳极极化(析氧)曲线示意图。其中析氢或析氧电位使用切线法估求(如图2)。
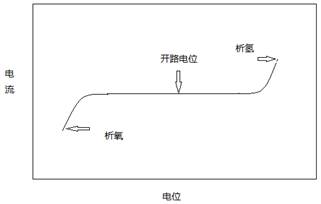
图1是某惰性电极在水溶液中的阴极极化(析氢)曲线)和阳极极化(析氧)曲线示意图。
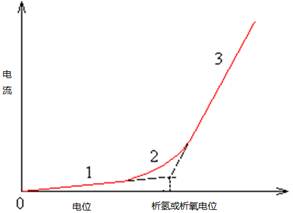
图2. 切线法估求析氢或析氧电位
三、实验器材
CHI电化学工作站;饱和甘汞电极;Hg/HgO电极;Hg/Hg2SO4电极;铂电极;玻碳电极;三口电解槽;0.2M K2SO4溶液;0.2M H2SO4溶液;0.2M NaOH 溶液
四、实验步骤
1. 配制250ml 0.2M K2SO4溶液和0.2M H2SO4溶液和0.2M NaOH 溶液;
2. 预处理玻碳电极,清洗参比电极和铂电极;
3.在电解槽中倒入其1/2体积的0.2M K2SO4溶液,在电解槽中适当位置,中间放入玻碳电极,玻璃膜的一侧放入铂电极,另一侧放入饱和甘汞电极,并用纸巾将电极悬空固定;
4. 打开CHI电化学工作站,并将其接线与电解槽中三电极接好,绿接玻碳电极(工作电极),白色接饱和甘汞电极(参比电极),红色接铂电极(对电极)。打开测试软件,测量并记录开路电位(Control——Open circuit voltage)。选择“阴极极化曲线”功能,输入参数,从开路电位扫描到析氢(初始电压为开路电压;终止电压为-2.0;选择Auto打勾)。扫速5mV/s。完成后保存实验结果(保存为txt格式并命名)。
5.取出铂电极,甩动(不需要断开与电化学工作站的连接),去除表面的气泡,放回电解池;取出玻碳电极,在砂纸上打磨至表面光滑,去除杂质,用去离子水冲洗,用滤纸擦干,放回电解池,并连接电化学工作站。
6.等待5min后,重新测量开路电压直到稳定,并记录电极开路电位。选择“阳极极化曲线”功能,输入参数(终止电压为+2.5,其他不变),从开路电位扫描到析氧。扫速5mV/s。完成后保存实验结果。
7.更换溶液,重复步骤2-5。H2SO4溶液中用Hg/Hg2SO4电极作参比电极;NaOH 溶液中用Hg/HgO电极作参比电极。
8.洗电极和电解槽,关闭仪器和电脑。(铂电极要酸浸)
五、实验数据处理及分析
(1) 对于同一种溶液,将阴极极化曲线和阳极极化曲线作在同一图中。共三张图。
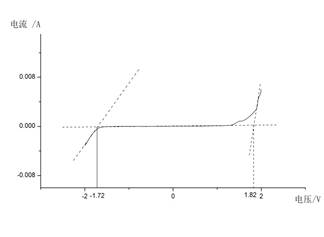
图1. 玻碳电极(vs. Hg/Hg2SO4)在0.2M H2SO4溶液中的阴极极化曲线和阳极极化曲线

图2 .玻碳电极(vs.饱和甘汞电极)在0.2M K2SO4溶液中的阴极极化曲线和阳极极化曲线
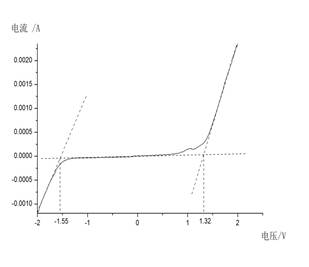
图3 .玻碳电极(vs. Hg/HgO)在0.2M NaOH溶液中的阴极极化曲线和阳极极化曲线
(2) 使用切线法估求玻碳电极在每种溶液中的析氢和析氧电位,并比较它们的大小 (比较前需要将这些电位换算为相对氢标电位)(饱和甘汞电位0.244V,Hg/HgO电极电位0.114V,Hg/Hg2SO4电极电位是0.614V).
因为Hg/Hg2SO4电极电位是0.614V
由图1,可以得到玻碳电极在0.2M H2SO4溶液中相对氢标电极
析氢电位φc=-1.72+0.614V=-1.106V
析氧电位φa=1.82+0.614V=2.434V。
因为饱和甘汞电位为0.244V
由图2,可得玻碳电极在0.2M K2SO4溶液中相对氢标电极
析氢电位φc=-1.83+0.244V=-1.586V
析氧电位φa=1.83+0.244V=2.074V。
因为Hg/HgO电极电位0.114V
由图3,可以得到玻碳电极在0.2M NaOH溶液中相对氢标电极
析氢电位φc=-1.55+0.114V=-1.436V
析氧电位φa=1.32+0.114V=1.434V。
比较可得到φc(酸)>φc(碱)>φc(中), φ a(酸)>φa(中)>φa(碱)
(3) 计算玻碳电极在三种溶液中的电位窗。
电位窗=φ a-φc
玻碳电极在0.2M H2SO4溶液中的电位窗φ(酸)=2.434-(-1.106)V=3.540V,
玻碳电极在0.2M K2SO4溶液中的电位窗φ(中)=2.074- (-1.586) V=3.660V,
玻碳电极在0.2M NaOH溶液中的电位窗φ (碱) =1.434-(-1.436)V=2.870V.
第二篇:电化学基础实验报告 4.28
华 南 师 范 大 学 实 验 报 告
学 号 20130010011 专 业 课程名称实验项目线性极化法测量金属Zn腐蚀的极化电阻
√综合 实验时间月日 实验类型 □验证 □设计 □
实验指导老师 吕 东 生 实验评分
一、实验目的
1. 了解极化电阻Rp的含义;
2. 掌握线性极化法测量金属腐蚀的极化电阻。
二、实验原理
金属Zn是中性锌锰电池、碱性锌锰电池和锌-空气电池等的负极材料,由于金属Zn具有较负的电极电位,当它与电解质溶液接触时,将会发生电化学腐蚀。在酸性或中性溶液中,金属Zn的电化学腐蚀反应为:
Zn?2e?Zn2?
2H?2e?H2?
而在碱性溶液中,金属Zn的电化学腐蚀反应为:
Zn?2OH??2e?Zn(OH)2
2H2O?2e?H2?2OH?
在金属Zn上进行电化学腐蚀的过程中,如果外电路无电流流过时,金属Zn的阳极溶解速率与其表面析氢速率相等,该速率就是Zn的腐蚀速率,用电流密度i腐,此时金属Zn的电位即是腐蚀电位φ腐。在实际应用中,不容易测得比较准确的i
通常根据极化电阻Rp的测量值来判断腐蚀体系的腐蚀速率的大小。腐蚀金腐值,
属电极的极化曲线在腐蚀电位φ腐处切线的斜率称为该腐蚀金属电极的 “极化电阻”。本实验采用线性极化法来测定Rp的值。
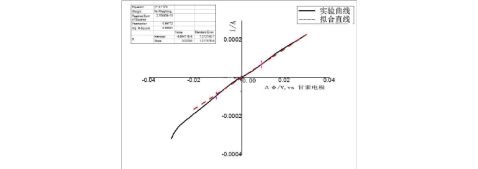
图1. 某腐蚀电极在1M H2SO4溶液中线性电位
扫描曲线(虚线为线性拟合线),扫速0.3mV/s.
线性极化的含义即是指在腐蚀电位附近,当Δφ≤10mV时,极化电流i与极化电位Δφ之间存在着线性规律。通过线性部分的拟合可以求得:
Rp??? i
也即是说极化电阻Rp为该直线的斜率的倒数,其单位是Ω?cm2。Δφ的单位是V,
2而i的单位是A/cm。Rp的值可以用来衡量腐蚀速率的大小,它的值越大,表明
腐蚀电流i腐值越小,即是腐蚀速率越小。
三、实验器材
CHI电化学工作站;甘汞电极;Hg/HgO电极;铂电极;金属Zn电极;0.2M ZnCl2溶液;0.2M KOH溶液;1200目细砂纸;高压氮气;电解池
四、实验步骤
1.打开CHI电化学工作站及测试用的电脑,预处理电极。其中,金属Zn电极要用1200目细砂纸打磨至金属面光亮。
2. 将铂电极和甘汞电极放入电解池中,向溶液中通入N2气约5min,除去其中的
氧气;
3.放入金属Zn电极,待开路电位稳定后,记录其值;
4. 选择“线性扫描伏安”功能,从φ开路-30mV的电位开始扫描,终止电位是φ开路+30mV,扫描速率是0.3mV/s。
5. 更换电解液,预处理电极,测量金属Zn的线性极化曲线。
五、数据处理与分析
1. 将测得的金属Zn电极在0.2M ZnCl2溶液和0.2M KOH溶液中的开路电位转换
成氢标电极后进行比较。
经查表得:饱和甘汞电极电位为0.244V,Hg/HgO电极电位为0.114V。而金属Zn电极在0.2M ZnCl2溶液中的开路电位为-1.114V,在0.2M KOH溶液中的开路电
位为-1.287V。
则:
金属Zn电极在0.2M ZnCl2溶液中的开路电位转换成氢标电极后为
E=0.244V-1.114V=-0.87V;
金属Zn电极在0.2M KOH溶液中的开路电位转换成氢标电极后为E=0.114V--1.287V=-1.173V.
因此,可看出:金属Zn电极在0.2M ZnCl2溶液中的开路电位比在0.2M KOH溶
液中的开路电位要小。
2. 在两张图中分别作出金属Zn电极在两种溶液中的线性极化曲线,并进行线性拟合,求出极化电阻Rp的值。说明金属Zn在哪一个溶液中更容易发生腐蚀。
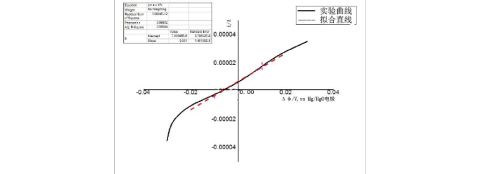
图2. 金属Zn电极在0.2M ZnCl2溶液中线性电位
扫描曲线(虚线为线性拟合线),扫速0.3mV/s.
图3. 金属Zn电极在0.2M KOH溶液中线性电位 扫描曲线(虚线为线性拟合线),扫速0.3mV/s.
由图及相关数据得:
1 当溶液为0.2M ZnCl2时,?=0.00785, 则??=127.389Ω?cm2;
当溶液为0.2M KOH时,?,则??=1000Ω?cm2. 由此可知,金属Zn在0.2M ZnCl2溶液中更容易发生腐蚀。
? 1?
