实验1 标准溶液的配置以及混合碱度的测定
一、实验目的:
1.掌握滴定管、移液管、容量管的准确使用,练习滴定操作。
2.学习酸碱溶液浓度的标定方法
3.了解双指示剂法测定碱液中NaOH和Na2CO3含量的原理。
4.了解混合指示剂的使用及其优点。
二、实验原理:
标定酸溶液和碱溶液所用的基准物质有多种,本实验中各介绍一种常用的。
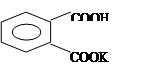 用酸性基准物邻苯二甲酸氢钾(KHC8H4O4)以酚酞为指示剂标定NaOH标准溶液的浓度。邻苯二甲酸氢钾的结构式为
用酸性基准物邻苯二甲酸氢钾(KHC8H4O4)以酚酞为指示剂标定NaOH标准溶液的浓度。邻苯二甲酸氢钾的结构式为
其中只有一个可电离的H+离子。标定时的反应式为:
KHC8H4O4 + NaOH = KNaC8H4O4 + H2O
邻苯二甲酸氢钾用作为基准物的优点是:①易于获得纯品;
②易于干燥,不吸湿;
③摩尔质量大,可相对降低称量误差。
用无水Na2CO3为基准物标定HCl标准溶液的浓度。由于Na2CO3易吸收空气中的水分,因此采用市售基准试剂级的Na2CO3时应预先于180℃下使之充分干燥,并保存于干燥器中,标定时常以甲基橙为指示剂。
NaOH标准溶液与HCl标准溶液的浓度,一般只需标定其中的一种,另一种则通过NaOH溶液与HCl溶液滴定的体积比算出。标定NaOH溶液还是标定HC1,要视采用何种标准溶液测定何种试样而定。原则上,应标定测定时所用的标准溶液,标定时的条件与测定时的条件(例如指示剂和被测成分等)应尽可能一致。
碱液中NaOH和Na2CO3的含量,可以在同一份试液中用两种不同的指示剂来测定,这种测定方法即所谓“双指示剂法”。此法方便、快速,在生产中应用普遍。
常用的两种指示剂是酚酞和甲基橙。在试液中先加酚酞,用HCl标准溶液滴定至红色刚刚退去。由于酚酞的变色范围在pH = 8~10,此时不仅NaOH完全被中和,Na2CO3也被滴定成NaHCO3,记下此时HCl标准溶液的耗用量V1。再加入甲基橙指示剂,溶液呈黄色,滴定至终点时呈橙色,此时NaHCO3被滴定成H2CO3,HCl标准溶液的耗用量为V2(注意HCl溶液的总的耗用量为V1+V2)。
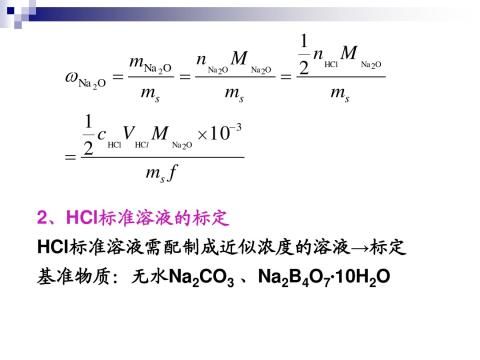
根据V1、V2可以计算出试液中NaOH及Na2CO3的含量x,计算式如下:
XNaOH = 
XNa2CO3 = 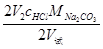
式中,c—浓度,单位为 mol/L
x—NaOH或Na2CO3的含量,单位为 g/L
M—物质的摩尔质量,单位为 g/mol:
V—溶液的体积,单位为 mL。
双指示剂中的酚酞指示剂可用甲基红和百里酚蓝混合指示剂代替。甲基红的变色范围为6.7(黄)~8.4(红),百里酚蓝的变色范围为8.0(黄)~9.6(蓝),混合后的变色点是8.3,酸色呈黄色,碱色呈紫色,在PH = 8.2时为樱桃色,变色较敏锐。
三、实验试剂
HCl溶液;固体碳酸钠;甲基橙指示剂; 酚酞指示剂;混合碱样。
四、实验步骤
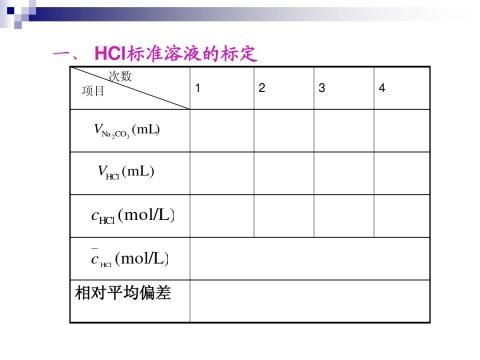
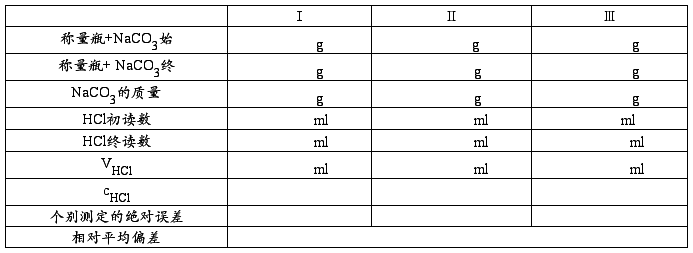
1.HCl溶液的配置及标定:
粗配0.5 mol/L HCl溶液500 mL于试剂瓶中。准确称取已烘干的无水碳酸钠三份(其重量按消耗20~40mL0.5mol/L HCl溶液计,请自己计算),置于3只250mL锥形瓶中,加水约30 mL,温热,摇动使之溶解,以甲基橙为指示剂,以0.5mol/L HCl标准溶液滴定至溶液由黄色转变为橙色。记下HCl标准溶液的耗用量,并计算出HCl标准溶液的浓度cHCl
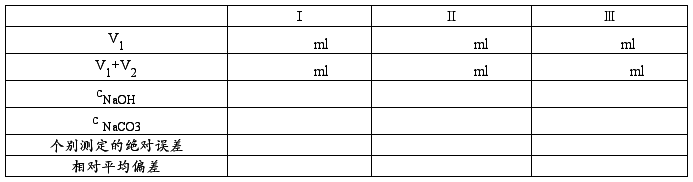
2.混合碱液的测定
用移液管吸取碱液试样10.00mL,加酚酞指示剂1~2滴,用已标定的HCl标准溶液滴定,边滴加边充分摇动,以免局部Na2CO3直接被滴至H2CO3。滴定至酚酞恰好褪色为止,此时即为终点,记下所用标准溶液的体积V1。然后再加2滴甲基橙指示剂,此时溶液呈黄色,继续以HCl溶液滴定至溶液呈橙色,此时即为终点,记下所用HCl溶液的体积V2。
五、记录和计算
1. HCl溶液的标定。
公式: cHCl=
2.混合碱液的测定。
思考题
1.溶解基准物Na2CO3所用水的体积的量度,是否需要准确?为什么?
2.用于标定的锥形瓶,其内壁是否要预先干燥?为什么?
3.用Na2CO3为基准物质标定0.5mol/L HCl溶液时,基准物称取量如何计算?
4.用Na2CO3为基准物质标定HCl溶液时,为什么不用酚酞作指示剂?
5.碱液中的NaOH及Na2CO3含量是怎样测定的?
6.如欲测定碱液的总碱度,应采用何种指示剂?试拟出测定步骤及以Na2Og/L表示的总碱度的计算公式。
7.试液的总碱度,是否宜于以百分含量表示?
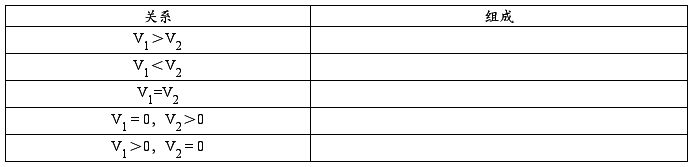
8.有一碱液,可能为NaOH或NaHCO3或Na2CO3或其混合液。用标准酸溶液滴定至酚酞终点时,耗去酸V1mL,继以甲基橙为指示剂滴定至终点时又耗去酸V2mL。根据V1与V2的关系判断该碱液的组成。
9.有一磷酸盐试液,用标准酸溶液滴定至酚酞终点,耗用酸溶液的体积为V1,继以甲基橙为指示剂滴定至终点时又耗去酸溶液的体积为V2。根据V1与V2关系判断试液组成。

10.某固体试样,可能含有Na2HPO4和NaH2PO4及惰性杂质.试拟定分析方案,测定其中Na2HPO4和NaH2PO4的含量。
注意考虑以下问题:
(1) 方法原理;
(2) 用什么标准溶液;
(3) 用什么指示剂;
(4) 测定结果的计算公式。
11.现有某含有HCl和CH3COOH的试液,欲测定其中HCl和CH3COOH的含量,试拟定一分析方案。
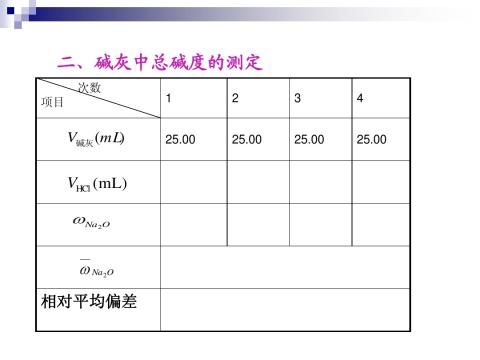
第二篇:实验七 碱灰中总碱度的测定