实验二 酸碱标准溶液的配制与标定
一、实验目的:
1.掌握间接法配制HCl、NaOH标准溶液的方法。
2. 熟练掌握差减称量法称取基准物的方法及滴定操作基本技能。
3.学习酸碱标准溶液的标定方法。
二、实验原理:
在酸碱滴定法中,常用到盐酸或氢氧化钠标准溶液,它们都不宜直接配制,因为浓盐酸易挥发,浓度和纯度不一,固体氢氧化钠中常因吸收空气中的二氧化碳和水蒸气,而含有碳酸钠和水分,因此,只能先将它们配制成近似浓度的溶液。然后通过标定来确定它们的准确浓度。
1.标定盐酸的基准物质:硼砂Na2B4O7·10H2O和无水碳酸钠Na2CO3。
(1)硼砂(四硼酸钠,Na2B4O7·10H2O):易制得纯品,不易吸水,性质比较稳定,而且摩
尔质量较大(381.37g/mol),称量误差小,是标定HCl溶液常用的基准物质,但硼砂易风化失水,需保存在相对湿度为60%密闭容器中。1︰2反应,其标定反应为:
Na2B4O7·10H2O + 2HCI = 2NaCI + 4H3BO3 + 5H2O
在化学计量点时,由于生成的硼酸是弱酸,溶液pH=5.1,可用甲基橙作指示剂。
(2)无水碳酸钠(Na2CO3):容易制得纯品,摩尔质量为105.99g/mol,但易吸湿,使用前应在3000C干燥1小时,保存在干燥器中,用时称量要快,以免吸水而引入误差。1︰2反应,其标定反应为:
Na2CO3 + 2HCI = 2NaCI + CO2+ H2O
计量点时,溶液pH =3.9,可用甲基红作指示剂。
本实验采用的方法是:称取硼砂后直接用盐酸滴定的方法进行操作,根据所称硼砂的质量和滴定所用盐酸溶液的体积,求出盐酸溶液的准确浓度。
2.标定氢氧化钠的基准物质:邻苯二甲酸氢钾和草酸。
(1)邻苯二甲酸氢钾(KHC8H4O4): 易制得纯品,在空气中不吸水,易保存,且摩尔质量较大(204.23g/mol),称量误差小,是标定NaOH溶液较为理想的基准物质。1︰1反应,其标定反应为:
KHC8H4O4 + NaOH = KNaC8H4O4 + H2O
到达化学计量点时,溶液pH =9.2,呈弱碱性,可用酚酞做指示剂。
(2)草酸(H2C2O4·2H2O):稳定,不会风化而失去结晶水,但草酸摩尔质量较小(126.07g/mol),又按1︰2与NaOH反应,若称取单份来标定,误差较大,需多称几倍量的草酸,配在容量瓶中,然后再移取部分溶液来标定。其标定反应为:
H2C2O4 + 2NaOH = Na2C2O4 +2H2O
计量点时,溶液pH =8.4,可用酚酞做指示剂。
本实验采用的方法是:先称取一定量的基准物邻苯二甲酸氢钾,准确配成100mL溶液,再移取20mL此溶液,用待标定的氢氧化钠溶液滴定。
三、实验仪器与试剂:
1.仪器:台平,分析天平,称量瓶,酸式滴定管,碱式滴定管,250mL锥形瓶6个,量筒(10mL,100mL),100mL容量瓶1个,烧杯(250mL2个,100mL1个),2mL吸量管1
个、20mL移液管1个,吸耳球,吸水纸,玻璃棒。
2.试剂:固体NaOH、浓HCl(ρ=1.19g·mL-1),硼砂(分析纯),邻苯二甲酸氢钾(分析纯),甲基橙指示剂,酚酞指示剂。
四、实验内容及步骤:
1.酸碱标准溶液的配制
⑴配制200mL0.1 mol·L-1HCl溶液
在烧杯中先加入50mL蒸馏水(一般先在烧杯中加入少量水,再加浓HCl可减少酸雾),然后用量筒或吸量管移取1.8mL浓HCl注入烧杯中,用蒸馏水稀释至200mL,摇匀,贴上标签备用。
⑵配制200mL0.1mol·L-1NaOH溶液
台平上迅速称取0.8克固体NaOH于烧杯中,加50mL新煮沸的不含CO2的蒸馏水,完全溶解后,用不含CO2的蒸馏水稀释至200mL,摇匀,贴上标签备用。
2.酸碱标准溶液的标定
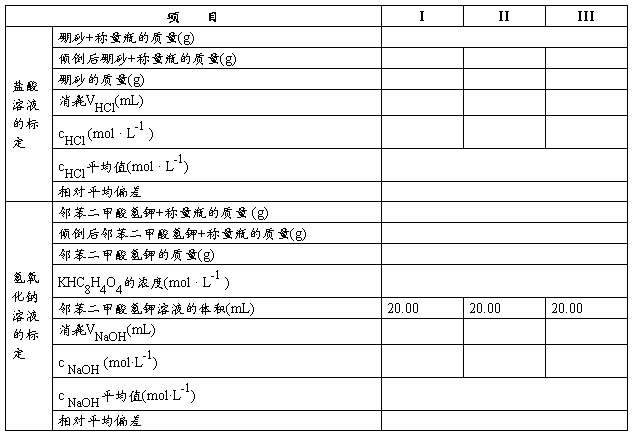
⑴盐酸溶液的标定 用差减法准确称取硼砂基准物质三份,每份为0.38~0.42g(准确到0.1mg),分别置于250mL锥形瓶中,标上标号,加30mL蒸馏水,慢慢摇动使其溶解。加入2~3滴甲基橙指示剂,用盐酸溶液滴定至由黄色变为橙色,半分钟不消失即为终点,记录每次滴定时所消耗盐酸溶液的体积,根据所消耗盐酸溶液的体积及硼砂的质量,计算盐酸溶液的准确浓度,取结果的平均值作为盐酸溶液的准确度。要求相对平均偏差不大于0.2%。
⑵氢氧化钠溶液的标定 用差减法准确称取邻苯二甲酸氢钾2.10~2.20g(准确到0.1mg)一份,放入小烧杯中,加入30mL蒸馏水,溶解,完全转移至100mL容量瓶中,定容,摇匀。然后用移液管准确吸取20.00mL邻苯二甲酸氢钾溶液三份,分别放入250mL锥形瓶中,标上标号,加入2~3滴酚酞指示剂,用NaOH溶液滴定至酚酞恰好由无色变为粉红色,半分钟不褪色即为终点。记录每次滴定时所消耗氢氧化钠溶液的体积,计算氢氧化钠溶液的准确浓度。两次滴定的体积相差不大于0.02mL。
五、数据纪录与处理
1.盐酸溶液的浓度:

2.氢氧化钠溶液的浓度:

第二篇:王元杭:酸碱标准溶液的配制和标定实验





