实验:K2Cr2O7电位滴定法测亚铁
一、目的要求
1、学会用K2Cr2O7电位滴定法测亚铁的原理及技术;
2、进一步熟练掌握离子计的使用;
3、掌握二阶微商法计算滴定终点的方法。
二、实验原理
用K2Cr2O7溶液滴定Fe2+的反应为:
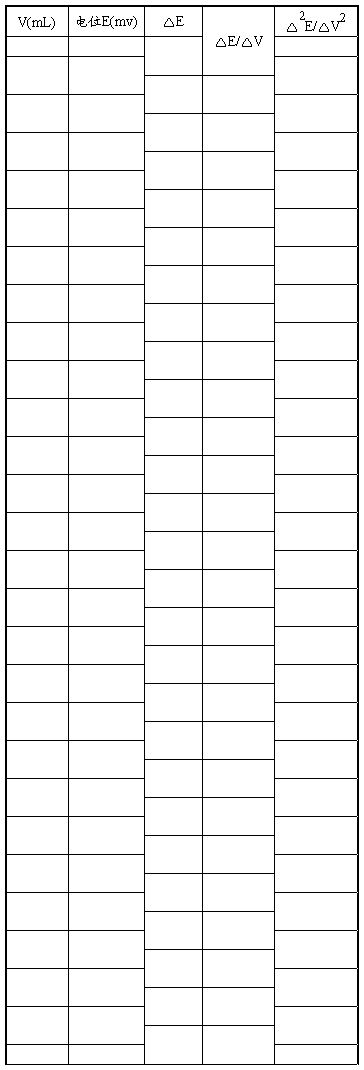
Cr2O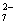 + 6Fe2++14H+=2Cr3++ 6Fe3++7H2O
+ 6Fe2++14H+=2Cr3++ 6Fe3++7H2O
用铂电极作指示电极,饱和甘汞电极作参比电极组成原电池。在滴定过程中,由于滴定剂(Cr2O2-7)的加入,待测离子氧化态(Fe3+)和还原态(Fe2+)的活度(或浓度)比值发生变化,铂电极的电位亦发生变化,在等量点附近产生电位突跃,用二阶微商法确定终点。
三、试剂与仪器
1、c(K2Cr2O7)= 0.0168mol/L的K2Cr2O7标准溶液
2、H2SO4—H3PO4混酸:150mL 浓H2SO4加放700mL水中,充分搅拌,冷却后再加150mL H3PO4,混匀即可。
3、硫酸亚铁铵待测溶液
4、酸度计(或离子计、电极电位仪)
5、电磁搅拌器
6、铂电极
7、饱和甘汞电极
8、50mL酸式滴定管
9、25mL移液管
四、实验步骤
1、准确移取15.00mL 硫酸亚铁铵待测溶液于250mL烧杯中,加入H2SO4—H3PO4混酸15mL ,并用蒸馏水稀释至约100mL。
2、用预处理了的铂电极与饱和甘汞电极及待测液构成电池,同时开始搅拌,以离子计测定其电动热并记录。预滴定一次,确定大致的终点体积。
3、再另取同样两份试样,进行正式滴定。加入适量体积K2Cr2O7标准溶液(0.0168mol/L),测电动势、记录;再加K2Cr2O7标准溶液,测电动势、记录。如此连续操作。
4、当电动势变化较大时,改为每加0.1mL K2Cr2O7标准溶液读一次电位值。
5、用二阶微分计算法求出Ve.p,计算待测液中Fe的浓度(g/ L)。
五、实验数据记录及处理
标准溶液名称及浓度 取样体积
仪器型号 参比电极 指示电极
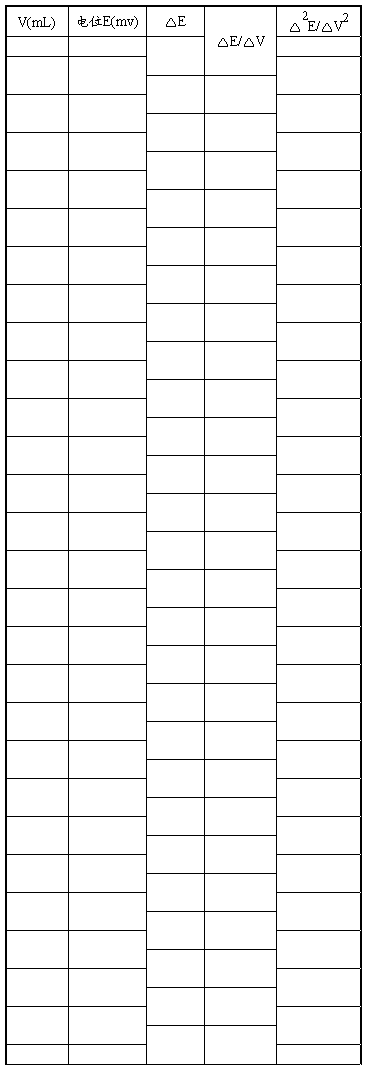
终点体积计算(mL): 1、 2、
结果计算公式:
结果计算(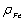 g/L): 1、 2、
g/L): 1、 2、
结果计算平均值: ;相对平均偏差:
第二篇:实验2 电位滴定法测定弱酸离解常数
实验2 电位滴定法测定弱酸离解常数
一:实验目的
(1)掌握电位滴定法测定一元弱酸解离常数;
(2)掌握确定电离滴定终点的方法;
(3)学会使用自动电位滴定剂。
二:实验原理
用电位滴定法测量弱酸离解常数Ka,组成的测量电池为
pH玻璃电极︳H+(c=x)‖KCl(s),Hg2Cl2,Hg
溶液pH pHx= pHs+(E电池x-E电池s)/0.0592
作图法,以pH值为纵坐标,以加入滴定剂体积V为横坐标,绘制pH-V电位滴定曲线,曲线斜率最大处所对应的滴定剂体积为终点体积。
一阶微商曲线,曲线的极大值所对应的滴定剂体积为终点体积。
由滴定剂(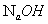 )的终点体积可计算出被滴物的原始浓度并计算出终点时滴定产物的浓度
)的终点体积可计算出被滴物的原始浓度并计算出终点时滴定产物的浓度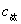 。
。
弱酸的离解常数K,由下式计算:
[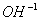 ]=
]=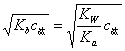
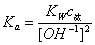
三:仪器与试剂
仪器:自动电位滴定计;PH玻璃电极,饱和甘汞电极(复合电极)。 试剂:0.1000mol/LNaOH标准溶液;醋酸;pH=7的标准缓冲溶液
四:实验步骤
1.弱酸的电位滴定
(1)小心摘去pH复合电极的塑料外套,将其固定在电极架上,将 导线与仪器连接安装好。
(2)打开仪器和搅拌器的电源,按要求调试好仪器,将测量选择开关置于pH档。
(3)用pH=7的标准缓冲溶液校准pH计。
(4)准确已取50.00mL 0.1mol/L 醋酸至一干净的100mL烧杯中。将烧杯置于滴定装置的搅拌器上,放入搅拌磁子,下移电极架,使pH复合电极插入试液。
2.测量:用自动电位滴定计进行自动滴定,绘制PH-V,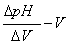 曲线图并导出。
曲线图并导出。
五:结果处理
1.绘制pH-V、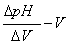 曲线图,并从图上找出终点体积。
曲线图,并从图上找出终点体积。
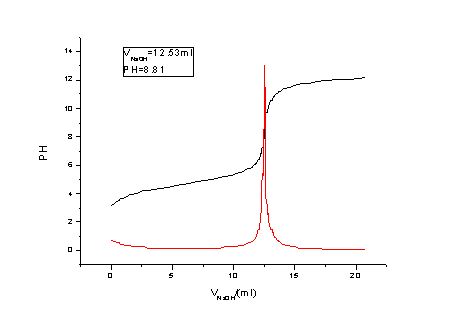
V=12.53mL PH=8.81
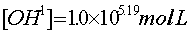
2.由终点体积计算一元弱酸的原始浓度:
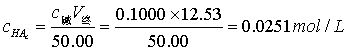
3.计算终点时弱酸盐浓度:
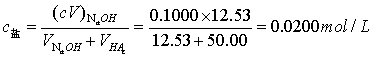
4.计算弱酸离解常数 :
:
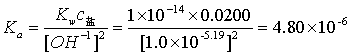
六.思考题
1.测定未知溶液pH值时,为什么要用pH标准缓冲液进行校正?
答:用PH标定时为了消除不对称电位的影响,PH电极工作时主要靠玻璃膜与水形成一层水化膜,如果没有这层膜,PH计不能正常工作。
2.测定的弱酸 与文献值比较有何差异,如有,说明原因?
与文献值比较有何差异,如有,说明原因?
答:测得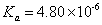 与文献值
与文献值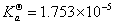 略偏小,可能是测定的pH偏大一点儿。
略偏小,可能是测定的pH偏大一点儿。
