选择电极直接电位法测定牙膏中的氟离子含量
111111
(1111111院,广州,519072)
摘要: 本文采用氟离子选择性电极直接电位分析法测定了牙膏样品中的氟元素含量。使用TISAB(总离子强度调节缓冲溶液)稳定溶液的总离子强度及pH,测定了一系列含氟离子溶液的标准曲线,在0.01-0.00001 mol/L的范围内线性相关系数为1.0000。结果表明本牙膏样品中的氟含量为0.595 mg/g,符合国家标准规定的含氟牙膏中氟含量范围。
关键词: 氟离子 牙膏 选择电极 直接电位法
1 前言
氟为人体必需元素,若饮用水中氟含量过高,会引起牙釉和骨软症,而适量氟对预防龋齿有利。龋病是一种危害人类牙齿最常见的多发病,尤其以儿童更为普遍。如何能及早预防儿童龋病的发生,是当今口腔医学上一重大课题。目前最简便有效的方法是使用含氟化钠的牙膏刷牙,其目的是使氟离子与牙齿表面钙盐结合形成抗酸蚀能力较强的氟磷灰石保护层,以增强牙齿的抗酸蚀能力,达到预防龋齿的目的。又由于氟化钠有毒,须严格控制其用量,因此测定牙膏中氟的含量具有重要的实际意义[1]。
目前氟化物的测定方法主要有[2-3]:分光光度法、离子色谱法、滴定法、扫描极谱法、原子发射光谱法、荧光法、气相色谱法等。其中比色法方法简单,但灵敏度低;分光光度法测定时要将样品中F-转化为吸光物质,受条件影响因素较多;离子色谱法作为一种新技术, 发展很快, 但此法大多用于测定阴离子且仪器昂贵;滴定法涉及样品预处理操作,手续繁杂,特别对微量元素的测定准确度和精密度不高;气相色谱法需对分析物进行衍生。
本实验采用氟离子选择性电极法,直接溶样测定牙膏中游离氟,该法与其他方法相比,操作更简单,方便快速,灵敏度高准确,选择性好,仪器简单,成本低,是一种实用的测定氟离子方法。
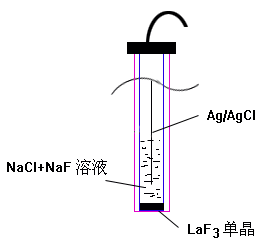
自从氟离子选择电极问世以来,用该电极直接电位法测定各种水样中的氟便是一种普遍、方便和准确的方法。氟离子选择电极简称为氟电极,其敏感膜是LaF3单晶(结构简图见图1)。 以氟电极为指示电极,Ag-AgCl参比电极电极为参比电极,插入试液中,组成一个测量电池:
氟离子选择电极│F-试液│参比电极
当试液的离子强度为定值时,电池的电动势E与F-试液的浓度CF-有确定的关系:
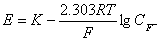 (1)
(1)
E与CF-成线性关系,因此可以用直接电位法测定F-的浓度。
当氟电极插入到F-溶液中时,F-在晶体膜表面进行交换,25℃时有
E = K - 0.059 lgaF- = K + 0.059 pF- (2)
离子选择性电极测量的是溶液中的离子活度,通常定量分析需要测量的是离子的浓度,不是活度,所以必须控制试液的离子强度,才可以近似认为测量的是离子浓度。本实验用标准工作曲线法测定水中氟离子的含量,测量的pH值范围为5.0-6.0,加入含有氯化钠、乙酸及柠檬酸钠的总离子强度调节缓冲剂(TISAB)以控制酸度、保持一定的离子强度和消除干扰离子对测定的影响。

2 实验部分
2.1 试剂与仪器
510型 pH计/离子计;电磁搅拌器;氟离子选择性电极;Ag/AgCl 标准电极;超声波清洗器。
F-标准溶液(0.1000 mol/L,实验室提供):准确称取4.198 g在 120℃干燥过后的氟化钠(A.R),以水溶解转入 1000mL 容量瓶中用水稀释至刻度,混匀转移至塑料瓶中储备;
TISAB(总离子强度调节缓冲溶液pH 5.0~5.5,实验室提供):在500 mL 水中,加入57 mL冰醋酸(A.R),58.5 g的氯化钠和0.3 g的柠檬酸钠(A.R),用水稀释至1 L。

2.2 标准曲线的制作
在50 mL的容量瓶中,准确加入5.00 mL0.1000 mol/L的氟标准溶液和25 mL TISAB,纯水定容后为1.000×10-2 mol/L的氟标准溶液。在1.000×10-2mol/L标准溶液的基础上逐级稀释成1.000×10-3、1.000×10-4、1.000×10-5mol/L 氟标准溶液 (此三者均加入22.5mL TISAB溶液)。配制含25 mL TISAB的空白溶液50 mL。设置好电位仪的参数,把电极插入去离子水中在搅拌的条件下洗涤至电位计读数稳定且换水后波动不超过5 mV时可以进行测量。按氟离子浓度由低到高的顺序测量,记下稳定的读数。测量完毕后将电极用蒸馏水清洗直至测得电位值与第一次清洗时的电位值相近。
2.3 牙膏中氟含量的测定
准确称取1.0400 g的牙膏样品于小烧杯中,用25ml TISAB溶液将牙膏样品稀释后转移至50ml容量瓶中,纯水定容,超声震荡5 min。在相同条件下测定,记录稳定的电位读数。
3 结果与讨论
3.1 数据与处理
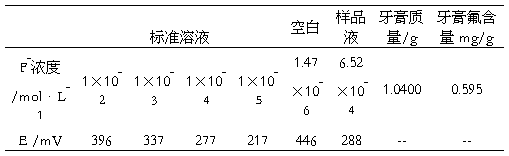
由实验测得的标准溶液测定电位值绘制出工作曲线(图1),得到E = -59.7* lgCF-+ 97.8,相关系数R² = 1.0000,可见线性较好。
根据实验测定,E样品=288 mV,代入工作曲线计算则有
lg(cF-)=(288-97.8)/(-59.7)=-3.186
则所没溶液中的氟离子浓度为
CF-=10-3.186=6.52×10-4 mol/L
又所取牙膏总质量m为1.0400 g,定容体积V至50 mL,则牙膏中氟离子含量m(F-)有
m(F-)= CF-×M(F)×V/m=6.52×10-4×18.9984×50/1.0400=0.595 mg/g
结果表明本牙膏样品中的氟含量符合国家标准规定的含氟牙膏中氟含量范围0.4-1.5 mg/g。

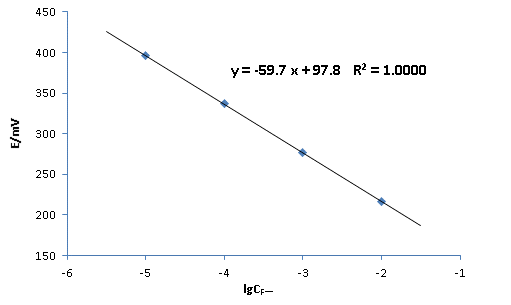
3.2 TISIB的作用与影响[4]
第一,固定溶液的离子强度。因离子选择性电极的膜电位是依赖于离子活度而不是浓度,只有当离子的活度系数保持不变时,膜电位才与浓度成线性关系,因此必须把离子强度较高的溶液加到标准溶液和未知溶液中,使溶液的离子强度固定,从而使离子的活度系数不变用浓度代替活度。
第二,防止氢离子和氢氧根离子对测定的干扰,缓冲pH使之保证一定范围。在pH < 5的酸性溶液中,氢离子和氟离子形成难离解的HF-和 HF2- 而氢氧根离子与氟离子在水中的有效离子半径相近,也有可能穿过半透膜,再者氟化镧在碱性溶液中能释放出氟离子,所以必须控制被测溶液的pH值。氟化物的含量越低适应pH范围越窄,一般情况控制在 5~6。
第三,消除铝、 铁离子的干扰。电极法测定的是游离的氟离子,而一些高价的阴离子如Al3+、 Fe3+和氢离子易与氟离子形成稳定的络和物从而有干扰。在TISAB中柠檬酸钠能与Al3+、 Fe3 +形成较强的络合物从而起到掩蔽作用,消除干扰。如图所示,TISAB对蒸馏水的平衡电位值影响不大因蒸馏水较纯净,含氟量极微,其它杂质也很少。TISAB 对地下含氟水电位影响最大,因地下水含较多的[OH-]、Al3+、Fe3 + 等,TISAB 消除了这些干扰。
第四,加快平衡的到达,缩短电极响应时间。根据“IUPAC” 的意见电极响应时间是指从离子选择性电极和参比电极接触样品溶液开始到电极电位达到稳定所经过的时间。影响电极响应时间的主要因素为:
[ a ]膜电极本身的结构、性质和光洁度;
[ b]待测溶液的浓度,通常浓度越低电极响应时间越长;
[ c ]搅拌(但不能过快以防气泡附着电极表面);
[ d]适当升高温度有利于平衡到达;
[ e ]加入掩蔽剂。
加入 TISAB后 ,其中柠檬酸钠对铝铁等形成较强的络合物使氟离子快速从铝铁络合物中解离出来,有利于缩短电极响应时间。
第五,TISAB 存放时间过长可造成误差。 TISAB不能存放时间过长(不超过一周) ,否则掩蔽能力下降引入误差。
3.3 离子选择电极原理与特点[5]
离子选择性电极是一类指示电极,它的电化学活性元件是“膜”,称为活性膜或敏感膜。离子选择性电极主要由两部分组成: ( 1)敏感膜。这是离子选择性电极最重要的组成部分, 它决定电极的性质,不同的离子选择电极具有不同的敏感膜,其作用是将溶液中特定离子活度转变成电位信号——膜电位;( 2)内导系统。一般包括内参比溶液和内参比电极,其作用在于将膜电位引出。
与其它分析方法相比,离子选择性电极具有许多独特的优点:是一种直接的、非破坏性的分析方法,用少量样品即可实现测量;所需设备简单、操作方便,不需要很多的设备费用及维护费用;分析速度快,典型的单次分析只需要1~ 2分钟,可以反复测量;电极输出为电信号,不需要经过转换就可以直接放大及测量记录,容易实现自动、连续测量及控制;测量的范围广, 灵敏度高,电极的响应为对数特性,因此在整个测量范围具有同样的准确程度;离子电极电位所响应的是溶液中给定离子的活度,而不是一般分析中离子的浓度,这在某些场合下具有重要的应用。
尽管电极分析方法具有一系列优点,但在实际应用中受到不少限制,应用中普遍存在的问题有:选择性问题——理想的ISE应只对一种特定的离子具有能斯特响应,但实际上电极对被测溶液中其他共存离子也有响应;离子强度——ISE最终结果是测得待测离子的活度,要保持测定中各试液(标准液与待测液 )之间离子强度的一致;溶液pH值——每种离子选择性电极都有一定的适用pH范围,超出该范围,就会偏离线性关系;干扰—— ISE法测定的干扰因素众多,一是溶液中的共存离子影响反应液的离子强度从而影响了被测离子的离子活度。二是共存离子与待测离子形成络合物或发生氧化还原反应,导致待测离子数量的减少。因此,离子选择性电极只适用于对误差要求不高的快速分析。当精密度要求需大于 %时一般不宜用此法。电极的选择性也是使其应用受到局限的一个因素,目前电极品种仍限于一些低价离子, 主要是阴离子,随离子价数增加,分析误差更为增大,电极电位值的重现性受实验条件变化影响较大,标准曲线不及光度法测定的曲线稳定。
%时一般不宜用此法。电极的选择性也是使其应用受到局限的一个因素,目前电极品种仍限于一些低价离子, 主要是阴离子,随离子价数增加,分析误差更为增大,电极电位值的重现性受实验条件变化影响较大,标准曲线不及光度法测定的曲线稳定。
3.4 空白电位值对测定的影响
氟离子选择电极的空白电位值是体现电极质量的主要参数,同一厂家、型号的电极,其值愈大愈好。空白电位值因生产厂家的不同而要求不一,在使用中应严格按厂家要求进行洗涤至某一电位值,如340 mV 或 230 mV 以上。一般情况下,氟离子选择电极洗到接近最大空白电位值时,其工作性能最好。此时,氟离子选择电极的线性范围最大,测试的稳定性最好。最大空白值与氟离子选择电极生产厂家、使用、保养和维护等诸多因素有关,要求氟离子选择电极的最大空白值一致是不可能的。另外,测定标准溶液和样品溶液前,控制空白电位值相同,以提高测试的精密度和准确度。
3.4 直接电位法与电位滴定法的比较
直接电位法:利用专用的指示电极―离子选择性电极,选择性地把待测离子的活度(或浓度)转化为电极电位加以测量,根据Nernst方程式,求出待测离子的活度(或浓度),也称为离子选择电极法。应用范围广,可用于许多阴离子、阳离子、有机物离子的测定,尤其是一些其他方法较难测定的碱金属、碱土金属离子、一价阴离子及气体的测定。因为测定的是离子的活度,所以可以用于化学平衡、动力学、电化学理论的研究及热力学常数的测定。测定速度快,测定的离子浓度范围宽。可以制作成传感器,用于工业生产流程或环境监测的自动检测;可以微型化,做成微电极,用于微区、血液、活体、细胞等对象的分析。
电位滴定法:利用指示电极在滴定过程中电位的变化及化学计量点附近电位的突跃来确定滴定终点的滴定分析方法。准确度比指示剂滴定法高,更适合于较稀浓度的溶液的滴定。可用于指示剂法难进行的滴定,如极弱酸、碱的滴定,络合物稳定常数较小的滴定,混浊、有色溶液的滴定等。可较好地应用于非水滴定。
4 结论
本文采用氟离子选择性电极直接电位分析法测定了牙膏样品中的氟元素含量。使用pH/mV计测定电位,利用TISAB(总离子强度调节缓冲溶液)稳定溶液的总离子强度及pH,测定了一系列含氟离子溶液的标准曲线,结果表明本牙膏样品中的氟含量为0.595 mg/g,符合国家标准规定的含氟牙膏中氟含量范围。

参考文献
[1] 刘兴利,景小明,杨学军,马晨,张强. 离子选择电极直接电位法测定牙膏中游离氟. 西南民族大学学报. 2003,29(3):298-210.
[2] 马运明,马蔚. 氟化物分析方法进展. 环境与健康杂志. 2003,20(2):125-127.
[3] 周福林,宁少飞,张稳婵,裴翠锦,李华静. 宜春学院学报. 2007,29(6):81-83.
[4] 支胡钰,温书恒,汪侃. TISAB对测定水中微量氟的影响. 江西教育学院学报. 2003,24(6):19-20.
[5] 刘丹,王小洲. 离子选择性电极及其发展趋势. 四川文理学院学报. 2009,19(2):20-22.
第二篇:氟离子选择电极直接电位法测定牙膏中的氟实验报告
1 氟离子选择电极直接电位法测定牙膏中的氟实验报告
2.1 试剂与仪器
试剂
(1)F-标准溶液(0.1000mol/L):实验室提供;
(2)TISAB(总离子强度调节缓冲溶液):实验室提供,在500ml水中,加入57ml冰醋酸,58.5g的氯化钠和0.3g的柠檬酸钠,用水稀释至1L,pH值为5.0至5.5。
表一:TISAB的组成与离子强度
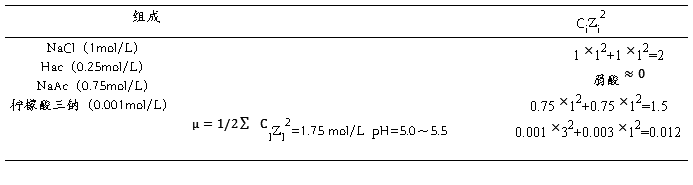
仪器
pH510型pH计/离子计;电磁搅拌器;氟离子选择性电极,Ag/AgCl电极,超声波清洗器。
2.2 1.000 10-2~1.000
10-2~1.000 -5 mol/L的氟的标准溶液系列的配置
-5 mol/L的氟的标准溶液系列的配置
取50ml的容量瓶,加入5mL0.1000mol/L氟标准液,加入25mlTISAC,用水稀释至刻度。照此法,配置1.000 10-2~1.000
10-2~1.000 -5的氟的标准溶液,浓度差为10倍。
-5的氟的标准溶液,浓度差为10倍。
2.3 标准氟工作曲线的制作
利用pH510型pH计/离子计,由稀至浓测量上述标准溶液系列的电位值。
以F-浓度的对数为横坐标,电位(mV)为纵坐标,绘制标准曲线。标准曲线如图一。
2.4 牙膏中氟含量的测定
准确称取1.1906g的牙膏样品于小烧杯中,用25mlTISAB稀释转移到50ml容量瓶。定容,超声波震荡几分钟。
取待测液用以上pH510型pH计/离子计测量此时溶液的电位值,记录于表一。
根据标准氟工作曲线以及样品的电位值求出牙膏中所含有的氟的浓度,并与国家标准进行比对。
3 结果与讨论
3.1 数据记录
表二:离子选择性电极直接测量牙膏中氟含量的结果记录表

表三:样品测定结果记录表

3.2 数据处理
根据所获得的实验数据,用Excel软件合成E(mV)-(-lgCF-)工作曲线,得到的工作曲线图和关系数据如图一所示:
图一:E(mV)-(-lgCF-)工作曲线
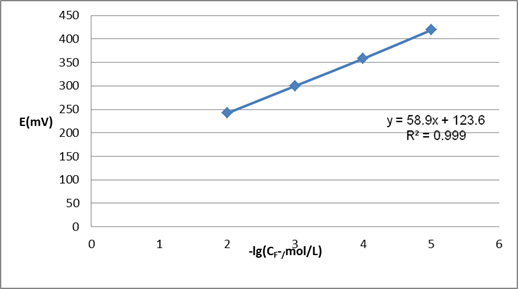
由工作曲线得知,线性回归方程E/mV=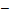 58.9
58.9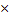 lg(CF-/mol/L)+123.6,故牙膏中的氟含量为:
lg(CF-/mol/L)+123.6,故牙膏中的氟含量为:
CF-=10^[(316-123.6)/(-58.9])=10^(-3.27)=5.37 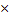 10-4mol/L;
10-4mol/L;
则1.1906g牙膏里的F-含量为:
m=5.37 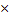 10-4
10-4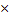 50
50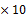 -3
-3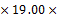 103=0.5101mg;
103=0.5101mg;
则牙膏里的F-含量为:
w=0.5101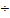 1.1906=0.4285 mg/g;
1.1906=0.4285 mg/g;
以质量分数百分含量表示:
w,=0.04%
3.4 实验讨论
3.41 1.000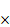 10-2~1.000
10-2~1.000 -5mol/L的氟的标准溶液的配置
-5mol/L的氟的标准溶液的配置
在配置溶液时,每种浓度的标准溶液加入了25ml TISAB试液,其目的是:
(1) 作为缓冲液保持pH值在5.0至5.5,消除了OH-的干扰,并且不易形成氟化氢缔合物;
(2) 其柠檬酸盐能络合Al3+、Fe3+等使原来被它们缔合的氟离子释放出来;
(3) 保持溶液的总离子强度基本固定不变;
(4) 加快平衡时间。
3.42 工作曲线法与标准加入法的优劣比较
工作曲线法具体方法是:用标准样品配制成不同浓度的标准系列,在与待测组分相同条件下,测量电位值,对样品浓度绘制标准曲线。
标准曲线法的优点是:绘制好标准工作曲线后测定工作就变得相当简单,可直接从标准工作曲线上读出含量,因此特别适合于大量样品的分析。
标准加入法,又名标准增量法,具体方法是:将一定量已知浓度的标准溶液加入待测样品中,测定加入前后样品的浓度。加入标准溶液后的浓度将比加入前的高,其增加的量应等于加入的标准溶液中所含的待测物质的量。如果样品中存在干扰物质,则浓度的增加值将小于或大于理论值。
工作曲线法适用于标准曲线的基体和样品的基体大致相同的情况,优点是速度快,缺点是当样品基体复杂时不正确。标准加入法可以有效克服上面所说的缺点,因为他是把样品和标准混在一起同时测定的(“标准加入法”的叫法就是从这里来的),但就是速度很慢。
工作曲线法可在样品很多的时候使用,先做出曲线,然后从曲线上找点,那样方便。
标准加入法,适合数量 少的时候用。
3.43 氟离子含量过高对人体的伤害
主要表现为氟骨症和氟斑牙。氟斑牙的表现为牙齿畸形、软化、牙釉质失去光泽、变黄;氟骨症的表现为骨骼变厚变软、骨质疏松、容易骨折。氟中毒晚期往往有慢性咳嗽、腰背及下肢疼痛、骨质硬化、肌腱、韧带钙化和关节囊肥厚、骨质增生、关节变形等。另外,机体代谢过程中所需要的某些酵素系统会被破坏,导致多器官病变。 因此,专家提醒使用含氟牙膏的量一定要小,一般每次不超过1克,牙膏占到牙刷头的五分之一到四分之一就可以了,无须挤满牙刷头。由于儿童使用牙刷还不熟练,有可能误食含氟牙膏,危害身体健康,因此专家建议儿童不要使用含氟牙膏。
3.44 实验测得的牙膏含量是0.04%,含量符合国家标准,实验过程中有可能是导致误差,是的牙膏中含氟量较低的步骤有:
(1):牙膏在处理过程中,没有完全溶解,导致氟离子没有完全转移至待测液中;
(2):配置系列标准溶液等实验操作引起的误差也可能导致结果偏小;
(3):部分氟元素并不是以氟离子形式存在的,由于此法只能测以氟离子形式存在的氟元素。
4 结论
本实验用氟离子选择电极直接电位法测定高露洁牙膏中氟的含量,以标准曲线法测得牙膏中氟的含量为0.04%的质量含量,符合国家标准《牙膏》GB8372-2008中的规定:“成人牙膏总氟量在0.05%-0.15%,含氟儿童牙膏中氟含量在0.05%-0.11%之间”,适合一般家庭使用。
实验操作检点,成本低廉,适合用于测定含氟量的测定。但是本实验并未探讨测量的准确度,重现性,选择性,有待继续研究。
