实验2 电位滴定法测定弱酸离解常数
一:实验目的
(1)掌握电位滴定法测定一元弱酸解离常数;
(2)掌握确定电离滴定终点的方法;
(3)学会使用自动电位滴定剂。
二:实验原理
用电位滴定法测量弱酸离解常数Ka,组成的测量电池为
pH玻璃电极︳H+(c=x)‖KCl(s),Hg2Cl2,Hg
溶液pH pHx= pHs+(E电池x-E电池s)/0.0592
作图法,以pH值为纵坐标,以加入滴定剂体积V为横坐标,绘制pH-V电位滴定曲线,曲线斜率最大处所对应的滴定剂体积为终点体积。
一阶微商曲线,曲线的极大值所对应的滴定剂体积为终点体积。
由滴定剂(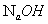 )的终点体积可计算出被滴物的原始浓度并计算出终点时滴定产物的浓度
)的终点体积可计算出被滴物的原始浓度并计算出终点时滴定产物的浓度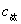 。
。
弱酸的离解常数K,由下式计算:
[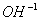 ]=
]=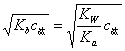
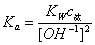
三:仪器与试剂
仪器:自动电位滴定计;PH玻璃电极,饱和甘汞电极(复合电极)。 试剂:0.1000mol/LNaOH标准溶液;醋酸;pH=7的标准缓冲溶液
四:实验步骤
1.弱酸的电位滴定
(1)小心摘去pH复合电极的塑料外套,将其固定在电极架上,将 导线与仪器连接安装好。
(2)打开仪器和搅拌器的电源,按要求调试好仪器,将测量选择开关置于pH档。
(3)用pH=7的标准缓冲溶液校准pH计。
(4)准确已取50.00mL 0.1mol/L 醋酸至一干净的100mL烧杯中。将烧杯置于滴定装置的搅拌器上,放入搅拌磁子,下移电极架,使pH复合电极插入试液。
2.测量:用自动电位滴定计进行自动滴定,绘制PH-V,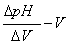 曲线图并导出。
曲线图并导出。
五:结果处理
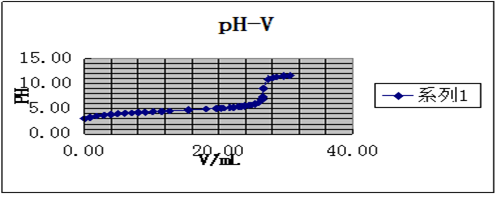
1.绘制pH-V、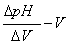 曲线图,并从图上找出终点体积。
曲线图,并从图上找出终点体积。
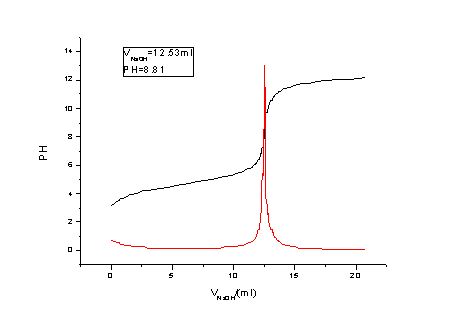
V=12.53mL PH=8.81
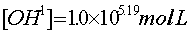
2.由终点体积计算一元弱酸的原始浓度:
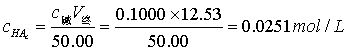
3.计算终点时弱酸盐浓度:
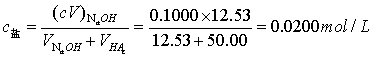
4.计算弱酸离解常数 :
:
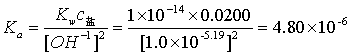
六.思考题
1.测定未知溶液pH值时,为什么要用pH标准缓冲液进行校正?
答:用PH标定时为了消除不对称电位的影响,PH电极工作时主要靠玻璃膜与水形成一层水化膜,如果没有这层膜,PH计不能正常工作。
2.测定的弱酸 与文献值比较有何差异,如有,说明原因?
与文献值比较有何差异,如有,说明原因?
答:测得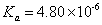 与文献值
与文献值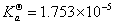 略偏小,可能是测定的pH偏大一点儿。
略偏小,可能是测定的pH偏大一点儿。
第二篇:实验2 电位滴定法测定弱酸离解常数
实验2 电位滴定法测定弱酸离解常数
姓名:陈俊森 班级:侯氏一班 学号:1106010102
一、实验目的
1、掌握电位分析法测定一元弱酸离解常数的方法。
2、掌握确定电位滴定终点的方法。
3、学会使用ZD-2型自动电位滴定计。
二、实验原理
作图法是以pH值为纵坐标,以加入滴定剂体积V为横坐标,绘制pH-V电位滴定曲线,曲线斜率最大处所对应的滴定剂体积为终点体积。
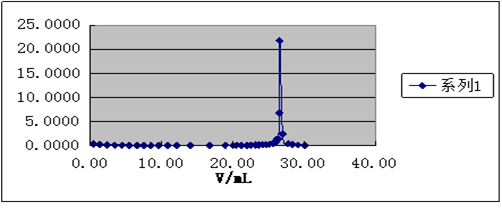
一阶微商曲线,曲线的极大值所对应的滴定剂体积为终点体积。
一阶微商对应值想减得儿阶微商值,作二阶微商曲线,二阶微商等于零时对应的滴定剂体积为滴定终点体积。
终点体积和终点pH可用以下公式计算:
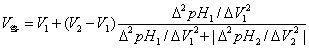

由滴定剂(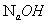 )的终点体积可计算出被滴物的原始浓度并计算出终点时滴定产物的浓度
)的终点体积可计算出被滴物的原始浓度并计算出终点时滴定产物的浓度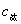 。
。
弱酸的离解常数K,由下式计算:
[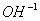 ]=
]=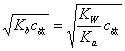
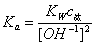
三、仪器与试剂
1、精密pH计、磁力搅拌机、pH复合电极。
2、邻苯二甲酸氢钾基准物。
3、一元弱酸,如醋酸等。
4、0.1000mol/L标准溶液。
5、pH=6.86的标准缓冲溶液。
四、实验步骤
1.0.1mol/L氢氧化钠标准溶液的配制与标定。
(1)在台秤上称取2g氢氧化钠固体于小烧杯中,用少量水溶解后倒入试剂瓶中,用水稀释至500mL待标定。
(2)在分析天平上准确称取KHP0.4~0.6g于250mL烧杯中,加35mL水溶解,用上述氢氧化钠溶液滴定。
2.弱酸的电位滴定
(1)小心摘去pH复合电极的塑料外套,将其固定在电极架上,将导线与仪器连接安装好。
(2)打开仪器和搅拌器的电源,按要求调试好仪器,将测量选择开关置于pH档。
(3)用pH=6.86的标准缓冲溶液校准pH计。
(4)准确已取25.00mL 0.1mol/L 一元弱酸至一干净的100mL烧杯中。将烧杯置于滴定装置的磁力搅拌器上,放入搅拌磁子,下移电极架,使pH复合电极插入试液。
(5)测量:在滴定初始阶段,每滴加1mL氢氧化钠标准液记录一次稳定的pH值;到pH突跃范围之前滴加体积逐渐减少,如每次滴加0.5mL氢氧化钠;在化学计量点附近时每次只加0.1mL,以增加测量点的密度;过来化学计量点,每次滴加的体积可增大到1mL,直至过量。
五.结果处理
1.计算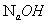 标准溶液的浓度:
标准溶液的浓度:
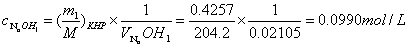
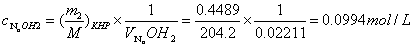
故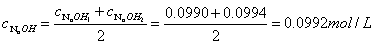
2.绘制pH-V、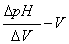 以及
以及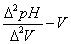 曲线图,并从图上找出终点体积。
曲线图,并从图上找出终点体积。
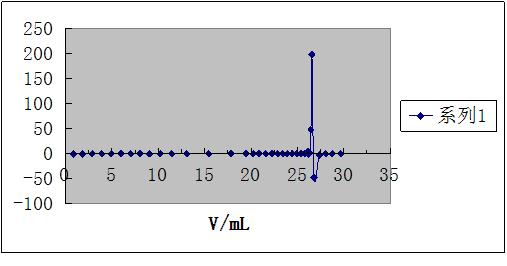
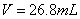
3.计算出终点体积V终和终点pH值并把它换算成终点[OH].
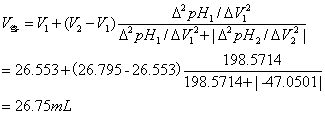
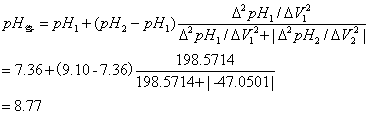
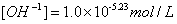
4.由终点体积计算一元弱酸的原始浓度:
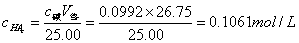
5.计算终点时弱酸盐浓度:
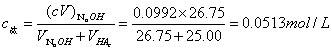
6.计算弱酸离解常数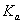 :
:
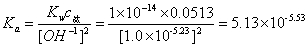
六.思考题
1.测定未知溶液pH值时,为什么要用pH标准缓冲液进行校正?
答:用pH标定时为了消除不对称电位的影响,pH电极工作时主要靠玻璃膜与水形成一层水化膜,若果没有这层膜,pH计不能正常工作,所以要标定。
2.测定的弱酸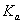 与文献值比较有何差异,如有,说明原因?
与文献值比较有何差异,如有,说明原因?
答:测得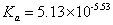 与文献值
与文献值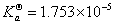 略偏小,可能是测定的pH偏大一点儿。
略偏小,可能是测定的pH偏大一点儿。
3.用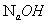 溶液滴定
溶液滴定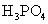 溶液,滴定曲线形状如何?怎样计算
溶液,滴定曲线形状如何?怎样计算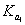 、
、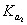 和
和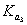 ?
?
答:有3个突跃的形状。分别读出突跃的体积和pH来计算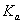 。
。
