实验四 醋酸电离常数的测定
1.实验目的:
(1)掌握醋酸电离常数的测定方法;
(2)学习PH计的使用。
2.实验原理:
醋酸(CH3COOH或HAc)是弱电解质,在水溶液中存在的电离平衡如下:
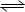 HAc H++Ac-
HAc H++Ac-
其平衡关系式可写为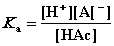 (3.4-1)
(3.4-1)
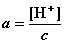 (3.4-2)
(3.4-2)
c为H Ac的起始浓度,[H+]、[Ac-]分别为H+、Ac-、HAc的平衡浓度,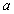 为电离度,
为电离度,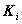 为电离平衡常数。
为电离平衡常数。
在HAc溶液中浓度关系为: [H+]=[Ac-]=ca [HAc]=c(1-a),
故有  (3.4-3)
(3.4-3)
当α<<1时(一般认为α<0.05时),1- α ≈1 ,则由(3.4-3)式可得:
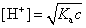 (3.4-4)
(3.4-4)
因此,只要测定已知浓度的HAc溶液的pH,就可知其[H+],从而可以计算该HAc溶液的电离度和平衡常数。
3.实验仪器与药品
仪器:碱式滴定管、吸量管(10mL)、移液管(25mL)、锥形瓶(50mL)、烧杯(50mL)、pH计。
药品:HAc(0.20mol·L-1)、0.2mol·L-1、NaOH标准溶液、酚酞指示剂。
4.实验步骤:
(1)醋酸溶液浓度的测定
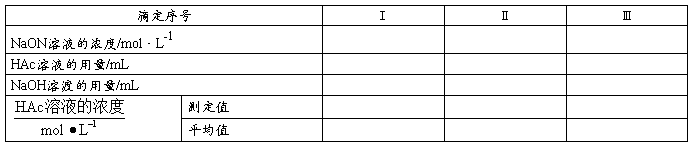
以酚酞为指示剂,用已知浓度的NaOH标准溶液标定HAc的准确浓度,把数据填入表3.4-1中。
表3.4-1 HAc浓度的确定
(2)配制不同浓度的HAc溶液
用移液管和吸量管分别量取25.00mL、5.00 mL、2.50 mL已测得准确浓度的HAc溶液,将它们分别加入三个50 mL容量瓶中,再用蒸馏水稀至刻度,摇匀,并计算出容量瓶中各HAc溶液的准确浓度。
(3)测定醋酸溶液的pH,计算醋酸的电离度和电离平衡常数
把以上四种不同浓度的HAc溶液分别加入到四只洁净干燥的50 mL烧杯中,按由稀到浓的顺序在pH计上分别测定出它们的pH,并把数据和计算结果填入表3.4-2中
表3.4-2 不同浓度HAc溶液的pH测定 温度 ℃

本实验测定的K值在1.0×10-5~2.0×10-5范围内合格(25℃的文献值为1.76×10-5)
5.思考题
(1)试推导一元弱酸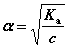 成立的条件,此式是否证明了溶液越稀,电离出的[H+ ]就越大?
成立的条件,此式是否证明了溶液越稀,电离出的[H+ ]就越大?
(2) 某一元有机酸的饱和水溶液的浓度为0.095mol/L,pH=2.94,求此酸的Ka 。
(3)同温下不同浓度的HAc的溶液的电离度是否相同?电离平衡常数是否相同?
(4)在测定HAc溶液pH值时,烧杯是否必须烘干?还可以作何处理?
(5)测定pH时,为什么要按溶液浓度从稀到浓的顺序进行?
(吴振国编)
第二篇:电导法测定弱电解质的电离平衡常数及数据处理
电导法测定醋酸电离常数
一、 实验目的
1.了解溶液电导、电导率和摩尔电导率的概念;
2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。
二、 实验原理
电解质溶液是靠正、负离子的迁移来传递电流。而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得。
一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ∞m是有差别的。这由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。所以,Λm通常称为表观摩尔电导率。
Λm/Λ∞m=α(U++ U-)/(U+∞+ U-∞)
若U+= U-,,U+∞=U-∞则
Λm/Λ∞m=α
式中α为电离度。
 AB型弱电解质在溶液中电离达到平衡时,电离平衡常数Ka?,起始浓度C0,电离度α有以下关系: AB A+ + B-
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数Ka?,起始浓度C0,电离度α有以下关系: AB A+ + B-
起始浓度mol/L: C0 0 0
平衡浓度mol/L: C0·(1-α) αC0 αC0
Kc?=[c(A+)/c?][c(B-)/c?]/[c(AB)/c?]=C0α2/(1-α)=C0Λm2/[c?Λ∞m(Λ∞m-Λm)]
根据离子独立定律,Λ∞m可以从离子的无限稀释的摩尔电导率计算出来。Λm可以从电导率的测定求得,然后求出Ka?。
ΛmC0/c? =Λ∞m2Kc?/Λm-Λ∞mKc?
通过ΛmC0/c?~1/Λm作图,由直线斜率=Λ∞m2Kc?,可求出Kc?。
三、仪器与试剂
DDS-11A(T)型电导率仪1台;恒温槽1套;0.1000mol/L醋酸溶液。
四、实验步骤
1.调整恒温槽温度为25℃±0.3℃。
2.用洗净、烘干的义形管1支,加入20.00mL的0.1000mol/L醋酸溶液,测其电导率。
3.用吸取醋酸的移液管从电导池中吸出10.00mL醋酸溶液弃去,用另一支移液管取10.00mL电导水注入电导池,混合均匀,温度恒定后,测其电导率,如此操作,共稀释4次。
4.倒去醋酸溶液,洗净电导池,最后用电导水淋洗。注入20mL电导水,测其电导率。
五、实验注意事项
1.本实验配制溶液时,均需用电导水。
2.温度对电导有较大影响,所以整个实验必须在同一温度下进行。每次用电导水稀释溶液时,需温度相同。因此可以预先把电导水装入锥形瓶,置于恒温槽中恒温。
六、数据记录及处理
第一次实验:实验温度:25.2℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1
表1 醋酸电离常数的测定
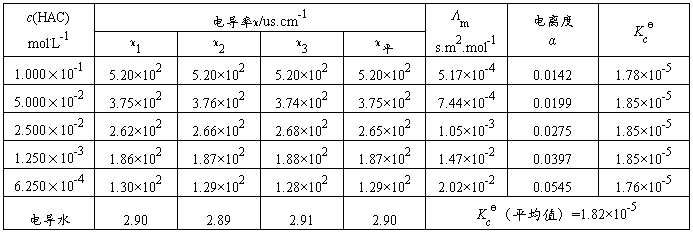
计算:Λm/s.m2.mol-1=(κHAC -κ电导水)us.cm-1×10-4/[c(HAC)mol.L-1×103]
={(κHAC -κ电导水) ×10-7/c(HAC)}
Λm(1)={(0.520×103-2.90)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1
Λm(2)={(0.375×103-2.90)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1
Λm(3)={(0.265×103-2.90)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1
Λm(4)={(0.187×103-2.90)/(1.250×10-3)}×10-7=1.47×10-2s.m2.mol-1
Λm(5)={(0.129×103-2.90)/(6.250×10-4)}×10-7=2.02×10-2s.m2.mol-1
Λ∞m(HAC)=Λ∞m(H+)+Λ∞m(AC-)=349.82s.cm2.mol-1+40.9s.cm2.mol-1
=390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1
α=Λm/Λ∞m
α(1)= 5.17×10-4/ 3.9072×10-2=0.0142
α(2)= 7.44×10-4 / 3.9072×10-2=0.0199
α(3)= 1.05×10-3 / 3.9072×10-2=0.0275
α(4)= 1.47×10-2 / 3.9072×10-2=0.0397
α(5)= 2.02×10-2/ 3.9072×10-2=0.0545
Kc?=C0Λm2/[Λ∞m(Λ∞m-Λm)
Kc?(1)=1.000×10-1×(5.17×10-4)2/[390.72×(390.72-5.17)×10-8]=1.78×10-5
Kc?(2)=5.000×10-2×(7.44×10-4)2/[390.72×(390.72-7.44)×10-8]=1.85×10-5
Kc?(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.85×10-5
Kc?(4)=1.250×10-3×(1.47×10-3)2/[390.72×(390.72-1.47)×10-8]=1.85×10-5
Kc?(5)=6.250×10-3×(2.02×10-3)2/[390.72×(390.72-2.02)×10-8]=1.76×10-5
Kc?(平均值)= 1.82×10-5
表2 醋酸电离常数的测定
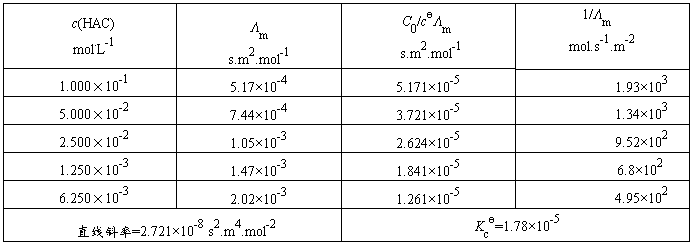

直线斜率=Λ∞m2Kc? =2.721×10-8,Kc?=2.721×10-8/(390.72×10-4)2=1.78×10-5
第二次实验:实验温度:24.9℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1
表1 醋酸电离常数的测定
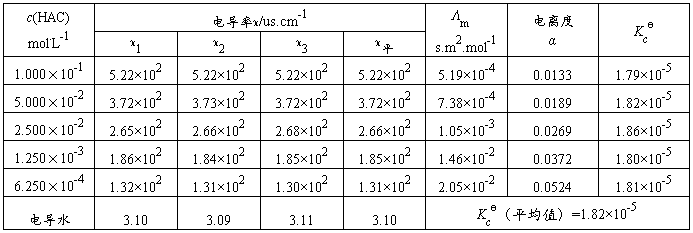
计算:Λm/s.m2.mol-1=(κHAC -κ电导水)us.cm-1×10-4/[c(HAC)mol.L-1×103]
={(κHAC -κ电导水) ×10-7/c(HAC)}
Λm(1)={(0.522×103-3.10)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1
Λm(2)={(0.372×103-3.10)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1
Λm(3)={(0.266×103-3.10)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1
Λm(4)={(0.185×103-3.10)/(1.250×10-3)}×10-7=1.46×10-2s.m2.mol-1
Λm(5)={(0.131×103-3.10)/(6.250×10-4)}×10-7=2.05×10-2s.m2.mol-1
Λ∞m(HAC)=Λ∞m(H+)+Λ∞m(AC-)=349.82s.cm2.mol-1+40.9s.cm2.mol-1
=390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1
α=Λm/Λ∞m
α(1)= 5.19×10-4/ 3.9072×10-2=0.0133
α(2)= 7.38×10-4 / 3.9072×10-2=0.0189
α(3)= 1.05×10-3 / 3.9072×10-2=0.0269
α(4)= 1.46×10-2 / 3.9072×10-2=0.0372
α(5)= 2.05×10-2/ 3.9072×10-2=0.0524
Kc?=C0Λm2/[Λ∞m(Λ∞m-Λm)
Kc?(1)=1.000×10-1×(5.19×10-4)2/[390.72×(390.72-5.17)×10-8]=1.79×10-5
Kc?(2)=5.000×10-2×(7.38×10-4)2/[390.72×(390.72-7.44)×10-8]=1.82×10-5
Kc?(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.86×10-5
Kc?(4)=1.250×10-3×(1.46×10-3)2/[390.72×(390.72-1.47)×10-8]=1.80×10-5
Kc?(5)=6.250×10-3×(2.05×10-3)2/[390.72×(390.72-2.02)×10-8]=1.81×10-5
Kc?(平均值)= 1.82×10-5
表2 醋酸电离常数的测定
实验温度:24.9℃,电导池常数K(l/A):0.94 m-1,Λ∞m=390.72 s.cm2/mol-1
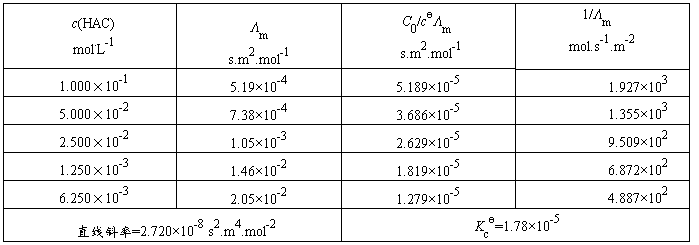
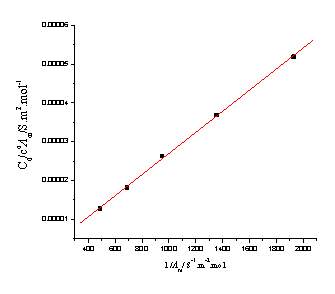
直线斜率=Λ∞m2Kc? =2.720×10-8,Kc?=2.720×10-8/(390.72×10-4)2=1.78×10-5
