实验三 醋酸解离度和解离常数的测定
一、实验目的
1. 了解弱酸的解离度和解离常数的测定方法。
2. 学会刻度吸管、容量瓶、滴定管的洗涤和使用及滴定方法。
3. 了解pH计的使用方法。
二、实验原理
 醋酸(CH3COOH或简写为HAc)是弱电解质,在水溶液中存在下列质子解离平衡:HAc + H2O H3O+ + Ac-
醋酸(CH3COOH或简写为HAc)是弱电解质,在水溶液中存在下列质子解离平衡:HAc + H2O H3O+ + Ac-
Ka = 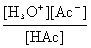 或简写为Ka =
或简写为Ka = 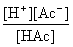
溶液中[H3O+] ≈ [Ac-],可通过测定溶液的pH值,根据pH==-lg[H3O+]计算出来。 [HAc] = CHAc-[H3O+] ,而CHAc可以用NaOH标准溶液通过滴定测得。这样,便可计算出该温度下的Ka,进而也可求得醋酸的解离度α。
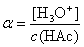 ×100%
×100%
三、仪器与试剂
1.仪器 pH计、50ml碱式滴定管一支、25ml移液管一支、10ml刻度吸管一支、50ml容量瓶3个、50ml烧杯4个、250ml锥形瓶3个、洗耳球
2.试剂 0.2 mol·L-1HAc溶液、0.20 mol·L-1NaOH标准溶液、酚酞指示剂
四、实验方法
1、配制不同浓度的醋酸溶液
用移液管分别量取0.1mol/L的HAc标准溶液5.00 ml、10.00 ml、25.00 ml于3个50 ml容量瓶中,加蒸馏水至满刻度,摇匀,备用。
2、测定不同醋酸溶液的pH值
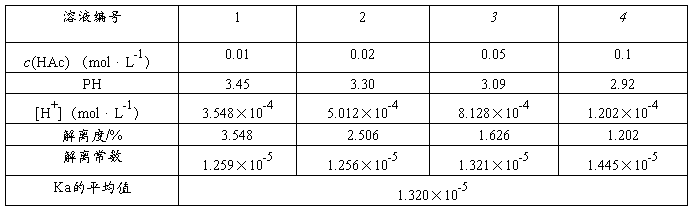
将原溶液上述三种不同浓度的醋酸溶液分别加入四个干燥的50 ml烧杯中,按由稀到浓的顺序用pH计分别测定它们的pH值。记录实验数据和温度,计算醋酸的Ka和α。把相关数据填入下表。
3、PH计的使用
将复合电极用蒸馏水吹洗,用滤纸片将电极吸干后,再把电极插入待测溶液中,轻轻摇动溶液,待显示屏上的数值稳定后读出溶液的PH值,清洗电极,测定其他缓冲溶液的PH值。
五、注意事项
1、用酸度计前,先要接通电源,预热30min,并进行校正。
2、每次测溶液PH前,都应先用蒸馏水冲洗电极,并用滤纸轻轻吸干。
3、配制溶液后要摇匀,使溶液均匀。
第二篇:2 醋酸标准解离常数和解离度的测定
醋酸标准解离常数和解离度的测定
一.实验目的
1.测定醋酸的电离常数,加深对电离度的理解;
2.学习正确使用pH计。
3. 巩固移液管和滴定的基本操作及容量瓶的使用。
二.实验原理
醋酸(CH3COOH或简写成HAc)是弱电解质,在溶液中存在如下电离平衡:
HAc→H++Ac–
Ki=[ H+][ Ac—]/[ HAc]
[ H+]、[ Ac—]和[ HAc]分别为 H+、Ac– 、HAc的平衡浓度,Ki为电离常数。
醋酸溶液的总浓度c可以用标准NaOH溶液滴定测得。其电离出来的H+离子的浓度可在一定温度下用pH计测定醋酸溶液的pH值,根据pH= – lg [ H+]关系式计算出来。另外,再从[ H+]= [Ac–]和[ HAc]= c–[ H+]关系式求出[Ac–]和[ HAc],代入Ki计算公式便可计算出该温度下的Ki值。醋酸的电离度是[ H+]/ c。
三.仪器与试剂
仪器:酸度计,容量瓶(50 mL),吸量管(10 mL ),碱式滴定管(50 mL),锥形瓶(250 mL),烧杯(50 mL )
试剂:标准NaOH(0.2 mol·L–1 ),HAc(0.2 mol·L–1),酚酞指示剂
四.实验步骤
1. 用NaOH标准溶液测定醋酸溶液的浓度(准确到三位有效数字)
用移液管吸取三份25.00 mL 0.2 mol·L–1 HAc溶液,分别置于锥形瓶中,各加2~3滴酚酞指示剂。分别用NaOH溶液滴定至溶液呈现微红色,半分钟内不褪色为止。记录下所用NaOH溶液的毫升数。
2. 配制不同浓度的醋酸溶液
用吸量管或滴定管分别取 2.50 mL,5.00 mL和25.00 mL已知其准确浓度的0.2 mol·L–1 HAc溶液于三个50 mL容量瓶中,用蒸馏水稀释至刻度,摇匀,制得0.01 mol·L–1、0.02 mol·L–1、0.1 mol·L–1 HAc溶液。
3. 测定0.01 mol·L–1、0.02 mol·L–1、0.1 mol·L–1和0.2mol·L–1HAc溶液的pH值
用四个干燥的50 mL 烧杯,分别取25 mL上述四种浓度的HAc溶液,由稀到浓分别用pH计测定它们的 pH值,并记录温度(室温)。
4. 未知弱酸标准解离常数的测定
取10.00 mL未知一元弱酸的稀溶液,用NaOH滴定到终点,然后再加入10.00 mL该弱酸溶液,混合均匀,测其pH值。计算该弱酸的标准解离常数。
五.数据处理及思考题
1. 自行设计实验记录和数据处理表格。
2. 自行推导计算公式并计算出相应的解离常数和解离度。
3. 在标定HAc溶液过程中,锥形瓶能否用蒸馏水冲洗?滴定至终点时,滴定管尖嘴部位有一滴溶液未滴下,对实际结果是否有影响?
4. 若改变所测溶液的温度,对结果是否有影响?
5. 在本实验中,测定HAc的解离常数时,HAc溶液的浓度必须精确测定;而测定未知酸的解离常数时,酸和碱的浓度都不必测定,只要正确掌握滴定终点即可,这是为什么?
【注】关于pH仪器的原理与使用由指导教师进行,也可自行参阅相关资料。
