实验五 电导滴定分析法测定未知酸
一.实验目的
1. 掌握电导率仪结构和测定溶液电导值的基本操作;
2.了解电导电极的结构和使用;
3.掌握电导滴定的基本原理和判断终点的办法。
二.实验原理
在滴定分析中,一般采用指示剂来判断滴定终点,但是稀溶液的滴定终点突跃甚小,而有色溶液的颜色会影响对指示剂在终点时颜色变化的判断,因此在稀溶液和有色溶液的滴定分析中,无法采用指示剂来判断终点。
本实验借助于滴定过程中离子浓度变化而引起的电导值的变化来判断滴定终点,这种方法称为电导滴定。NaOH溶液与HCL溶液的滴定中,在滴定开始时,由于氢离子的极限摩尔电导值较大,测定的溶液电导值也较大;随着滴定进行,H+和OH-离子不断结合生成不导电的水,在H+浓度不断下降的同时增加同等量的Na+离子,但是Na+离子导电能力小于H+离子,因此溶液的电导值也是不断下降的;在化学计量点以后,随着过量的NaOH溶液不断加入,溶液中增加了具有较强导电能力的OH-离子,因而溶液的电导值又会不断增加。由此可以判断,溶液具有最小电导值时所对应的滴定剂体积即为滴定终点。
三:实验仪器与试剂
1.DDS-307型电导率仪 2.DJS-1C型电导电极
3.85-1磁力搅拌器一台 4.0.1000mol/L NaOH标准溶液
5.未知浓度HCL溶液 6.10ml移液管1只
7.100ml玻璃烧杯1个
四.实验步骤
1.滴定前准备
按照滴定分析基本要求洗涤,润洗滴定管,装入0.1000mol/L的NaOH标准溶液,调节滴定液面至“0.00ml”处。
用移液管准确移取5.00ml未知浓度HCL溶液于100ml玻璃烧杯中,加入50ml蒸馏水稀释被测溶液,将烧杯置于磁力搅拌器上,放入搅拌珠。
按照要求将电导电极插入被测溶液;调节仪器“常数”旋钮至1.004;将仪器的“量程”旋钮旋至检查档;将“校准”旋钮旋至100;调节“温度”旋钮至室温21℃;将“量程”旋钮置于合适的量程范围。即可开始测量。
2.滴定过程中溶液电导值测定
按照下表依次滴加0.1000mol/L的NaOH标准溶液,读取并记录电导率仪上的电导值。
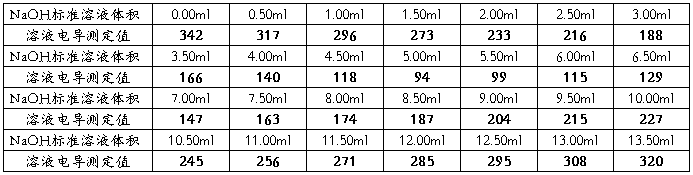
五.实验数据处理
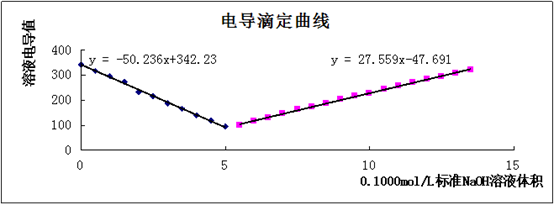
1.滴定曲线绘制
以测定的溶液电导值为纵坐标,滴加的NaOH标准溶液体积为横坐标制图,绘制电导滴定曲线,并采用作图法在滴定曲线上求出滴定终点所对应的滴定剂体积。
2.未知浓度HCL溶液的浓度计算
根据NaOH标准溶液的浓度,滴定终点时的滴定剂的体积,采用下式计算未知浓度HCL溶液的浓度:
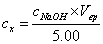 =
=
六.实验小结与讨论
1.实验前碱式滴定管必须清洗干净,并用0.1000mol/L的标准NaOH溶液润洗2-3次。
2.注意调节好磁力搅拌器的速度(注意观察搅拌珠的旋转以判断速度),不能过快而使液体飞溅,亦不能过慢而未使溶液混合均匀,而影响滴定结果。
3.将电导电极插入溶液时,要注意插入的深度及位置,既要保证搅拌珠不会损坏电极,也要保证滴定时的方便操作。
4.滴定开始前,要注意碱式滴定管的尖嘴处是否有空气,若有,一定要排空,且在后续的滴定操作中要注意控制胶管中的玻璃珠以控制差不多一次滴的滴定速度,这样即可保证不会留有空气柱。
5.一次滴定结束后,电导率仪显示的值会跳动,这是因为溶液还在混匀之中,要待其稳定后再记录电导值。
6.本次试验的误差主要来自于碱式滴定管的操作,因中途滴定中未控制好流速而使胶管中留有一段空气。
第二篇:电导的定分析法测定未知酸实验报告
电导的定分析法测定未知酸
【实验目的和要求】
1. 掌握电导率仪和测定溶液电导值的基本操作;
2. 了解电导电极的结构和使用;
3. 掌握电导滴定的基本原理和判断终点的方法。
【实验原理】
借助于滴定过程中离子浓度变化而引起的电导值的变化来判断滴定终点,这种方法称为电导滴定。以NaOH标准溶液滴定HCl溶液的电导滴定曲线来看。
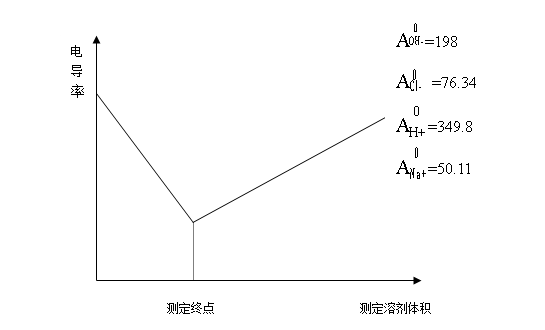
在NaOH溶液与HCl的溶液的滴定中,各种离子的极限摩尔电导值如图中所示,在滴定开始是,由于H+的极限摩尔电导值较大,测定的溶液电导值也比较大;随着滴定进行,H+和OH+不断结合生成不导电的水,在H+离子浓度不断下降的同时不断增加同等数量的Na+离子,但是由于Na+离子导电能力小于H+离子,因此溶液的电导值也是不断下降的;在化学计量点以后,随着过量的NaOH溶液不断加入,溶液中增加了具有较强导电能力的OH-离子,因为溶液的电导值也会不断增加。由此可以判断,溶液具有最小电导值是所对应的滴定剂体积为滴定终点。
【实验仪器与试剂】
1. DDS-307型电导率仪
2. DJS-1C型铂黑电导电极
3. 磁力搅拌器一台
4. NaOH标准溶液(0.1000mol/L)
5. 未知浓度HCl溶液
6. 10ml移液管一只
7. 100ml玻璃烧杯一个
【实验步骤】
1.滴定前准备
按照滴定分析基本要求洗涤、润洗滴定管,装入0.1000 mol/L的NaOH标准溶液,调节滴定管液面至“0.00ml”处。
用移液管准确移取5.00ml未知浓度的HCl溶液于100ml玻璃烧杯中,加入50ml蒸馏水稀释被测溶液,将烧杯置于磁力搅拌器上,放入搅拌棒。
2.安装好仪器,将电极插入被测溶液;完成电导率仪的各项调试。
3.滴定过程和溶液电导值测定。
启动磁力搅拌器,按照下表依次滴加0.1000mol/L的NaOH标准溶液,将电导率仪调到适合量程,开始测量。
【实验数据处理】

1.滴定曲线的绘制
以测定的溶液浓度电导值为纵坐标,滴加的NaOH标准溶液体积为横坐标绘制电导滴定曲线,并才用作图法在滴定曲线上去出滴定终点所对应的滴定剂体积。
【实验结果讨论一】
本次实验我们做了两组,这是第二组的实验数据。在第一组的实验数据中,我们由于操作失误,从滴加1.00mlNaOH溶液开始计电导率,记得滴加1.00mlNaOH溶液后溶液的电导率为333,按照后面的规律往前推,可得不滴加NaOH溶液即原HCL溶液的电导率估计在380-390.所以,两次实验的HCL溶液的电导率值相
差很大,分析原因如下:
第一组开始实验时,我们没有清洗电极,原电极上残留离子干扰实验结果,使电导率累积增大。再加上两次实验稀释HCL所用的蒸馏水不一样,导致各离子浓度不一样,最终两个因素作用,所以实验一组数据比实验二组数据整体偏大。但这种情况并不影响我们的最终结果,只是曲线的纵截距变化,同一实验所得两条直线的交点所对应的横坐标不变,即所得的滴定终点不变。
绘图如下:




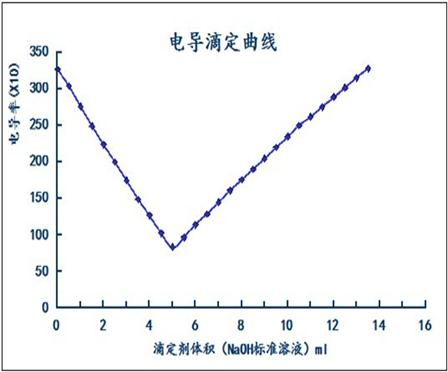
令Y1=Y2,,得:X=4.88
2.未知浓度HCl溶液的浓度计算
根据NaOH标准溶液的浓度,滴定终点时滴定剂的体积,计算未知浓度HCl溶液的浓度。
V(ep)=4.88ml 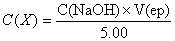 ≈0.10mol/L
≈0.10mol/L
【实验结果讨论二】
采用作图法在图上求得滴定终点的读取值,这个点是图中前半部分趋势线和后半部分趋势线的理论交点的横坐标,不是直接连接所有的点得到的的最低点然后求其的横坐标。
关于最后的V(ep)值,我们采取的是根据两条直线的方程,求得交点,减少作图带来的误差。
最后的实验结果为0.976mol/L,根据计算保留两位有效小数,约等于0.10mol/L。实验误差原因可能有:1.滴定过程中,溶液没反应完全就读数;2.滴定过程中,每次滴定体积不一样;3.电极没有充分浸在待测溶液。
【实验注意事项】
1.准确按照说明书完成电导率仪的各项调试。
2.在实验开始时必须清洗电极,擦干后再进行实验测定。
3.实验室中,加50ml的蒸馏水只是让电极浸在溶液中,所以,这里不需要精确量取蒸馏水的体积。
4.移取NaOH标准溶液一定要按照操作过程一步步来,不要出现错误操作,同样的,在滴定时也要注意这些问题,不要将溶液滴到瓶外,或者瓶壁,这些都不是标准的。
5.同样滴定时,眼睛要时刻注意滴定管中的液面变化,而且要平视。
6.注意仪器“常数”旋钮必须与电极上表明的数值一致。
