滴定分析基本操作及酸碱浓度的比较 实验报告
实验目的就不写出来了大家肯定都有
一 实验原理
1.酸碱指示剂有其变色范围(pH),甲基橙的变色范围是3.1-4.4,0-3.1为红色,
3.1-4.4为橙色,4.4-14为黄色。酚酞的变色范围是8.2-10.0,0-8.2为无色,8.2-10.0为浅红色,10.0-14为红色
2.盐酸和氢氧化钠的反应方程式为:HCl+NaOH=NaCl+H2O
在中和反应过程中,溶液的pH会发生突变,可以通过溶液的颜色变化判断滴定终点,之后测定出消耗的酸或者碱的体积,就可以利用公式:
VB*cB*νA=VA*cA*νB
求出碱和酸的浓度之比(ν代表化学计量数,对于盐酸和氢氧化钠的反应盐酸和氢氧化钠的化学计量数均为1)
3.滴定分析法是将滴定剂(已知准确浓度的标准溶液)滴加到含有被测组分的溶液中,直到达到滴定终点,然后根据滴定剂的浓度和消耗的体积计算被测组分含量的一种方法
4,。标准溶液的配置方法一般有两种:直接配制法和间接配制法,本实验是用间接配制法,以酚酞或甲基橙为指示剂来确定滴定终点
二 实验步骤
1. 实验试剂
浓度为cNaOH=1mol/LNaOH溶液(要求不含碳酸根离子)
浓度为cHCl=1mol/LHCl溶液
0.1%酚酞指示剂
0.1%甲基橙指示剂
2. 实验仪器的准备
(1) 酸式、碱式滴定管各一支,洗涤至内壁不挂水珠。然后涂油,试漏,
最后用5-10ml去离子水润洗三次备用
(2) 锥形瓶三个,称量瓶两个,细口试剂瓶两个,用自来水洗至不挂水珠,
再用少量去离子水润洗三次,备用。称量瓶洗净后倒扣在干净的表面皿或滤纸上,令其自然干燥,以备下次实验用
3. 酸碱溶液浓度的比较
(1) 用量筒分别量取40ml浓度为cNaOH=1mol/LNaOH溶液和浓度为
cHCl=1mol/LHCl溶液,分别倒入两个试剂瓶中,再用量筒分别量取
360ml去离子水,分别倒入两个试剂瓶中,将两个试剂瓶中的溶液摇
匀,配成浓度为cNaOH=0.1mol/LNaOH溶液和浓度为cHCl=0.1mol/LHCl溶液
三 实验记录和数据处理
1. 用甲基橙作为指示剂
25.00 25.00 25.00
0.00 0.00 0.00
25.00 25.00 25.00
22.10 21.85 21.95
0.00 0.00 0.00
22.10 21.85 21.95
0.8840 0.8740 0.8780
0.8787
0.005300 0.004700 0.0007000 科学记数法
0.003567
2.用酚酞作为指示剂
29.45 29.40 29.60
0.00 0.00 0.00
29.45 29.40 29.60
25.00 25.00 25.00
0.00 0.00 0.00
25.00 25.00 25.00
0.8489 0.8503 0.8446
0.8479
0.001000 0.002400 0.003300
0.002233
四 误差分析
1. 误差分析
用两种指示剂测得的体积比VHCl/VNaOH不一定吻合:因为甲基橙作指示剂,HCl滴定NaOH,终点偏酸性,可能略过化学计量点0.1%,而酚酞作指示剂,NaOH滴定HCl,终点偏碱性,可能略过化学计量点0.1%,因此可能造成VHCl/VNaOH(甲基橙)>VHCl/VNaOH(酚酞)。
在装溶液前应将溶液摇匀,否则浓度不均,每次取出的溶液浓度不同
指示剂的量要适当,过少或过多导致无法准确判定滴定终点或消耗酸或碱的体积发生变化
酸碱滴定管应该先用溶液润洗,否则导致加入溶液的浓度减小,消耗酸或碱的体积发生变化
锥形瓶不能用溶液润洗,否则导致消耗酸或碱的体积增加
必须要将酸碱滴定管中的气泡排干净,否则会对读数造成影响
振荡锥形瓶时不能将溶液溅出,也不能将滴定管中的溶液滴到锥形瓶外面
如果停止滴定时滴定管口悬一滴溶液导致读数误差
不同实验者的主观因素(对颜色的敏感程度不同)导致对滴定终点的判断不同
酸碱滴定管在使用前应进行试漏,否则导致误差
必须等到附在内壁上的溶液流下后再去读数,滴定管必须处于垂直状态,眼睛应与弯月面最下缘在同一水平线上,不能俯视或仰视,否则导致误差
溶液变色立即停止滴定并读数
临近终点时要放慢滴定速度,每加一滴或半滴要充分摇动直至指示剂变色停止滴定,等待0.5-1min读数
将试剂瓶中的溶液倒入滴定管时不能借助其他器皿,以免标准溶液浓度改变造成污染
滴定管内壁必须完全被水润湿不挂水珠,充液后弯月面边缘处不起皱变形,否则滴定时溶液沾在壁上影响容积测量的准确性,使用酸管时手心不要碰到活塞尾部致使漏液,使用碱管时挤压时不能使玻璃球移位或挤压球的下部以免形成气泡
2. 其他注意事项
滴加指示剂时不能将胶头滴管伸入锥形瓶中
每次测定都必须将溶液重新装至滴定管的零刻度线
应该左手持滴定管右手握住锥形瓶瓶口,使滴定管管尖伸入锥形瓶口约1cm,瓶底离滴定台底板约2-3cm,边摇动边滴定,摇动时锥形瓶要按一个方向转动,瓶口不晃动,不碰管尖
锥形瓶洗净后还有少量去离子水不会导致误差
酸管涂油时应先用滤纸将活塞、活塞孔和活塞套擦干,活塞孔附近不要涂太多,涂油过少,活塞转动不灵活导致操作困难,也容易漏液,涂油过多会造成活塞孔甚至管尖堵塞,涂油后的滴定管要重新试漏
滴定开始前,滴定管管尖如有液滴,用烧杯内壁碰去
滴定终点时,滴定管管尖如有液滴,可用锥形瓶内壁靠下,或用洗瓶将其冲下,但不能用过多的去离子水
每秒滴三滴的滴定速度比较合适
滴定管使用之后洗净并倒置在滴定管架上
注意浓度比等于体积反比,即CNaOH/CHCl=VHCl/VNaOH,并注意结果的有效数字。
五 思考题
1. 因为在装入标准溶液之前,滴定管已经用去离子水润洗过,有少量的去离子水残留,用标准溶液润洗三次的目的是保证滴定管内溶液的浓度与试剂瓶中一样,如果不润洗则会导致加入的溶液被稀释,浓度减小,消耗的酸或碱的体积增加。锥形瓶不需要润洗,锥形瓶的作用只是提供反应场所,加入锥形瓶中的盐酸和氢氧化钠的量是用滴定管量取好的,如果润洗则会导致消耗酸或碱的量发生改变,导致误差。
2. 因为在放置过程中,溶液吸收了空气中的CO2,CO2与水反应生成碳酸,导致溶液的pH降低,溶液褪色,不需要再滴定。
3. 不影响终点读数,因为盐酸和氢氧化钠的体积是准确量取的,向锥形瓶中加入少量去离子水不影响锥形瓶中溶质的量,也不影响消耗的标准溶液的量,对滴定结果没有影响,不影响终点读数
第二篇:大学化学实验——盐酸浓度的标定
盐酸浓度的标定
一 实验目的
1. 了解基准物质无水碳酸钠(Na2CO3)的性质及其应用
2. 掌握HCl标准溶液的配置及标定,进一步熟练滴定分析基本操作
二 实验原理
反应 2HCl+ Na2CO3 = 2NaCl+CO2+H2O
混合指示剂:一种是由两种或两种以上的指示剂混合而成;另一种是由某种指示剂和一种惰性染料组成. 利用颜色之间的互补作用,使变色更加敏锐. 甲基橙
三 主要仪器和试剂
酸式滴定管 锥形瓶 移液管 分析天平
Na2CO固体(基准)3 HCl 溴甲酚绿-二甲基黄混合指示剂
四 实验步骤
1.0.1mol·L-1盐酸溶液的配置
2. 盐酸溶液浓度的标定
(1)差减法称取0.13-0.15g无水Na2CO3三粉,称准至0.0001g
(2)加水50mL.搅拌,使Na2CO3完全溶解.
(3)加入9滴溴甲酚绿-二甲基黄混合指示剂 绿色变亮黄
(滴定管的准备)
五 实验记录
盐酸标准溶液的标定
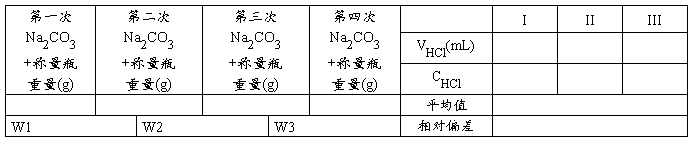
由碳酸钠的重量及实际消耗的盐酸的体积计算溶液的物质的量浓度
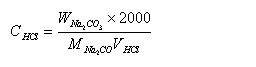
式中W Na2CO3—碳酸钠的质量(g),M Na2CO3—碳酸钠的物质的量(106.0 g/mol),V HCl —盐酸溶液的体积(ml)。
六 思考题
1.氢氧化钠和盐酸能否作为工作基准试剂?能否直接在容量瓶中配置0.1000 mol·L-1的氢氧化钠溶液?
不能
2. 以碳酸钠标定盐酸浓度时为什么用甲基橙作指示剂(溴甲酚绿-二甲基黄混合指示剂)?能否用酚酞作指示剂?
酚酞变色点8.0-9.6, HCl首先和CO32-生成HCO3- 达到第一化学计量点 第一次突跃pH值为8.31 第二化学计量点产物H2CO3 pH 3.9
3 草酸钠能否用来标定盐酸溶液?
不能 标定高锰酸钾
4.标定盐酸浓度时称量无水碳酸钠要不要十分准确,溶解时加水量要不要十分准确,为什么?
看计算公式
