实验六 磷酸的电位滴定
应化1101 夏海琴 2014.11.13
一、实验目的
1. 掌握酸度计测量溶液pH和雷磁ZDJ-4A自动电位滴定仪的操作要点。
2. 了解电位滴定法的基本原理。
3. 学习使用Excel或Origin软件处理NaOH滴定磷酸的数据和绘图。更直观地观察滴定曲线中的两个突跃,学会计算相应的两级解离常数。
4. 掌握用三切线法及一级、二级微商来处理实验数据和分析实验结果。
二、实验原理
电位滴定法是根据滴定过程中,指示电极的电位或pH产生“突变”,从而确定滴定终点的一种分析方法。
在以NaOH滴定H3PO4时,将饱和甘汞电极及玻璃电极插入待测溶液中,使之组成原电池:
Ag | AgCl,HCl (0.1 mol/L) | 玻璃膜 | 被测试液 || KCl ( >3.5 mol/L),HgCl2 | Hg
 H+ 盐桥
H+ 盐桥
 玻璃电极 甘汞电极
玻璃电极 甘汞电极
被测试液
由于玻璃薄膜上的阳离子能与溶液中的H+产生离子交换而产生电势,因而称玻璃电极为指示电极,甘汞电极为参比电极,当NaOH溶液不断滴入试液中,溶液H+的活度随着改变,电池的电势也不断变化,可用能斯特(Nernst)公式表示为
E电池= ΔEθ – 0.059V lgαH+ 或E电池= ΔEθ + 0.059V pH
此处 ΔEθ = Eθ(HgCl2/Hg) - Eθ(AgCl/Ag)。
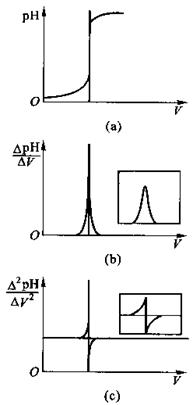
 以滴定体积VNaOH为横坐标,相应的溶液的pH为纵坐标,绘制NaOH滴定H3PO4的滴定曲线,曲线上呈现出两个滴定突跃,以“三切线法”作图,可以较准确地确定两个突跃范围内各自的滴定终点,即在滴定曲线两端平坦转折处作AB及CD两条切线,在“突跃部分”作EF切线与AB、CD两线相交于Q,P两点,在P、Q两点作PG,QH两条线平行于横坐标。然后在此两条线之间作垂直线,在垂线一半的J点处,作JJ'线平行于横坐标,J'点称为拐点,即为滴定终点。此J'点投影于pH与V坐标上分别得到滴定终点时的pH和滴定剂的体积V,见图8-1。 图8-1 三切线法作图
以滴定体积VNaOH为横坐标,相应的溶液的pH为纵坐标,绘制NaOH滴定H3PO4的滴定曲线,曲线上呈现出两个滴定突跃,以“三切线法”作图,可以较准确地确定两个突跃范围内各自的滴定终点,即在滴定曲线两端平坦转折处作AB及CD两条切线,在“突跃部分”作EF切线与AB、CD两线相交于Q,P两点,在P、Q两点作PG,QH两条线平行于横坐标。然后在此两条线之间作垂直线,在垂线一半的J点处,作JJ'线平行于横坐标,J'点称为拐点,即为滴定终点。此J'点投影于pH与V坐标上分别得到滴定终点时的pH和滴定剂的体积V,见图8-1。 图8-1 三切线法作图
如要求更准确的确定滴定终点,可用一级微商法(dpH/dV-V)和二级微商法(d2pH/dV2-V)。表8-1为数据处理示例。如用三切线法求得第一个终点时,Vep1=19.00 mL,用一级微商求得Vep1= 19.50 mL,用二级微商求得Vep1 = 19.46 mL。
结果略有差异,用二级微商法处理准确度较高。
1. 一级微商计算示例
当滴入NaOH 18.80 mL到19.00 mL时,
 = 0.45
= 0.45
表8-1 H3PO4电位滴定数据记录和处理示例
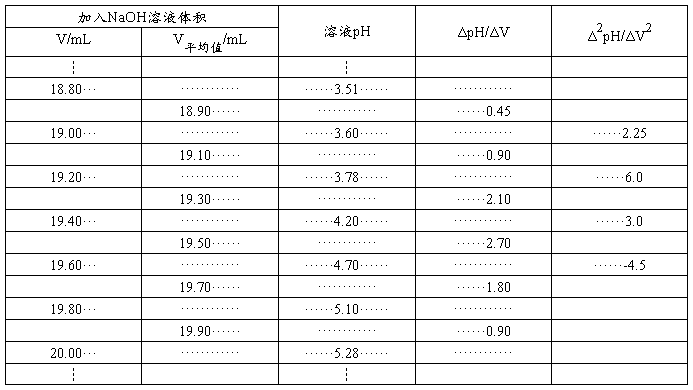
0.45对应的体积V平均值= (V2 + V1)/2 = 18.90 mL,其余各点按相同方法计算得到表8-1。以Δ pH/ΔV为纵坐标,V平均值为横坐标作图,得图8-2(b)。
2. 二级微商法示例
先按上述方法求得19.10 mL和18.90 mL的一级微商后,再求出19.00mL的二级微商。
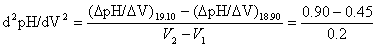 = 2.25
= 2.25
此即为19.00mL对应的值。
以d2pH/dV2为纵坐标,对应的V为横坐标描点作图,得到图8-2(c)。显然,当Δ2pH/ΔV2 = 0时,二级微商由正值变化到负值,此点即为滴定终点。
用电位法绘制滴定曲线,不仅可以确定滴定终点,还能求算H3PO4的Ka1和Ka2。
从pH-V滴定曲线上找出滴定到第一个终点所用NaOH滴定剂体积一半时对应的pH,此时[H3PO4]≈[H2PO4-],由Ka1≈[H+][H2PO4-]/[H3PO4]计算得到Ka1=[H+],即pKa1=pH。由于磷酸的Ka1较大,用上述最简式计算误差大,最好采用下列公式计算。
 [H+] =
[H+] = 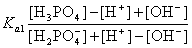 (1)
(1)
由于[H+] >> [OH-],上式可简化为
[H+] =  (2)
(2)
同理可得到H3PO4的Ka2,但应根据第二个滴定终点所用的NaOH体积一半时对应的pH求算。此时pH粗略地估算约等于pK2。较精确计算时,应将(2)式略作改变。即
[H+] = 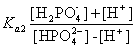 (3)
(3)
本实验要求用0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4,绘制出pH-V滴定曲线。由此滴定曲线上用三切线或一级微商法准确求出pHep1和pHep2;Ka1及Ka2。其数据处理方法可以用手工法,也可以用计算机法。处理H3PO4电位滴定数据的计算机程序介绍见附录。
三、仪器与试剂 图8-2 一级和二级微商法处理滴定曲线
(1) pHS-3c型酸度计及配套电极,雷磁ZDJ-4A自动电位滴定仪及配套电极。
(2) 电磁搅拌器。
(3) NaOH标准溶液 0.1 mol·L-1 配制和标定见:靳素荣, 王志花. 分析化学实验[M].武汉: 武汉理工大学出版社,20##年第45页。
(4) H3PO4 0.1 mol·L-1溶液 量取7.00 mL原装H3PO4加水稀释至1 L,充分摇匀,存放在试剂瓶中。
(5) 标准缓冲溶液 0.025 mol·L-1 KH2PO4与0.025 mol·L-1 Na2HPO4的混合溶液,pH为6.864。
(6) 甲基橙指示剂 2 g·L-1。
(7) 酚酞指示剂 2 g·L-1 乙醇溶液。
四、实验步骤
1. 连接电位滴定装置
2. 熟悉pHs-3c型酸度计的正确使用方法及电极的安装、仪器的校正和定位及测量pH等主要操作。
3. 测量H3PO4试液的pH
吸取20.00 mL (或25.00 mL) 0.1 mol·L-1 H3PO4溶液放入150 mL(或200 mL)烧杯中,插入电极,如电极未被浸没,可适当加入一些蒸馏水至电极能被浸没。装电极时,注竟不要碰撞。按操作要领和步骤测量0.1 mol·L-1 H3PO4试液的pH。
4. 磷酸的电位滴定
将0.1 mol·L-1 NaOH标准溶液装入碱式滴定管,搅拌磁子放入被测试液中,为了更好地观察终点,同时加入甲基橙和酚酞指示剂。开动电磁搅拌器,用NaOH标准溶液滴定,开始时可—次滴入5 mL,测量pH。其后每加入2 mL NaOH溶液测量相应的pH。滴定至pH=3后,每隔0.1 mL或0.2 mL测量。特别是突跃部分要多测几个点(可借助甲基橙指示剂的变色来判断第一个计量点)。然后用0.l mol·L-1 NaOH溶液继续滴定,方式与第一计量点相同,当被测试液中出现微红色时 ( 或滴至pH=7.5后 ),每次滴入NaOH的体积要少,直至出现第二次突跃,测量至pH约为11.5时可停止滴定。
实验完毕,取下甘汞电极,用水吹洗,并用滤纸吸干后归还原处保存。玻璃电极仍浸泡在盛有蒸馏水的烧杯中。
五、实验数据及处理
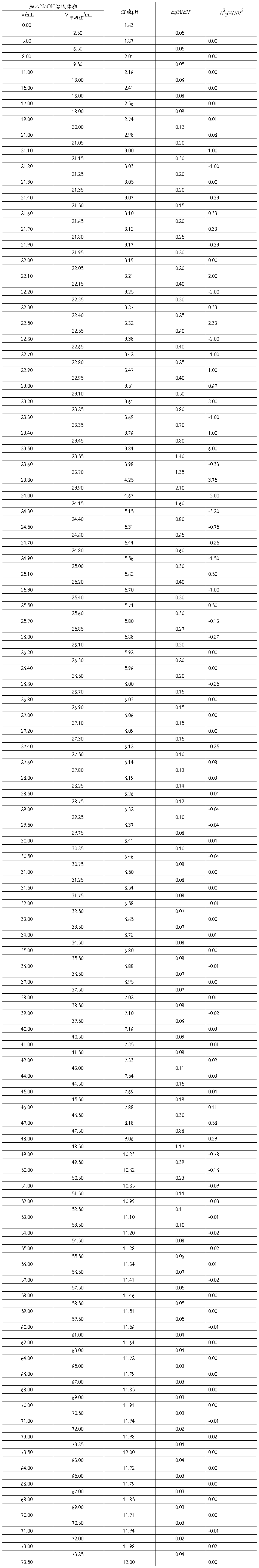
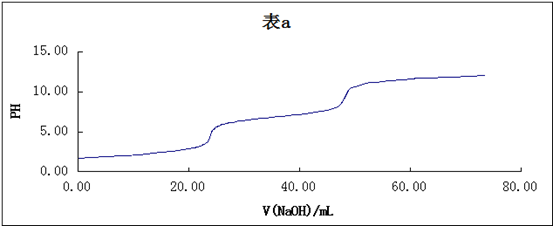
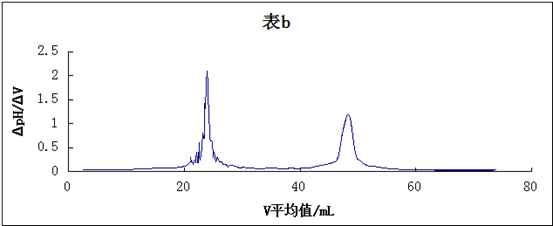
由上表计算可得所用磷酸的pKa1=6.80×10-3、pKa2=5.96×10-8
第二篇:电位滴定法测定酱油中氨基酸态氮的含量
实验九 电位滴定法测定酱油中氨基酸态氮的含量
一、实验原理
根据氨基酸的两性作用,加入甲醛以固定氨基的碱性,使羧基显示出酸性,将酸度计的玻璃电极及甘汞电极(或复合电极)插入被测液中构成电池,用碱液滴定,根据酸度计指示的pH值判断和控制滴定终点。
二、仪器与试剂
1、仪器 酸度计 磁力搅拌器 烧杯(250mL) 微量滴定管
2、试剂 pH=6.18标准缓冲溶液;20%中性甲醛溶液;0.05mol/L左右的NaOH标准溶液
三、实验操作方法
(1)样品处理
先根据实验四测出待测酱油的比重,然后吸取酱油5.00mL于100mL容量瓶中,加水定容。吸取定容液20.00mL于250mL烧杯中,加水60mL,放入磁力转子,开动磁力搅拌器使转速适当。用pH6.18的标准缓冲液校正好酸度计,然后将电极清洗干净,再插入到上述酱油液中,用NaOH标准溶液滴定至酸度计指示pH8.2,记下消耗的NaOH溶液体积。
(2)氨基酸的滴定
在上述滴定至pH8.2的溶液中加入10.00mL的中性甲醛溶液,再用NaOH标准溶液滴定至pH9.2,记下消耗的NaOH溶液体积。
(3)空白滴定
吸取80mL蒸馏水于250mL的烧杯中,用NaOH标准溶液滴定至pH8.2,然后加入10.00mL中性甲醛溶液,再用NaOH标准溶液滴定至pH9.2,记下加入甲醛后消耗的NaOH溶液体积。
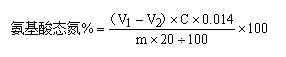
四、 实验计算
式中:
V1——酱油稀释液在加入甲醛后滴定至pH9.2所用NaOH标准溶液的体积mL;
V2——空白滴定在加入甲醛后滴定至pH9.2所用NaOH标准溶液的体积mL
C ——NaOH标准溶液的浓度mol/L
M——吸取的酱油的质量g
0.014——氮的毫摩尔质量g/m mol
