实验六 全自动电位滴定法测定混合酸
1 实验目的
(1)初步了解和掌握自动电位滴定仪的原理和操作;
(2)掌握多元酸或混合酸分步滴定的有关规律;
(3)用NaOH溶液滴定由HCl与H3PO4组成的混合溶液,分别测出这两种酸的浓度。 2 实验仪器和试剂
2.1 实验仪器
798MPT(或702SM)自动电位滴定仪,氢离子选择性复合电极(滴定仪和电极均由瑞士万通公司生产)。
100mL烧杯,100mL量筒,10mL(或5mL)移液管,洗耳球。
2.2 实验试剂
0.1031mol/L NaOH标准溶液(已用基准邻苯二甲酸氢钾标定);由HCl与H3PO4组成的待测混合溶液。
3 实验原理和步骤
3.1 实验原理
由于HCl 是强酸,H3PO4的pKa1、pKa2及pKa3分别为2.12、7.20及12.36,用NaOH溶液滴定由HCl与H3PO4组成的混合溶液,滴定曲线有两个突跃。第一个突跃对应的NaOH溶液的体积记作V1,相应的滴定产物是H2O和H2PO4-,滴定反应是
H+ + OH- = H2O (1)
和
H3PO4 + OH- = H2PO4- (2)
第二个突跃对应的NaOH溶液的体积记作V2,相应的滴定产物是HPO42-,滴定反应是
H2PO4- + OH- = HPO42- (3)
在上述滴定中,V2 -V1是滴定H2PO4- 所消耗的NaOH溶液的体积(见反应(3)),也是滴定H3PO4所消耗的NaOH溶液的体积(见反应(2));V1 -(V2 - V1)= 2V1 - V2 是滴定HCl所消耗的NaOH溶液的体积(见反应(1))。因此,利用上述两个突跃对应的滴定终点V2和 V1 ,按以下两式,可以分别求出混合溶液中HCl和H3PO4的浓度:
cHCl?(2V1?V2)?cNaOH (4) 5.00
cH3PO4?
3.2 实验步骤 (V2?V1)?cNaOH (5) 5.00
实验步骤:在100mL烧杯中,用移液管吸入5.00mL HCl和H3PO4混合溶液,加50mL H2O,加入搅拌子,放好电极,用0.1031mol/L NaOH标准溶液电位滴定。仪器自动记录滴定曲线和滴定数据,并测出滴定终点V1和V2。
仪器的设置:选择Met(等体积)滴定模式,滴定步长0.10mL,平衡时间30s,滴定至加入的标准溶液体积为10.00mL。
4 实验结果和讨论
测定结果(见下表);
表1 HCl和H3PO4混合溶液的测定结果
V1/mL V2/mL 混合溶液中HCl的浓度/(mol·L) -1混合溶液中H3PO4的浓度/(mol·L) -16.035
5 思考题 8.955 0.06423 0.06021
(1)多元酸(二元酸或三元酸)分步滴定的条件是什么?混合酸(如由HCl与H3PO4组成的混合酸)分步滴定的条件是什么?
答:多元酸分步滴定的条件是其相邻两级离解常数相差足够大(大等于10000),且C×Ka1≥10∧-9,C×Ka2≥10∧-9;
混合酸分步滴定的条件是:
(C1×Ka1)/(C2×Ka2)≥10∧-4;C×Ka1≥10∧-9,C×Ka2≥10∧-9;两个滴定突跃。 (C1×Ka1)/(C2×Ka2)≥10∧-4;C×Ka1≥10∧-9,C×Ka2<10∧-9;一个滴定突跃。 (C1×Ka1)/(C2×Ka2)<10∧-4;C×Ka1≥10∧-9,C×Ka2≥10∧-9;一个滴定突跃。
(2)电位滴定法确定滴定终点有哪些方法?这些方法的依据是什么?
答:1、绘E-V曲线图,曲线上折点即化学计量点;?2、一级微商法,曲线尖峰即滴定终点;,此法较准确,但手续复杂,且尖峰有实验点外推出,所以也有一定误差。?3、三级微商法,二级微商为零时为终点。?
(3)自动电位滴定仪确定滴定终点的依据是什么?
答:通过测量电极电位变化,来测量离子浓度。被测离子的浓度不断发生变化,因而指示电极的电位随之变化。在滴定终点附近,被测离子的浓度发生突变,引起电极电位的突跃,因此根据电极电位的突跃可确定滴定终点,并给出测定结果。?
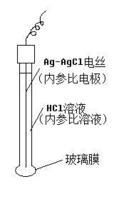
(4)本实验所用的氢离子选择性复合电极的构造和原理是怎样的?
答:构造:电极内一定浓度的HCl溶液(内参比溶液),插入银-氯化银电丝(内参比电极),电极玻璃泡的下端是一层特殊的玻璃膜(电极膜);
原理:玻璃膜中的Na+于溶液中的H+可以发生交换,对H+有选择性响应。
(5)在本实验的滴定过程中,若存在CO2的干扰,对测定结果有什么影响?
答 :若存在CO2,使消耗的碱量V2增大所以盐酸浓度偏小,磷酸浓度偏大。
第二篇:全自动电位滴定法测定混合酸
实验1 全自动电位滴定法测定混合酸
1 实验目的
①初步了解和掌握自动电位滴定仪的原理和操作;
②掌握多元酸或混合酸分步滴定的有关规律;
③用NaOH溶液滴定由HCl与H3PO4组成的混合溶液,分别测出这两种酸的浓度。
2 实验仪器和试剂
自动电位滴定仪,氢离子选择性复合电极,100mL烧杯,100mL量筒,5mL移液枪,0.1000mol/L NaOH标准溶液;由HCl与H3PO4组成的待测混合溶液。
3 实验原理
由于HCl 是强酸,H3PO4的pKa1、pKa2及pKa3分别为2.12、7.20及12.36。第一个突跃对应的NaOH溶液的体积记作V1,相应的滴定产物是H2O和H2PO4-。利用两个突跃对应的滴定终点V2和 V1 ,按以下两式,可以分别求出混合溶液中HCl和H3PO4的浓度:
4 实验步骤
用移液枪将5.00mL HCl和H3PO4混合待测溶液吸入烧杯中,加50mL H2O,加入搅拌子,放好电极,用0.1000mol/L NaOH标准溶液电位滴定。仪器自动记录滴定曲线和滴定数据,并测出滴定终点V1和V2。
5 实验数据记录
V1/mL V2/mL 混合溶液中HCl的浓度/(mol·L-1) 混合溶液中H3PO4的浓度/(mol·L-1)
5.617 9.176 0.0424 0.7334
5 思考题
①多元酸(二元酸或三元酸)分步滴定的条件是什么?混合酸分步滴定的条件是什么?
答:多元酸分步滴定的条件是其相邻两级离解常数相差足够大(大等于10000),且 C×Ka1≥10∧-9,C×Ka2≥10∧-9; 混合酸分步滴定的条件是:(C1×Ka1)/(C2×Ka2)≥10∧-4;C×Ka1≥10∧-9,C×Ka2≥10∧-9;两个滴定突跃。(C1×Ka1)/(C2×Ka2)≥10∧-4;C×Ka1≥10∧-9,C×Ka2<10∧-9;一个滴定突跃。(C1×Ka1)/(C2×Ka2)<10∧-4;C×Ka1≥10∧-9,C×Ka2≥10∧-9;一个滴定突跃。
②电位滴定法确定滴定终点有哪些方法?这些方法的依据是什么?
答:①作图求终点;②二阶微商法确定终点:根据代数学原理,在终点体积时,二阶微商为零 ③自动电位滴定仪确定滴定终点的依据是什么?
答:通过测量电极电位变化,来测量离子浓度。被测离子的浓度不断发生变化,因而指 示电极的电位随之变化。在滴定终点附近,被测离子的浓度发生突变,引起电极电位的突 跃,因此根据电极电位的突跃可确定滴定终点,并给出测定结果。
④本实验所用的氢离子选择性复合电极的构造和原理是怎样的?
答:构造:电极内一定浓度的HCl溶液(内参比溶液),插入银-氯化银电丝(内参比电极),电极玻璃泡的下端是一层特的玻璃膜(电极膜);原理:玻璃膜中的Na+于溶液中的H+可以发生交换,对H+有选择性响应。
⑤在本实验的滴定过程中,若存在CO2的干扰,对测定结果有什么影响?
答:使消耗的碱量V增大所以盐酸浓度偏小,磷酸浓度偏大。
