六盘水实验二中化学实验技能大赛评分表
班级: 姓名:
第二篇:酸碱中和滴定习题
永安中学20xx年春期高二化学
酸碱中和滴定练习题
高二、1班 姓名: 总分
一、选择题
1、在下列叙述仪器“0”刻度位置正确的是( )
A. 在量筒的上端
C. 在托盘天平刻度尺的正中
A. 25ml量筒
C. 25ml碱式滴定管 B. 在滴定管上端 D. 在托盘天平刻度尺的右边 B. 25ml酸式滴定管 D. 有刻度的50ml烧杯 2、准确量取25.00ml KMnO4溶液,可选用的仪器是( )
3、下列实验中,由于错误操作导致所测出的数据一定偏低的是( )
A. 用量筒量取一定体积液体时,俯视读出的读数
B. 用标准盐酸滴定氢氧化钠溶液测碱液浓度时,酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液,所测出的碱液的浓度值
C. 测定硫酸铜晶体结晶水含量时,加热温度太高使一部分硫酸铜发生分解,所测出的结晶水的含量
D. 做中和热测定时,在大小烧杯之间没有垫碎泡沫塑料(或纸条)所测出的中和热数值
4、酸碱中和反应属于放热反应,酸碱中和生成1mol水时所放出的热量称为中和热。放下列浓度均为0.1mol/L的溶液混合时,相关说法中正确的是( )
A. 与NaOH反应时,HCL的中和热小于CH3COOH的中和热
B. 与NaOH反应时,HCL的中和热大于CH3COOH的中和热
C. 与NaOH反应时,H2SO4的中和热大于HCL的中和热
D. 与H2SO4反应时,Ba(OH)2的中和热等于NaOH的中和热的2倍
5、下列关于等体积、等pH的NaOH和氨溶液的说法正确的是( )
A. 两种溶液中OH的浓度相同
B. 需要等浓度、等体积的盐酸中和
C. 温度升高10℃,两溶液的pH仍相等
D. 两种溶液中溶质的物质的量浓度相同
6、酸碱完全中和时( )
A、酸与碱的物质的量一定相等 C、酸与碱的质量相等
+- B、酸所能提供的H和碱所能提供的OH的物质的量相等 D、溶液呈中性
7、要准确量取25.00mL的稀盐酸,可用的仪器是( )
A、25mL容量瓶 B、25mL量筒 C、25mL酸式滴定管 D、25mL碱式滴定管
8、在25mL的碱式滴定管中盛有溶液,液面恰好在20mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( )
A、5mL B、20mL C、大于5mL D、小于5mL
9、用物质的量浓度相同的盐酸、硫酸、磷酸溶液,分别中和质量相同、浓度相同的NaOH溶液生成正盐,消耗这三种酸的体积比是( )
A、1:1:1 B、3:2:1 C、6:3:2 D、1:2:3
10、中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐 1 -
酸的体积分别为V1、V2、V3,则三者的大小关系为( )
A、V3>V2>V1 B、V3>V2=V1
C、V3=V2>V1 D、V1=V2>V3,
11、用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是( )
A、加入5mL盐酸再进行滴定 B、返滴一滴待测盐酸
C、重新进行滴定 D、以上方法均不适用
12、常温下,在氨水中滴入盐酸,使pH=7,下列说法中错误的是( )
A、加入的盐酸量不足 B、加入的盐酸过量
+--7+- C、c(H)=c(OH)=10mol/L D、c(NH4)<c(Cl)
13、向10mLpH=12的某碱溶液中加入10mLpH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是( )
A、弱碱 B、一元强碱 C、多元强碱 D、任何强碱
14、等量的苛性钠溶液分别用pH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb,则它们之间的关系是( )
A、Va>10Vb B、Vb=10Va C、Va<10Vb D、Vb>10Va
15、某苛性钾样品中含有不与酸反应的杂质,为了测定苛性钾的纯度,取样品0.56g溶于水制成1L溶液。取此溶液25.00mL,用0.005mol/LH2SO4标准液滴定,用去24mL,则苛性钾的质量分数为( )
A、96% B、48% C、9.6% D、56%
16、下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是 ( )
A.⑥③①②⑤④ B.⑤①②⑥④③
C.⑤④③②①⑥ D.③①②④⑤⑥
-117、某学生用碱式滴定管量取0.1mol·L的NaOH溶液,开始时仰视液面读数为1.0mL, 取
出部分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为 ( )
A.大于10.0mL B.小于10.0mL C.等于10.0mL D.等于11.0mL
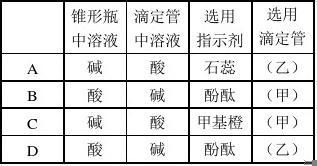
18、 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从表中选出正确选项( )

19、 用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮 ④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外
A. ①③④
-1B. ②⑤ C. ②③⑤ D. ①③ -120、用0.01mol·LH2SO4滴定0.01mol·LNaOH溶液,中和后加水至100mL .若滴定时终点
+判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05mL),则①和②[H]
2
之比值( )
3 4A.10 B.50 C.5×10D.10
二、填空题
1、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式
与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是 。
(2)配制250mL0.1mol/L溶液时,还缺少的仪器是 。
(3)过滤时,应选用上述仪器中的 (填编号)。
2、用标准盐酸滴定未知浓度的氨水时,锥形瓶中通常盛放 ,滴定时左手 ,右手 ,双眼注视 ,当 时才达到滴定终点。如滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
(1)用酚酞作指示剂 ;
(2)滴定前未用标准盐酸润洗酸式滴定管 ;
(3)滴定前用氨水润洗锥形瓶 ;
(4)滴定前标准盐酸是敞口放置的 ;
(5)中和过程中往锥形瓶中加一些水 ;
(6)滴定结束时俯视滴定管刻度 。
3、称取mg纯NaOH配成500mL溶液,取出25mL恰好与20mL盐酸完全中和,则该盐酸的物质的量浓度是 。
若该mgNaOH中实际含有少量的氢氧化钙,则盐酸的实际浓度比上面的数值要 。 若该mgNaOH中实际含有少量的氯化钠,则盐酸的实际浓度比上面的数值要 。 若mgNaOH中实际含有少量的碳酸钠,则盐酸的实际浓度比上面数值要 。
4、环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为: 2Mn+O2+4OH=2MnO(OH)2(该反应极快)
②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H),使之生成I2,再用bmol/L的Na2S2O3
溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:
MnO(OH)2+2I+4H=Mn+I2+3H2O I2+2S2O3=2I+S4O6
试回答:(1)水中溶解氧的计算式是(以g/L为单位) 。
(2)滴定(I2和S2O3反应)以淀粉为指示剂,终点时溶液由 色变为 色。
(3)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果(偏高、偏低、无影响) 。
(4)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果(偏高、偏低、无影响) 。 2--+2+2--2-+2+-
3
5、用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答: ⑴将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
⑵取10.00mL待测液,用 式滴定管量取。
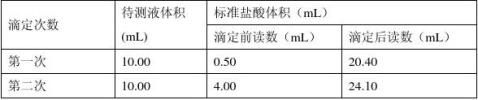
⑶用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定到终点。 ⑷根据下列数据,烧碱的纯度为 。
⑸以标准的盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视 ②未用标准液润洗滴定管 ③用待测液润洗锥形瓶 ④不小心将标准液滴在锥形瓶外面 ⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁 6、氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式: MnO4-3-H+——2+42-H2O
(2)滴定过程中,NaHSO3溶液的体积是20.00mL,消耗0.100mol/L的酸性KMnO4溶液16.00mL,则NaHSO3溶液的物质的量浓度是 mol/L。
(3)下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管 B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡 D.不小心将少量酸性KMnO4溶液滴在锥形瓶外 E.观察读数时,滴定前仰视,滴定后俯视
7、 用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号
1
2
3 待测HCl溶液的 体积/mL 20.0 20.0 20.0 滴入Na2CO3溶液的 体积/mL 24.8 23.1 22.9
(1)滴定中误差较大的是( )次实验,造成这种误差的三个可能原因是: .
(2)计算未知盐酸的浓度(数据精确到0.1)。
4
