 院系:医学检验系 班级:11检验本科1班 姓名:****
院系:医学检验系 班级:11检验本科1班 姓名:****
间接电位分析法测定磷酸浓度
实验目的和要求
1、掌握酸度计的基本结构及操作;
2、掌握复合电极的基本结构、保存和使用;
3、掌握电位滴定法测定多元酸的原理与方法;
4、掌握电位滴定曲线的绘制及滴定终点的确定方法;
5、掌握电位滴定数据的处理方法。
实验原理
磷酸是一个三元酸,但是其第二、第三极离解常数很小,当磷酸浓度较小时,仅仅只有第一级离解能够被NaOH滴定,可应用于滴定分析:
H3PO4+NaOH=NaH2PO4+H2O
在滴定过程中,随着滴定剂的不断加入,磷酸与NaOH发生反应,溶液中的H+浓度不断变化,由此引起电池的电动势(电极电位)也不断变化,达到滴定化学计量点附近时,H+浓度的突跃将引起电极电位也产生突跃,从而可以根据电位变化确定滴定终点。采用这种电位滴定方法,可以对弱酸弱碱、多元酸碱、混合酸碱是否能够被滴定进行研究。
实验仪器与试剂
1、pH-3C型酸度计 2、NaOH标准溶液(0.1000mol/L)
3、磷酸待测样品溶液 4、pH复合电极一只
5、磁力搅拌器一台 6、10ml移液管1只
7、100ml玻璃烧杯1个 8、50ml量筒1个
实验步骤
1、滴定前准备
打开pH-3C型酸度计开关,按“mV”按钮。取1个100ml玻璃烧杯,用移液管准确移10.00ml待测磷酸样品溶液,加入25ml蒸馏水稀释溶液,将烧杯置于磁力搅拌器上,开动搅拌器,插入pH复合电极。
3、滴定过程中电极电位测定
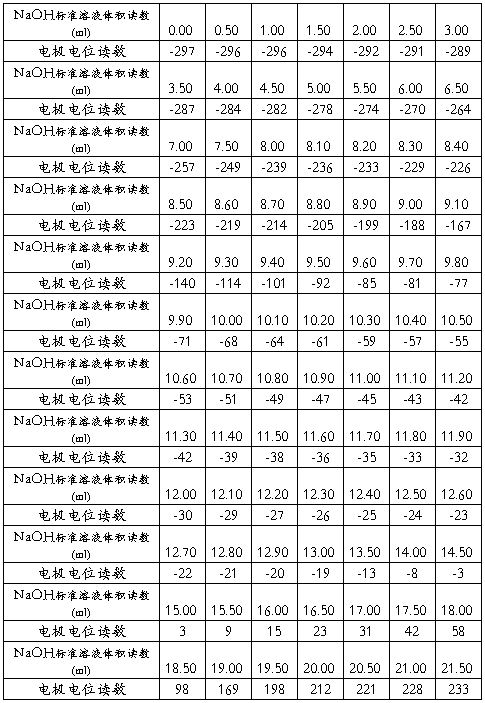
按照下表滴定NaOH标准溶液,读取不同滴定体积时所对应的电极电位值。
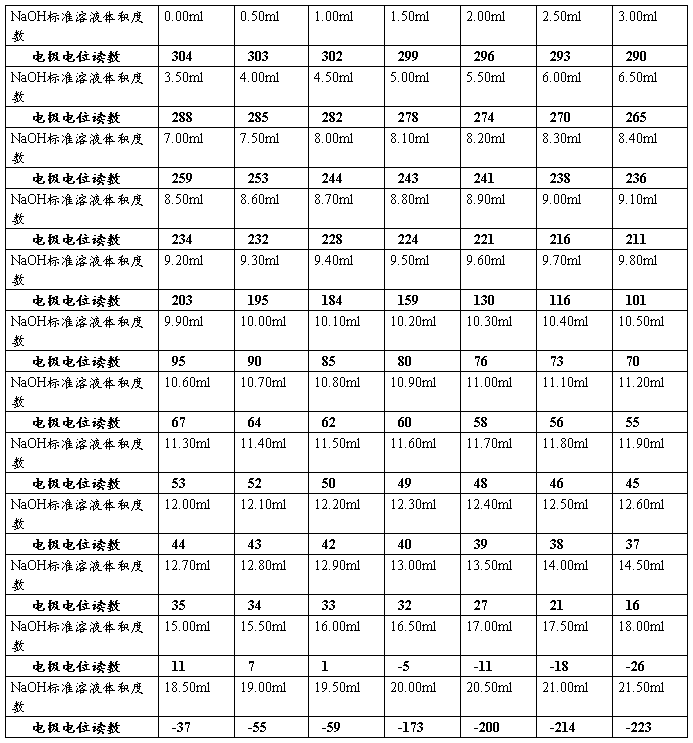
实验数据处理
1、滴定曲线绘制
以测定的电极电位值为纵坐标,滴加的NaOH标准溶液体积为横坐标制图,绘制滴定曲线。
2、采用作图法求出滴定终点
在绘制的滴定曲线上,通过滴定曲线的上、下两个拐点处画出两条为45°角的切线,在两切线之间作一垂线,再通过垂线的中点作一条与两切线平行的直线,该直线与滴定曲线的交点即为A点,A点在横坐标上对应的NaOH标准溶液体积就是滴定终点,如图所示:

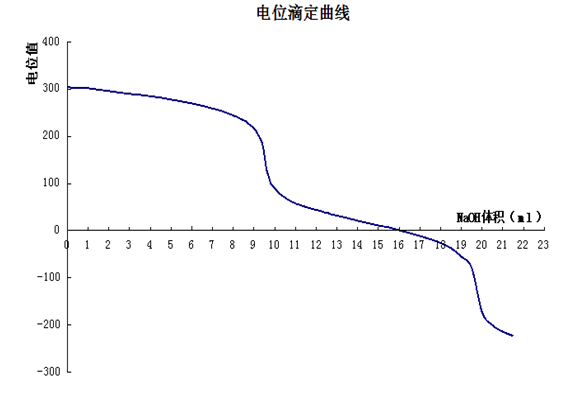
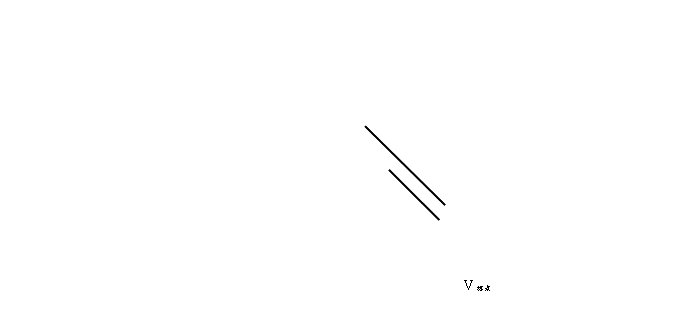
根据上图,可知V终点=9.50ml。
3、采用计算法求出滴定终点
分析上面滴定数据,观察滴定突跃(电极电位出现快速变化)出现的位置,以该点为中心,左右各取五个电极电位值及对应的滴定体积值,列如下表,按照表格要求计算对应的各个计算值。

在上述计算结果中,对计算的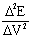 值进行分析,寻找刚好由负值变化为正值的两个点,将其对应的数据列入下表
值进行分析,寻找刚好由负值变化为正值的两个点,将其对应的数据列入下表

按照下式计算求出滴定终点,并将结果与作图法得到的结果进行比较:
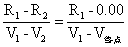
求得,V终点=9.48ml
4、未知浓度磷酸溶液的浓度计算
根据作图法和计算法得到的滴定终点体积值、NaOH标准溶液的浓度,采用下式计算未知浓度磷酸溶液的浓度:
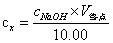
作图法求得:cx=0.0950mol/L 计算法求得:cx= 0.0948mol/L
5、结果比较

实验讨论
1、注意事项: ?实验过程中需要滴加0.1ml的NaOH标准溶液,对技术要求较高,注意滴加过程对少量滴加溶液的操作 ;?PH复合电极在测定完成后,应及时清洗并置于3mol/LKCl溶液中保存。
2、计算法中的△E/△V表示曲线的斜率,△2E/△V2表示斜率的变化率,由于滴定突跃,导致斜率变化率发生正负的突跃变化,而滴定终点斜率的变化率应为0,由作图法大致判断出滴定终点在R1处,所以△2E/△V2的斜率在R1与滴定终点近似相等,所以可以根据公式(R1-R2)/(V1 –V2)=(R1-0.00)/(V1-V终点)算出V终点 。
3、与化学分析法相比,电位滴定法有很多优越性,除了适用于没有适当指示剂及浓度很稀的试液的滴定反应外,还特别适合于混浊、荧光性、有色的、甚至不透明的溶液的滴定。如采用自动电位滴定仪,还可以提高分析精度,减少人为误差,提高分析速度,实现全自动化操作。
4、在采用计算法求滴定终点的方法时,寻找刚好由负值变化为正值(或刚好有负值变化为正值)的两个点时发现有两个转折点,但由变化的大小可知第二个转折点很有可能是由误差造成,滴定0.1ml体积NaOH溶液不易操作,误差大。
第二篇:间接电位分析法测定磷酸浓度
间接电位分析法测定磷酸浓度
检本一班 2组宋文博 2009221832
实验目的
1. 掌握酸度计的基本结构及操作
2. 掌握玻璃电极的基本结构、保存和使用
3. 掌握电位滴定测定多元酸的原理和方法
4. 掌握电位滴定曲线的绘制及滴定终点的确定方法
5. 掌握电位滴定数据的处理方法
实验原理
玻璃电极属于以玻璃薄膜为敏感膜的一类离子选择电极,可对溶液中的氢离子产生选择性响应,其电极电位与被测氢离子浓度之间符合能斯特关系,可应用于氢离子浓度或溶液酸度值的测定。
本实验采用玻璃电极作为指示电极,饱和甘汞电极作为参比电极与电池被测溶液组成电池,利用电位仪测定电池电动势,电池组成如下:
Ag︱AgCl(s),内参比溶液︱玻璃膜︱待测溶液‖KCl(饱和),Hg2Cl2(s)︱Hg
在构成的电池中,饱和甘汞电极的电极电位不变,玻璃电极的电极电位(电池电动势)仅随待测溶液中的氢离子的浓度变化而变化,可表示如下:
E=K+2.303RT/(nF)×lg[H+]
磷酸是一个三元酸,但是其第二、第三级解离常数很小,当磷酸浓度很小时,仅仅只有第一级解离能被NaOH滴定,可用于滴定分析:
H3PO4+NaOH=NaH2PO4+H2O
在滴定过程中,随着滴定剂的不断加入,磷酸与NaOH发生反应,溶液中的氢离子不断变化,由此引起的电池电动不断变化,达到滴定化学计量点附近时,氢离子浓度的突跃将引起电池电动势也产生突跃,从而可以根据电位变化确定滴定终点。采用这种电位滴定法,可对弱酸、弱碱多元弱酸弱碱、混合酸碱是否能被滴定进行研究。
实验仪器与试剂
pHS-3C型酸度计,NaOH标准溶液(0.1000mol/L),磷酸待测样品溶液,玻璃电极、饱和甘汞电极各一只,磁力搅拌器一台,10ml移液管一只,100ml烧杯1个
实验步骤
1. 滴定前准备
按照仪器要求,安装pHS-3C型酸度仪,分别接上玻璃电极和饱和甘汞电极。取1个100ml玻璃烧杯,用移液管准确移取10.00ml待测磷酸溶液,加入25ml蒸馏水稀释,将烧杯至于磁力搅拌器上,开动搅拌器插入玻璃电极和饱和甘汞电极。
2. 滴定过程中电极电位的测定
按照仪器操作程序完成仪器各项调节,使其处于mv位,按照下表滴加NaOH标准溶液,读取不同滴定体积时的电极电位值。
实验数据处理
1. 滴定曲线绘制
以NaOH标准溶液体积为横坐标,电极电位为做坐标制图,绘制标准曲线

2. 采用作图法求出滴定终点
在绘制的滴定曲线上,通过滴定曲线上上下两个拐点处画出两条为45度角的切线,在两切线之间做一垂线,再通过垂线的中点做一条与两切线平行的直线,该直线与滴定曲线的交点极为A点,A点在横坐标轴上对应的NaOH标准溶液的体积就是滴定终点。
3. 采用计算法求出滴定终点
分析上面滴定数据,观察滴定突跃出现的位置,以该点位中心,左右各取五个电极电位值及对应的滴定体积,列入表二,按照表格要求计算对应的各个计算值。
在表二的计算结果中,对计算的△2E/△V2值进行分析,寻找刚好由正值变化为负值(或刚好由负值刚好变化为正值)的两个点,将对应的数据列入下表:
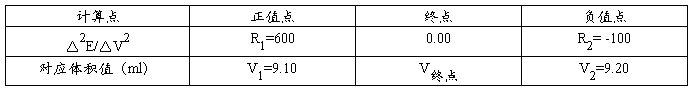
按照下式计算求出滴定终点,并将结果与作图法得到的结果进行比较
(R1-R2)/(V1 –V2)=(R1-0.00)/(V1-V终点)
V终点=9.11ml
4. 未知浓度磷酸溶液的浓度的计算
根据作图法和计算法得到的滴定终点体积值、NaOH标准溶液的浓度,采用下式计算未知浓度磷酸溶液的浓度:
Cx=CNaOH×V终点/10.00
C作图=0.1000×9.10/10.00=9.10×10-2mol/L
C计算=0.1000×9.11/10.00=9.11×10-2mol/L
表二
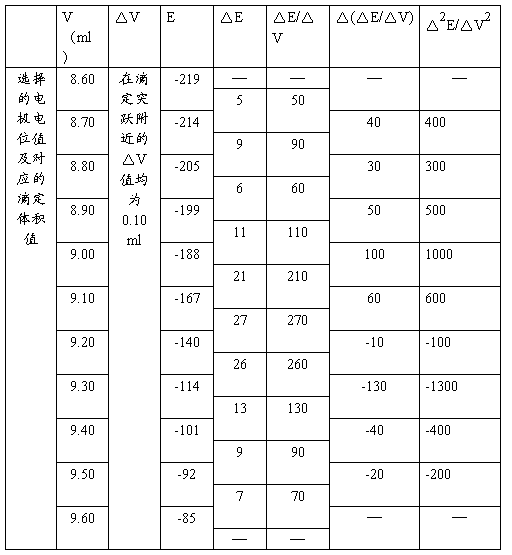
5.结果比较
将实验所得最后结果填入下表,比较实验结果并进行分析

讨论
1. 玻璃电极的薄膜很脆弱,操作过程中注意不要打破
2. 实验过程中需要滴加0.5ml和0.1ml的NaOH标准溶液,对技术要求较高,注意滴加过程对少量滴加溶液的操作
计算法中的△E/△V表示曲线的斜率,△2E/△V2表示斜率的变化率,由于滴定突跃,导致斜率变化率发生正负的突跃变化,而滴定终点斜率的变化率应为0,由作图法大致判断出滴定终点在R1处,所以△2E/△V2的斜率在R1与滴定终点近似相等,所以可以根据公式(R1-R2)/(V1 –V2)=(R1-0.00)/(V1-V终点)算出V终点
3. 注意检查甘汞电极的内参比溶液情况,不要让其干涸,并需其液面接触电极
4. 与化学分析法相比,电位滴定法有很多优越性,除了适用于没有适当指示剂及浓度很稀的试液的滴定反应外,还特别适合于混浊、荧光性、有色的、甚至不透明的溶液的滴定。如采用自动电位滴定仪,还可以提高分析精度,减少人为误差,提高分析速度,实现全自动化操作。
