分析化学实验教学指导
EDTA标准溶液的配制与的标定
一、 实验目的
1、 了解EDTA标液的配制和标定原理;
2、 掌握常用的标定EDTA的方法。
二、 实验原理
1、 EDTA:乙二胺四乙酸H4Y(本身是四元酸),由于在水中的溶解度很小,通常把它制成二钠盐(Na2H2Y·2H2O),也称为EDTA或EDTA二钠盐。EDTA相当于六元酸,在水中有六级离解平衡。与金属离子形成螯合物时,络合比皆为1:1。
EDTA因常吸附0.3%的水分且其中含有少量杂质而不能直接配制标准溶液,通常采用标定法制备EDTA标准溶液。
标定EDTA的基准物质有纯的金属:如Cu、Zn、Ni、Pb,以及它们的氧化物。
某些盐类:如CaCO3、ZnSO4.7H2O、MgSO4.7H2O。
2、 金属离子指示剂:在络合滴定时,与金属离子生成有色络合物来指示滴定过程中金属离子浓度的变化。
M + In ←→ MIn
纯蓝色 酒红色
滴入EDTA后,金属离子逐步被络合,当达到反应化学计量点时,已与指示剂络合的金属离子被EDTA夺出,释放出指示剂的颜色:
MIn + Y ←→ MY +In
酒红色 纯蓝色
指示剂变化的pMep应尽量与化学计量点的pMsp一致。金属离子指示剂一般为有机弱酸,存在着酸效应,要求显色灵敏,迅速,稳定。
常用金属离子指示剂:
铬黑T(EBT):pH=10时,用于Mg2+,Zn2+,Cd2+,Pb2+,Hg2+,In3+,
二甲酚橙(XO):pH5~6时,Zn2+
K-B指示剂(酸性铬蓝(K)-荼酚绿(B)混合指示剂):pH=10时,用于Mg2+,Zn2+,
分析化学实验教学指导
Mn2+。pH=12时,用于Ca2+。
三、 实验步骤
1、标准溶液和EDTA溶液的配制
(1)、Ca2+标准溶液
差减法称取计算量的CaCO3于150ml小烧杯中→溶解(少量水润湿,盖上表面皿,用滴管从烧杯嘴处滴加HCl至CaCO3完全溶解→冷却→定量转移至250ml容量瓶中→定容→计算Ca2+的浓度。
(2)、EDTA溶液的配制
天平称取计算量的EDTA二钠盐于200ml烧杯中→温热溶解→冷却。
2、EDTA的标定
用CaCO3为基准物质,铬黑T为指示剂标定EDTA
移液管准确平行移取25.00ml Ca2+标准溶液三份于锥形瓶中→加一滴甲基红,用氨水中和至红变黄→加10mlNH3-NH4Cl缓冲溶液调节pH值→加入K-B指示剂→用EDTA滴定至蓝色→计算EDTA浓度。
四、 思考题
1、 为什么要使用两种指示剂分别标定?
答案要点:因为络合滴定中,EDTA与金属离子形成稳定络合物的酸度范围不同,如Ca2+,Mg2+要在碱性范围内,而Zn2+,Ni2+,Cu2+等要在酸性范围内。故要根据不同的酸度范围选择不同的金属离子指示剂,从而在标定EDTA时,使用相应的指示剂,可以消除基底效应,减小误差。
2、 在中和标准物质中的HCl时,能否用酚酞取代甲基红,为什么?
答案要点:不能用酚酞取代甲基红,氨水中和盐酸,产物NH4Cl是强酸弱碱盐,呈弱酸性,而酚酞是碱性指示剂,故不能用酚酞作指示剂,而甲基红的变色范围是4.4-6.2,可以用来做指示剂。
3、 阐述Mg2+-EDTA能够提高终点敏锐度的原理。
答案要点:铬黑T与Mg2+能形成稳定的络合物,显色很灵敏,但与Ca2+形成的络合物不稳定,
分析化学实验教学指导
显色灵敏度低,为此在pH=10的溶液中用EDRA滴定Ca2+时,常于溶液中先加入少量MgY,使之发生置换反应,置换出Mg2+:
MgY+Ca2+ == CaY+Mg2+,
置换出的Mg2+与铬黑T显出很深的红色:Mg2++EBT=Mg-EBT(红色)
但EDTA与Ca2+的络合能力比Mg2+强,滴定时,EDTA先与Ca2+络合,当达到终点时,EDTA夺取Mg-EBT中的Mg2+,形成MgY,
Y+Mg-EBT=MgY+EBT (蓝色)
游离出的指示剂显蓝色,变色很明显,在这里,滴定前的MgY与最后生成的MgY物质的量相等,故不影响滴定结果。
4、 滴定为什么要在缓冲溶液中进行?如果没有缓冲溶液存在,将会导致什么现象发生? 答案要点:在络合滴定过程中,随着络合物的生成,不断有H释出:
M+H2Y=MY+2H
因此,溶液的酸度不断增大,酸度增大的结果,不仅降低了络合物的条件稳定常数,使滴定突跃减小,而且破坏了指示剂变色的最适宜酸度范围,导致产生很大的误差。因此在络合滴定中,通常需要加入溶液来控制溶液的pH值。
++
第二篇:EDTA标准溶液的配置和标定
姓名:舒睿 学号:5603111040 试验时间:第八周,星期3 ,14点
实验九 EDTA标准溶液的配制和标定
一、 实验目的:
1.进一步掌握分析天平的正确使用;
2.掌握正确的滴定操作方法。
3学习EDTA 标准溶液的配制和标定方法;
4.掌握配位滴定指示剂的指示原理、终点的判断。
5. 掌握定量分析实验报告的正确表示(格式、内容、有效数字等)
二、原理
乙二胺四乙酸二钠简称EDTA,由于EDTA与大多数金属离子形成稳定的1:1型螯合物,故常用作配合滴定的标准溶液。
标定EDTA溶液的基准物有:Zn,ZnO,CaCO3,Cu,Bi ,Ni,Pb MgSO4·7H2O,等。通常选用的标定条件应尽可能与测定条件一致,以免引起系统误差,如果用被测元素的纯金属或化合物作基准物质,就更为理想。
如果EDTA溶液用于测定pb2+,Bi3+,则宜用纯金属锌作基准物标定EDTA,用铬黑T作指示剂,用氨缓冲溶液,在pH=10进行标定。也可用二甲酚橙作指示剂,用六次甲基四胺调节酸度,在pH=5~6进行标定。
本实验用CaCO3作基准物,在pH≧12的NaOH缓冲液中,以钙指示剂, 标定EDTA。溶液由酒红色变为纯蓝色为终点。反应如下:
滴定前 : Ca2++ HInd2-(纯蓝) CaInd-(酒红)+ H+
滴定开始至终点:
Ca2+ + H2Y2- CaY2- + H+
pH≧12
终点:
CaInd-(酒红)+H2Y2- CaY2- + HInd2-(纯蓝)
pH≧12
计算EDTA浓度
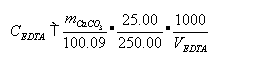
三、试剂
1、乙二胺四乙酸二钠(Na2H2Y·2H2O)
摩尔质量为372.2。1g/2人。
2、 CaCO3 (A·R)
3、NH3-NH4Cl缓冲溶液
4、钙指示剂
四、主要步骤
①0.005mol/L EDTA 溶液的配制:1g 乙二胺四乙酸二钠→于500mL 的烧杯中,加水溶解(必要时可以温热,以加快溶解或加 200mL 温水)用玻棒搅拌均匀→配成500mL溶液(每两人配一份)
②0.005mol/L EDTA 溶液的标定:
准确称取0.15-0.20g CaCO3(100烧杯中)→少量水润湿,盖上表面皿→5mL1∶1HCl从杯嘴逐滴加入?至完全溶解→加热微沸?→定容至250mL → 移取25.00mL 钙标准溶液→加约25mL水和10mL10%NaOH及少许固体钙指示剂→用EDTA滴定至溶液由紫红色→蓝绿色为终点。
平行测定三份。
五、数据记录及处理
表一 标准溶液的配制

表二 EDTA溶液的标定
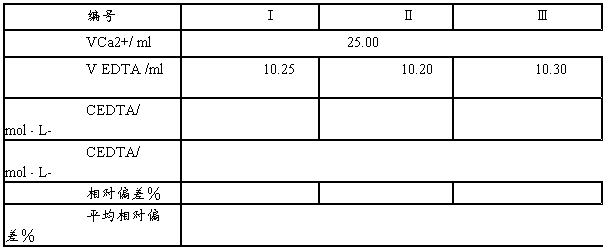
六、 思考题:
1. EDTA标准溶液和Zn、CaCO3标准溶液的制备方法有何不同?
2. 配位滴定中为什么要加入缓冲溶液?
