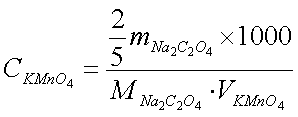实验:高锰酸钾标准溶液的配制和标定
一、实验目的
1、掌握高锰酸钾标准溶液的配制方法和保存条件;
2、掌握用草酸钠基准试剂标定高锰酸钾浓度的原理和方法;
二、实验原理
KMnO4 是氧化还原滴定中最常用的氧化剂之一。高锰酸钾滴定法通常在酸性溶液中进行,反应时锰的氧化数由+7变到+2。市售的KMnO4常含杂质,而且KMnO4易与水中的还原性物质发生反应,光线和MnO (OH)2等都能促进 KMnO4的分解,因此配制KMnO4溶液时要保持微沸1小时或在暗处放置数天,待 KMnO4把还原性杂质充分氧化后,过滤除去杂质,保存于棕色甁中,标定其准确浓度。
Na2C2O4是标定 KMnO4 常用的基准物质,其反应如下:
5C2O42- + 2MnO4- + 16H+ = 10CO2 + 2Mn2+ + 8H2O (1)
反应要在酸性、较高温度和有Mn2+ 作催化剂的条件下进行。滴定初期,反应很慢,KMnO4 溶液必须逐滴加入,如滴加过快,部分KMnO4 在热溶液中将按下式分解而造成误差:
4KMnO4 + 2H2SO4 = 4MnO2 + 2K2SO4 + 2H2O + 3O2 (2)
在滴定过程中逐渐生成的 Mn2+ 有催化作用,结果使反应速率逐渐加快。
因为KMnO4溶液本身具有特殊的紫红色,极易察觉,故用它作为滴定剂时,不需要另加指示剂。
三、实验仪器与试剂
试 剂:高锰酸钾(AR);草酸钠(基准试剂);3 mol/L硫酸溶液、1mol/L MnSO4、
仪 器:酸式滴定管、500mL棕色试剂瓶、50mL量筒、10mL量筒、25mL移液管、1mL吸量管、250mL锥形瓶、250mL容量瓶、电子天平、水浴锅、电炉、玻璃砂芯漏斗。
四、实验步骤
1、0.02 mol·L-1KMnO4溶液的配制
在托盘天平上称取高锰酸钾约1.7g于烧杯中,加入适量蒸馏水煮沸加热溶解后倒入洁净的500mL棕色试剂瓶中,用水稀释至500 mL,摇匀,塞好,静止7~10d后将上层清液用玻璃砂芯漏斗过滤,残余溶液和沉淀倒掉,把试剂瓶洗净,将滤液倒回试剂瓶,摇匀,待标定。
如果将称取的高锰酸钾溶于大烧杯中,加500mL水,盖上表面皿,加热至沸,保持微沸状态1小时,则不必长期放置,冷却后用玻璃砂芯漏斗过滤除去二氧化锰的杂质后,将溶液储于500mL棕色试剂瓶可直接用于标定。
2、KMnO4浓度的标定
精确称取 0.15~0.20g预先干燥过的 Na2C2O4 三份,分别置于250 mL锥形甁中,各加入 40mL 蒸馏水和 10 mL3 mol·L-1H2SO4使其溶解,水浴慢慢加热直到锥形瓶口有蒸气冒出 (约75~85℃)。趁热用待标定的 KMnO4溶液进行滴定。开始滴定时,速度宜慢,在第一滴 KMnO4 溶液滴人后,不断摇动溶液,当紫红色褪去后再滴入第二滴。待溶液中有Mn2+产生后,反应速率加快,滴定速度也就可适当加快,但也决不可使KMnO4溶液连续流下(为了使反应加快,可以先在高锰酸钾溶液中加一、两滴1mol/L MnSO4)。近终点时,应减慢滴定速度同时充分摇匀。 最后滴加半滴 KMnO4溶液,在摇匀后半分钟内仍保持微红色不褪,表明己达到终点。记下最终读数并计算KMnO4溶液的浓度及相对平均偏差。
五、数据记录与处理

六、思考题
1、配制KMnO4标准溶液为什么要煮沸,并放置一周后过滤?能否用滤纸过滤?
2、滴定KMnO4标准溶液时,为什么第一滴KMnO4溶液加入后红色褪去很慢,以后褪色较快?
第二篇:实验六高锰酸钾标准溶液的配制和标定
分析化学实验报告
实验六:高锰酸钾标准溶液的配制和标定
班级: 姓名: 日期:
Ⅰ、实验目的
1、 学会KMnO4标准溶液的配制和标定方法。
2、 学会用基准物质Na2C2O4标定KMnO4的原理和方法。
3、 了解用KMnO4作为自身指示剂的特点和终点判断方法。
Ⅱ、实验原理
市售的KMnO4固体试剂中常含有少量MnO2和其他杂质,而且蒸馏水中也常似有微量还原性物质也可以与KMnO4反应,故不能用直接法配制。
标定KMnO4溶液常用的基准物质是Na2C2O4。原理:
2 MnO4-+5 C2O42-+16H+====2Mn2++10CO2↑+8H2O
反应达化学计量点时,微过量的KMnO4使溶液呈粉红色即为终点。
Ⅲ、实验仪器与试剂
分析天平、托盘天平、电炉、酸式滴定管、锥形瓶。
KMnO4、Na2C2O4、H2SO4溶液
Ⅳ、实验内容与步骤
1.配制0.02mol/L溶液:
2.标定KMnO4标准溶液
3.数据记录
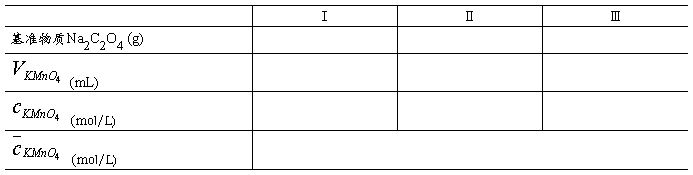
4.计算