分析化学实验报告
实验六:高锰酸钾标准溶液的配制和标定
班级: 姓名: 日期:
Ⅰ、实验目的
1、 学会KMnO4标准溶液的配制和标定方法。
2、 学会用基准物质Na2C2O4标定KMnO4的原理和方法。
3、 了解用KMnO4作为自身指示剂的特点和终点判断方法。
Ⅱ、实验原理
市售的KMnO4固体试剂中常含有少量MnO2和其他杂质,而且蒸馏水中也常似有微量还原性物质也可以与KMnO4反应,故不能用直接法配制。
标定KMnO4溶液常用的基准物质是Na2C2O4。原理:
2 MnO4-+5 C2O42-+16H+====2Mn2++10CO2↑+8H2O
反应达化学计量点时,微过量的KMnO4使溶液呈粉红色即为终点。
Ⅲ、实验仪器与试剂
分析天平、托盘天平、电炉、酸式滴定管、锥形瓶。
KMnO4、Na2C2O4、H2SO4溶液
Ⅳ、实验内容与步骤
1.配制0.02mol/L溶液:
2.标定KMnO4标准溶液
3.数据记录
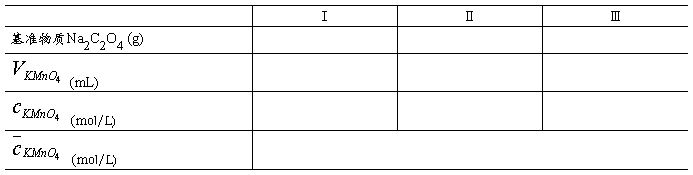
4.计算
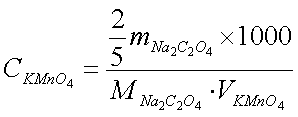
第二篇:COD的测定(高锰酸钾法和重铬酸钾法)-高锰酸钾标准溶液配制标定及注意事项
环境监测中化学需氧量(COD)的测定
一、水体污染
地球上大约有13.9亿立方千米的水,其中97.2%在海洋中,2.15%是冰山和冰川,人们可以利用的淡水只约占0.65%。人类就是依靠这些水来维持生命和从事生产的。在这些天然水中含有K+、Na+、Ca2+、Mg2+、Cl-、SO42-、HCO3-、CO32- 等离子。如果使不属于水体的物质进入水体,而且进入的数量已经达到破坏水体原有用途的程度,就叫水污染。
造成水污染的原因是多方面的。根据污染源可分为城市生活废水污染、工业废水污染、农田流水污染(喷洒的农药、施用的化肥被雨水冲刷流入水体)、固体废物污染(工业废渣中的有毒物质,经水溶解后进入水体)及工业烟尘废气污染(烟尘废气落入水体或被雨水淋洗流入水体)等。
污染水体的物质一般可分为以下几类:
1.无机污染物:包括酸、碱、无机盐等。
2.有机污染物:包括碳水化合物、脂肪、蛋白质、碳氢化合物、合成洗涤剂等。
3.有毒物质:包括重金属(铅、铬、汞、镉等)盐类、氰化物、氟化物、砷化物、酚类、多环芳烃、多氯联苯、有机农药等。
4.致病微生物:包括各种病毒、细菌、原生物等。
5.耗氧污染物:有些有机物和无机物,能消耗水中溶解的氧气,使水发黑变臭,危害水生生物的生存。
6.植物营养物质:有些物质中含有植物生长所需要的氮、磷、钾等营养元素(如含磷洗衣粉、化肥、饲料等),这些物质能促使水中藻类疯长,从而消耗水中的氧气,危害鱼类的生长,造成水质恶化。
此外,还有石油工业带来的油污染、热电厂造成的热污染、核电厂带来的放射性污染等,不仅污染水体,危及水生动物,还会危害人体健康。
二.化学需氧量(Chemical Oxygen Demand,COD)
化学需氧量(COD)是水体质量的控制项目之一,它是量度水中还原性污染物的重要指标。水中还原性物质包括有机物和亚硝酸盐、硫化物、亚铁盐等无机物。水体中能被氧化的物质在规定条件下进行化学氧化过程中所消耗氧化剂的量,换算成以O2作为氧化剂时1L水样所消耗O2的质量(mg/L),通常记为COD。在COD测定过程中,有机物被氧化成二氧化碳和水。水中各种有机物进行化学氧化反应的难易程度是不同的,因此化学需氧量只表示在规定条件下,水中可被氧化物质的需氧量的总和。化学需氧量反映了水中受还原性物质污染的程度。COD的数值越大,则水体污染越严重。一般洁净饮用水的COD值为几至十几mg/L。
当前测定化学需氧量常用的方法有KMnO4和KCr2O7法,前者用于测定较清洁的水样,后者用于污染严重的水样和工业废水。同一水样用上述两种方法测定的结果是不同的,因此在报告化学需氧量的测定结果时要注明测定方法。
1. 高锰酸钾(KMnO4)指数
高锰酸钾指数是反应水体中有机及无机可氧化物质污染的常用指标,它是在一定条件下,用高锰酸钾氧化水中的的某些有机物及无机还原性物质,由消耗的高锰酸钾量计算相当的氧量,表示单位为氧的毫克/升(O2,mg/L)。
高锰酸盐指数在以往的水质监测分析中,亦有被称为化学需氧量的高锰酸钾法。但是,由于这种方法在规定条件下,水中有机物只能部分被氧化,并不是理论上的需氧量,也不是反映水体中总有机物含量的尺度,因此,用高锰酸盐指数这一术语作为水质的一项指标,以有别于重铬酸钾法的化学需氧量,更符合于客观实际。使用KMnO4测定水中需氧有机物,一般只适用于需氧有机物含量较低的天然水体,我国按水质从高到低,将地面水环境的质量标准分成Ⅰ~Ⅴ5类,其中的高锰酸盐指数、CODCr和与此相关的每升水中所含溶解氧的量(mg/L)三项参数标准,如下表所示:

按测定溶液的介质不同,分为酸性高锰酸钾法和碱性高锰酸钾法。因为在碱性条件下高锰酸钾的氧化能力比酸性条件下稍弱,此时不能氧化水中的氯离子,故常用于测定含氯离子浓度较高的水样。
1 耗氧量
1.1 CODMn法(酸性高锰酸钾滴定法)
1.1.1 范围
本标准规定了用酸性高锰酸钾滴定法测定生活饮用水及水其源水中的耗氧量。
本法适用于氯化物质量浓度低于300 mg/L(以Cl-计)的生活饮用水及其水源水中耗氧量的测定。
本法最低检测质量浓度(取100 mL水样)为0.05 mg/L,最高可测定耗氧量为5.0 mg/L(以O2计)若取50 mL水样测定,最低检测质量浓度为1.0 mg/L
1.1.2 原理
高锰酸钾在酸性溶液中将还原性物质氧化,过量的高锰酸钾用草酸还原。根据高锰酸钾消耗量表示耗氧量(以O2计)。
2MnO4-+5C2O42-+16H+= Mn2++8H2O+10CO2↑
(2KMnO4+5H2C2O4+3H2SO4=K2SO4+MnSO4+8H2O+10CO2)
1.1.3 仪器
电恒温水浴锅(可调至100℃)
锥形瓶,100mL。
滴定管。
1.1.4 试剂
1.1.4.1 硫酸溶液(1+3):将1体积硫酸(ρ20=1.84 g/mL)在水浴冷却下缓缓加到3体积纯水中,煮沸,滴加高锰酸钾溶液至溶液保持微红色。
1.1.4.2 草酸钠标准储备溶液[c(1/2Na2C2O4)=0.1000 mol/L]:称取6.701 g草酸钠(Na2C2O4),溶于少量纯水中,并于1000 mL容量瓶中用纯水定容。置暗处保存。
1.1.4.3 高锰酸钾溶液[c(1/2KMnO4)=0.1000 mol/L]:称取3.3 g草酸钠(KMnO4),溶于少量纯水中,并稀释至1000 mL。煮沸15min,静置2W,定容至1000 mL。(煮沸时水分蒸发,使溶液浓度升高)然后用玻璃砂芯漏斗过滤至棕色瓶中,置暗处保存并按下述方法标定浓度:
1.1.4.3.1 吸取25.00 mL草酸钠溶液于250 mL锥形瓶中,加入75 mL新煮沸放冷却的纯水及2.5 mL硫酸(ρ20=1.84 g/mL)。
1.1.4.3.2 迅速自滴定管中加入约24 mL高锰酸钾溶液,待褪色后加热至65℃,再继续滴定呈微红色并保持30 s不褪。当滴定终了时,溶液温度不低于55℃。记录高锰酸钾溶液用量。
高锰酸钾溶液的浓度计算见式(1):
 0.1000×25.00
(1)
0.1000×25.00
(1)
V
式中:
c(1/5KMnO4)—高锰酸钾溶液的浓度,单位mol/L;
V—高锰酸钾溶液的用量,单位mL;
1.1.4.3.3 校正高锰酸钾溶液的浓度c(1/5KMnO4)为0.1000mol/L。
1.1.4.4高锰酸钾标准溶液[c(1/5KMnO4)=0.01000 mol/L]:高锰酸钾溶液准确稀释10倍。
1.1.4.5草酸钠标准使用溶液[c(1/2Na2C2O4)=0.01000 mol/L]:将草酸钠标准储备液准确稀释10倍。
1.1.5 分析步骤
1.1.5.1 锥形瓶的预处理:向250 mL锥形瓶加入1 mL硫酸溶液(1+3)及少量高锰酸钾标准溶液。煮沸数分钟,取下锥形瓶用草酸钠标准使用溶液(1.1.4.5)
滴定至微红色,溶液弃去。
1.1.5.2 吸取100 mL充分混匀的水样(若水样中有机物含量较高,可取适量水样以纯水稀释至100 mL),置于上述处理过的锥形瓶中。加入5 mL硫酸溶液(1+3)。用滴定管加入10.00 mL高锰酸钾标准溶液(1.1.4.4)。
1.1.5.3 将锥形瓶放入沸腾的水浴中,准确放置30 min。如加热过程中红色明显减褪,需将水样稀释重做。
1.1.5.4 取下锥形瓶趁热加入10.00mL草酸钠标准使用溶液(1.1.4.5),充分振摇,使红色褪尽。
1.1.5.5 于白色背景上,自滴定管滴入高锰酸钾标准溶液(1.1.4.4)至溶液呈微红色即为终点,记录用量V1(mL)。
注:测定时如水样消耗的高锰酸钾标准溶液超过了加入量的一半,由于高锰酸钾的浓度过低影响了氧化能力,使测定结果偏低。遇此情况,应取少量样品稀释后重做。
1.1.5.6 向滴定终点的水样中趁热()加入10.00mL草酸钠溶液(1.1.4.5),立即用高锰酸钾标准溶液(1.1.4.4)滴定至微红色,记录用量V2(mL)。如高锰酸钾的物质的量浓度为准确的0.0100 mol/L,滴定时用量应为10.00 mL,否则可求一校正系数(K),计算见式(2)
 10
(2)
10
(2)
V2
1.1.5.7 如水样用纯水稀释,则另取100 mL纯水,同上述步骤滴定,记录高锰酸钾标准溶液消耗量V0(mL)。
1.1.6 计算
耗氧量浓度的计算式见(3)
 [ (10+V1 )×K-10]×c×8×1000
(3)
[ (10+V1 )×K-10]×c×8×1000
(3)
V
=[(10+V1 )×K-10]×c×0.8
如水样用纯水稀释,则采用式(4)计算水样的耗氧量:
 {[(10+V1 )×K-10]-[(10+V0)K-10]×R×c×8×1000
(4)
{[(10+V1 )×K-10]-[(10+V0)K-10]×R×c×8×1000
(4)
V0
式中:
R—水样稀释时,纯水在100 mL体积内所占的比例值{例如:25 mL水样用纯水稀释至100 mL,则

 100-25
100-25
100
ρ—耗氧量的浓度,单位mg/L;
c—高锰酸钾标准溶液的浓度,mol/L;
8—与1.00 mL高锰酸钾标准溶液[c(Na2EDTA)=0.01mol/L]相当的以mg表示氧的质量;
V3—水样体积,单位mL;
V0,K,V1 分别见步骤1.1.5.5、1.1.5.6和1.1.5.7;
1.2 CODMn法(碱性高锰酸钾滴定法)
1.2.1 范围
本标准规定了用碱性高锰酸钾滴定法测定生活饮用水及水其源水中的耗氧量。
本法适用于氯化物质量浓度低于300 mg/L(以Cl—计)的生活饮用水及其水源水中耗氧量的测定。
本法最低检测质量浓度(取100mL水样)为0.05 mg/L,最高可测定耗氧量为5.0 mg/L(以O2计)。
1.2.2 原理
高锰酸钾在碱性溶液中将还原性物质氧化,酸化后过量高锰酸钾用草酸钠溶液滴定。
1.2.3 仪器
电恒温水浴锅(可调至100℃)
锥形瓶,100mL。
滴定管。
1.2.4 试剂
氢氧化钠溶液(500 g/L):称取50 g氢氧化钠(NaOH),溶于纯水中,稀释至100 mL。
其他试剂见1.1.4.1、1.1.4.2、1.1.4.3
1.2.5 分析步骤
滴定至微红色,溶液弃去。
1.2.5.1 吸取100 mL于250 mL处理过的锥形瓶(处理方法见1.1.5.1)加入0.5 mL氢氧化钠溶液及10.00 mL高锰酸钾标准溶液(1.1.4.4)。
1.2.5.2 于沸腾水中准确加热30 min。
1.2.5.3 取下锥形瓶趁热加入5 mL硫酸溶液(1+3)及10.00mL草酸钠标准使用溶液(1.1.4.5),摇振均匀值红色褪尽。
1.2.5.4 自滴定管滴入高锰酸钾标准溶液(1.1.4.4)至微红色即为终点,记录用量V1(mL)。
1.2.5.5 按1.1.5.6计算高锰酸钾标准溶液的校正系数。
1.2.5.6 如水样须纯水稀释后测定,按1.1.5.7计算100 mL纯水的耗氧量,记录高锰酸钾标准溶液的消耗量V0。
1.2.6 计算
见1.1.6
酸性法测定高锰酸盐指数时的误差主要来源于高锰酸钾溶液的不稳定性,浓度标定不准确引入的误差和测定条件的酸度、温度控制不当影响反应引入的误差。因此,要消除误差,获得一个相对的准确测定值,必须要解决好以下几点:
1. 配制较稳定0.1mol/L的高锰酸钾溶液。
2. 准确标定0.1mol/L的KMnO4溶液的浓度。
3. 严格控制测定条件,使结果准确可靠。
高锰酸盐指数是一个相对的条件性指标,其测定结果与所用蒸馏水的纯度、溶液的酸度、高锰酸盐浓度、加热温度和时间有关。因此,测定时必须严格遵守操作规定,使结果具可比性。操作步骤应按《水和废水分析方法》(第4版)的规定进行。应注意以下几个问题:
(1) 配置CODMn试剂要求用新鲜的蒸馏水,最好用重蒸水(不含还原性物质的水即:将1L蒸馏水置于全玻璃蒸馏器中,加入10 mL硫酸和少量高锰酸钾溶液,蒸馏。弃去100mL初溜液,余下溜出液贮于具玻璃塞的细口瓶中。)或超纯水,而不能用去离子水。因为去离子水中含有微量树脂浸出物和树脂崩解微粒,不宜用于配置有机物质分析的试液。离子交换处理能除去原水中绝大部分盐类、碱和游离酸,但不能完全除去有机物。如果用含有有机物的去离子水配置CODMn试液,在做水样时其本底值会偏高,影响对样品水的测定。(2)应先标定好0.1mol/L KMnO4(1/5KMnO4)准确浓度,再根据稀释公式把浓度调节到0.01000—0.009600mol/L范围内,以减小误差。
(2) 应先标定好0.1mol/L KMnO4(1/5KMnO4)准确浓度,再根据稀释公式把浓度调节到0.01000—0.009600mol/L范围内,以减小误差
(3) 加入10.00 mL的0.01 mol/LKMnO4和0.01mol/L Na2C2O4时均应用滴定管加药,这样既快又准。
(4) 加热的时间应从水浴开始沸腾时计时,时间为30±2min,时间要卡准。加热时间短,测定结果偏低,加热时间长了将导致测定结果偏高。
总之,要消除酸性法测定高锰酸盐指数时的误差,必须应用符合标准的纯水,要配制和保存好草酸钠和高锰酸钾标准溶液,准确进行标定,严格控制测定条件。只有这样,才能获得一个相对的准确测定值。
2. 重铬酸钾法(K2Cr2O7) CODCr
采用重铬酸钾(K2Cr2O7)作为氧化剂测定出的化学耗氧量表示为CODcr.化学耗氧量可以反映水体受还原性物质污染的程度。水中还原性物质包括有机物、亚硝酸盐、亚铁盐、硫化物等。重铬酸钾能够比较完全地氧化水中的有机物,如它对低碳直链化合物的氧化率为80~90%,因此CODcr能够比较完全地表示水中有机物的含量。此外,CODcr测定需时较短,不受水质限制,因此现已作为监测工业废水污染的指标。
我国关于工业废水最高容许排放浓度(mg/L)规定如下:

2 重铬酸钾法(CODCr法)
2.1 原理
是在水样中加如一定量的重铬酸钾和催化剂硫酸银,在强酸性介质中加热回流一定时间,部分重铬酸钾被水样中可氧化物质还原,用硫酸亚铁铵滴定剩余的重铬酸钾,根据消耗重铬酸钾的量计算COD的值…
2.2 范围
本方法测定COD的范围为50—500mg/L。对于化学需氧量小于50mg/L的水样,应改用0.0250mol/L重铬酸钾标准溶液。回滴时用0.01mol/L硫酸亚铁铵标准溶液。对于COD大于500mg/L的水样应稀释后再来测定。
2.3 仪器
2.3.1 500mL全玻璃回流装置.
2.3.2 加热装置(电炉).
2.3.3 25mL或50mL酸式滴定管,锥形瓶,移液管,容量瓶等.
2.4 步骤
2.4.1 试剂
1 重铬酸钾标准溶液(c(1/6K2Cr2O7)=0.2500mol/L)
2 试亚铁灵指示液
3 硫酸亚铁铵标准溶液[c(NH4)2Fe(SO4)2·6H2O≈0.1mol/L](使用前标定)
4 硫酸硫酸银溶液
2.4.2 测定步骤
2.4.2.1 硫酸亚铁铵标定[c(NH4)2Fe(SO4)2·6H2O≈0.1mol/L]:准确吸取10.00 mL重铬酸钾标准溶液于250 mL锥形瓶中,加水稀释至110 mL左右,缓慢加入10 mL浓硫酸,摇匀.冷却后,加入3滴试亚铁灵指示液(约0.15mL),用硫酸亚铁铵溶液滴定,溶液的颜色由黄色经蓝绿色至红褐色即为终点.
2.4.2.2 测定
取20mL水样,加入10mL的重铬酸钾,插上回流装置,再加入30mL硫酸硫酸银,加热回流 2h,冷却后,用90.00mL水冲洗冷凝管壁,取下锥形瓶. 溶液再度冷却后,加3滴试亚铁灵指示液,用硫酸亚铁铵标准溶液滴定,溶液的颜色由黄色经蓝绿色至红褐色即为终点,记录硫酸亚铁铵标准溶液的用量.
测定水样的同时,取20.00mL重蒸馏水,按同样操作步骤作空白实验.记录滴定空白时硫酸亚铁铵标准溶液的用量.
2.5 计算
CODCr(O2,mg/L)=8×1000(V0-V1)·C/V
注意1、使用0.4g硫酸汞络合氯离子的最高量可达40mg,如取用20.00mL水样,即最高可络合2000mg/L氯离子浓度的水样。若氯离子的浓度较低,也可少加硫酸汞,使保持硫酸汞:氯离子=10:1(W/W)。若出现少量氯化汞沉淀,并不影响测定。[HgSO4+4Cl-→HgCl4-+SO42-]
注意2、水样加热回流后,溶液中重铬酸钾剩余量应为加入量的1/5—4/5为宜。
注意3、用邻苯二甲酸氢钾标准溶液检查试剂的质量和操作技术时,由于每克邻苯二甲酸氢钾的理论CODCr为1.176g,所以溶解0.4251g邻苯二甲酸氢钾(HOOCC6H4COOK)于重蒸馏水中,转入1000mL容量瓶,用重蒸馏水稀释至标线,使之成为500mg/L的CODcr标准溶液。用时新配。
注意4、CODCr的测定结果应保留三位有效数字。
注意5、每次实验时,应对硫酸亚铁铵标准滴定溶液进行标定,室温较高时尤其注意其浓度的变化。
高锰酸钾标准溶液配制与标定
实验原理
由于高锰酸钾性质不稳定,容易分解,不容易得到很纯的试剂,所以必须用间接法配制标准溶液,一般在制备高锰酸钾标准溶液时,需加热近沸约30min,以充分氧化水中的有机杂质,并静置过夜,再除去生成的沉淀,同时保存在棕色小口瓶中避免光照,以保持溶液浓度相对稳定,不致迅速氧化。然后再用基准物质标定其准确浓度。
标定高锰酸钾溶液的基准物质有 H2C2O4·2H2O、FeSO4·7H2O、(NH4)2SO4·6H2O、As2O3和纯铁丝等。由于前两者较易纯化,所以在标定高锰酸钾时经常采用。
本实验采用Na2C2O4标定预先配好的浓度近0.02mol/L KMnO4溶液,两者反应方程式如下:
2KMnO4+8H2SO4+5NaC2O4=2MnSO4+10CO2↑+5Na2SO4+2K2SO4+8H2O
[2MnO4- +5C2O42-+16H+ == 2Mn2+ + 10CO2↑+8H2O]
直接称取一定质量的Na2C2O4,用少量蒸馏水溶解后,以待标定的高锰酸钾溶液滴定至终点,按如下计算式计算高锰酸钾溶液的准确浓度:
2×m(Na2C2O4)×1000
c(KMnO4)= -----------------------------------------------
5×M(Na2C2O4)×V(KMnO4)
式中c(KMnO4) ----- 高锰酸钾的准确浓度(mol/L);
m(Na2C2O4) ----- 所称草酸钠的质量(g)
M(Na2C2O4) ----- 所称草酸钠的摩尔质量(g/mol)134 g/mol
V(KMnO4) ----- 所用高锰酸钾的体积(ml)
仪器及试剂
分析天平、酸式滴定管、锥形瓶、量筒。
KMnO4、草酸钠(分析纯)、3 mol/L H2SO4等;
分析步骤
0.02mol/L的高锰酸钾标准溶液的配制:称取1.58g高锰酸钾,加少量水溶解,定容至500 mL,盖上表面皿,煮沸15 min(1 h),冷却后于暗处静置2周(2-3天),经砂芯漏斗过滤,储存于具玻璃塞的棕色玻璃瓶内,{过滤后的溶液不允许与纸、橡皮或其他有机物质接触}
标定
称取0.13g-0.15g预先经105℃干燥1h的草酸钠三份置于150 mL锥形瓶中,加40 mL蒸馏水,10mL 3 mol/L H2SO4溶液〔硫酸溶液预先煮沸10~15min,并冷却至(27±3)℃〕,摇动至草酸钠溶解,慢慢加热,直到有蒸汽冒出(75-85℃)。趁热用待标定的KMnO4溶液进行滴定,开始时,速度要慢,滴入第一滴溶液后,不断摇动锥形瓶,使溶液充分混合反应,当紫红色褪去后再滴入第二滴。当溶液中有Mn2+(催化剂)产生后,反应速度会加快,滴定速度也可随之加快,接近终点时,紫红色退去很慢,此时,应该减慢滴定速度,同时充分摇匀。最后滴加半滴KMnO4溶液摇匀后30s内不褪色即为达到终点。记下读数。计算KMnO4溶液的准确浓度。再将浓度调节到0.02 mol/L。
数据记录

为了配制较稳定的KMnO4溶液,常采用下列措施:
1. 称取1.58g的KMnO4,溶解在不含还原性物质的蒸馏水中并稀释至500mL。
2. 将配制好的KMnO4溶液于90~95℃水浴中加热两小时,然后在暗处放置2~3d,使溶液中可能存在的还原性物质完全氧化。
3. 倾出清夜,贮存于棕色试剂瓶中并存放于暗处,以待标定。
为了能使此反应定量的迅速进行,应控制好以下条件:
1. 温度控制:反应温度70~80℃。温度超过90℃,H2C2O4部分分解导致标定结果偏高。温度过低反应速度太慢,水浴锅中的水不要开,液面上有白汽为宜。同时要保证沸水浴的水面要高于锥形瓶内的液面。
2. 酸度控制:滴定应在一定酸度的H2SO4介质中进行,一般滴定开始时,溶液[H+]应为0.5~1mol/L左右,滴定终了时应为0.2~0.5mol/L左右。酸度过低,MnO4- 会部分被还原成MnO2;酸度过高会促进H2C2O4分解,使测定结果偏高。
3. 滴定速度:滴定时开始速度一定要慢,第一滴高锰酸钾褪色很慢。滴定时应待第一滴KMnO4红色褪去之后再滴入第二滴[会出现棕色浑浊现象],若滴定速度过快,在热的酸性溶液中,滴入的KMnO4来不及和C2O42-反应而发生分解:4MnO4-+12H+====4Mn2++5O2↑+6H2O导致标定结果偏低。待滴入KMnO4反应生成Mn2+作为催化剂时,滴定才逐渐加快。但在近终点时应小心慢加。
4. 滴定终点KMnO4不太稳定,这是由于空气中还原性气体及尘埃等杂质使MnO4-缓慢分解,粉红色消失,所以保持30 s不退色即可认为已经到达滴定终点。
注意:
1. KMnO4颜色较深,读数时应以液面的上沿最高线为准。
2. 滴定过程中锥形瓶不烫手了说明温度过低,应拿到水浴中再次加热。
3. 出现棕色浑浊现象说明实验失败,要重新称量草酸钠。
4. 高锰酸钾易反应,衣物会染色,应注意。
思考题
1. 配制KMnO4标准溶液时,为什么要将KMnO4溶液煮沸一定时间并放置数天?配好的KMnO4溶液为什么要过滤后才能保存?过滤时是否可以用滤纸?
答:KMnO4试剂中常含有少量MnO2和其它杂质(如硝酸盐、硫酸盐或氯化物等),KMnO4的氧化能力强,易和水中的有机物,空气中的尘埃及氨等还原性物质作用,并能自行分解 [蒸馏水中常含有微量还原性物质它们能慢慢地使KMnO4还原为MnO(OH)2沉淀。另外因MnO2或MnO(OH)2又能进一步促进KMnO4溶液分解]。因此,配制KMnO4标准溶液时,要将KMnO4溶液煮沸一定时间并放置数天,让还原性物质完全反应后并用微孔玻璃漏斗过滤,滤取MnO2或MnO(OH)2沉淀后保存棕色瓶中。过滤时不可以用滤纸,因为滤纸有还原性。
2. 配制好的KMnO4溶液为什么要盛放在棕色瓶中保护?如果没有棕色瓶怎么办?
答:因Mn2+和MnO2的存在能使KMnO4分解,见光分解更快。所以.配制好的KMnO4溶液要盛放在棕色瓶中保存。如果没有棕色瓶,应放在避光处保存。
3. 在滴定时,KMnO4溶液为什么要放在酸式滴定管中?
答:因为KMnO4溶液具有氧化性,能使碱式滴定管下端的橡皮管氧化。所以,滴定时KMnO4溶液要放在酸式滴定管中。
4. 用Na2C2O4标定KMnO4时候,为什么必须在H2SO4介质中进行?酸度过高或过低有何影响?可以用HNO3或HCl调节酸度吗?为什么要加热到70~80℃?溶液温度过高或过低有何影响?
答:因若用HCl调酸度时,Cl-具有还原性,会与KMnO4反应。若用HNO3调酸度时,HNO3具有氧化性。所以只能在H2SO4介质中进行。滴定必须在强酸性溶液中进行,若酸度过低KMnO4与被滴定物作用生成褐色的MnO(OH)2沉淀,反应不能按一定的计量关系进行。在室温下,KMnO4与Na2C2O4之间的反应速度慢,故须将溶液加热到70~80℃,但温度不能超过90℃,否则Na2C2O4分解。
5. 标定KMnO4溶液时,为什么第一滴KMnO4加入后溶液的红色褪去很慢,而以后红色褪去越来越快?
答:因KMnO4与Na2C2O4的反应速度较慢,第一滴KMnO4加入后,由于溶液中没有Mn2+,反应速度慢,红色褪去很慢,随着滴定的进行,溶液中Mn2+的浓度不断增大,由于Mn2+的催化作用,反应速度越来越快,红色褪去也就越来越快。
6. 盛放KMnO4溶液的烧杯或锥形瓶等容器放置较久后,其壁上常有棕色沉淀物,是什么?此棕色沉淀物用通常方法不容易洗净,应怎样洗涤才能除去此沉淀?
答:棕色沉淀物为MnO2和MnO(OH)2,此沉淀物可以用酸性草酸或盐酸羟胺洗涤液洗涤。过滤后玻璃砂漏斗及烧杯上沾有MnO2,要用硫酸/草酸过饱和溶液洗(注意不要烧手、废液要回收)。
