物质的量
1阿伏加德罗常数(NA)
⑴定义:①单位物质的量的物质所含有粒子数。
②12g碳—12中所含碳原子数为阿伏加德罗常数。
⑵根据实验测得其数值为6.02×1023(近似值),单位为mol-1.,表达式为NA=N/n
2 物质的量(n)
⑴定义:表示含有一定数目粒子的集合体的物理量。
⑵研究对象:分子、原子、离子、质子、中子、电子等。
⑶单位为mol
3 摩尔质量(M)
⑴定义:单位物质的量的物质的质量叫做物质的额摩尔质量。
⑵表达式为M=m/n,单位是g·mol-1.,其数值上等于该微粒的相对分子质量或相对原子质量。 4 气体摩尔体积(Vm)
⑴定义:一定条件下,单位物质的量气体所占的体积。
⑵表达式为Vm=V/n,其单位为L·mol-1。
⑶Vm与压强、温度有关。标准状况下(0°C 101KPa),任何气体Vm≈22.4 L·mol-1 非标准状况下(25°C 101KPa),Vm≈24.8 L·mol-1
提示:物质的体积,指一定量物质在一定条件下所占据空间的大小。从微观角度分析,物质的体积的大小决定因素有:①物质所含微粒数的多少;②物质微粒间距离的大小;③物质微粒本身的大小。 所以对于固体和液体的体积主要取决于①③两个因素,而气体的体积主要取决于气体分子间的距离,在谈气体的摩尔体积时必须讲到温度和压强。
5 阿伏加德罗定律及其推论
⑴ 定律:在相同温度和压强下,相同体积的任何气体都含有相同数目的分子。
⑵ 推论:理想气态方程:PV=nRT(R为常数)
①同温、同压下:V1/V2=n1/n2=N1/N2
②同温、同压下:p1/p2=M1/M2=D
③同温、同体积下: P1/P2=n1/n2=N1/N2
④同温、同压、同体积下:m1/m2=M1/M2
⑤同温、同压、同质量下:V1/V2=M2/M1
⑥同温、同体积、同质量下:P1/P2=M2/M1
⑶气体摩尔质量的求法
①已知标注状况下气体密度p,则M=22.4p(p单位为g/L)
②已知非标准状况下T、P、p,则M=m RT/PV=p RT/P
③已知相同条件下两种气体的密度:p1/p2=M1/M2=D
④混合气体的平均式量,在数值上等于混合气体的平均摩尔质量
Mr=
Mr=
⑤对于化学反应a A=xB(g)+yC(g)+zD(g)所得混合气体的平均式量Mr=a·mA/(x+y+z)
⑥十字交叉法(常用于混合气体平均分子量组成,混合烃平均分子式,用组成同位素原子百分含量,溶液的配置,很何物的反应等)
6 物质的量浓度
⑴定义:单位体积溶液中所含溶质B的物质的量,称为溶质的物质的量浓度,用CB表示。 ⑵定义式:CB=n/V ,单位:mol·L-1
⑶式中的V指溶液的体积,不是溶剂的体积,其单位为升(L),不能用毫升(mL)。 ⑷溶液的体积不具有加和性(除同浓度的同溶质的溶液的相加)
⑸物质的量浓度与质量分数的关系:C=1000p·w﹪/M
⑹物质的量浓度与溶解度的关系:C=1000p·S/M(S+100)
⑺标准状况下,气体溶于水后所得溶液的物质的量浓度计算:C=1000p·V气/M V气+22400V水 ⑻溶液稀释或浓缩的计算:C(浓)·V(浓)=C(稀)·V(稀)
⑼等体积或等质量溶液混合时质量分数的变化规律
浓度与密度的变化关系
若溶液的密度大于1g·cm-3,则溶液的质量分数越大,其密度就越大。
若溶液的密度小于1g·cm-3,则溶液的质量分数越大,其密度就越小。
常见溶液中,氨水、酒精等溶液比水轻,氯化钠、硝酸、硫酸等溶液比水重。
变化规律
① 等质量混合型
无论溶液的密度大于1g·cm-3,还是小于1g·cm-3,等质量混合时,得混合溶液的质量分数都等于它们和的一半。
② 等体积混合型
两种不同质量分数的溶液等体积相混合,若溶液的密度大于1g·cm-3,则混合溶液质量分数大于它们和的一半;若溶液的密度小于1g·cm-3,则混合溶液质量分数小于它们和的一半。
若加等体积水稀释,求算稀释后的质量分数,可把水视作0﹪的溶液,按上述规律处理。 7以物质的量为中心的各化学量的相互关系
8 一定物质的量浓度溶液的配置(容量瓶常见规格25ml,50ml, 100ml,250ml,500ml,1000ml ...) ⑴原理:CB=n/V
⑵仪器:①溶质为固体-药匙、托盘天平(砝码)、量筒、烧杯、玻璃棒、胶头滴管、容量瓶 ②溶质为液体-滴定管、烧杯、玻璃棒、胶头滴管、容量瓶
⑶步骤:计算、称量量取、溶解、转移、洗涤、定容、摇匀、装瓶
第二篇:物质的量总结(重要)
《物质的量》知识点总结
一、有关概念
1.物质的量
(1)概念:表示物质所含微粒数目多少的物理量
(2)符号: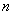
(3)单位:mol
2.摩尔
(1)概念:摩尔是物质的量的单位,每1mol物质含有阿伏加德罗常数个结构微粒。
(2)符号:mol
(3)说明:①当描述物质的物质的量(使用摩尔)时,必须指明物质微粒的名称,不能是宏观物质名称
②常见的微观粒子有:分子、原子、离子、电子、质子、中子或它们特定的组合
③当有些物质的微观粒子只有一种时,可以省略其名称
3.阿伏加德罗常数
(1)含义:实验测定12g12C中碳原子的个数
(2)符号:NA
(3)单位:个/mol
(4)说明:①NA的基准是12g碳-12中的原子个数
②12C不仅是摩尔的基准对象,而且还是相对原子质量的基准
③NA是一个实验值,现阶段常取6.02×1023作计算
④要注意NA与6.02×1023的区别
4.摩尔质量
(1)概念:单位物质的量的物质的质量
(2)符号: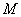
(3)单位:g·mol-1
(4)说明:①使用范围:A.任何一种微观粒子
B.无论是否纯净
C.无论物质的状态
②与式量的比较:
③与1mol物质的质量的比较:
5.气体摩尔体积
(1)概念:单位物质的量的气体的体积
(2)符号:
(3)单位:L·mol-1
(4)标准状况下的气体摩尔体积
①标准状况:0℃、1atm即1.01×105Pa
②理想气体:A.不计大小但计质量
B.不计分子间的相互作用
③标准状况下的气体摩尔体积:约22.4L·mol-1
(5)影响物质体积大小的因素:
①构成物质的微粒的大小(物质的本性)
②结构微粒之间距离的大小(温度与压强来共同决定)
③结构微粒的多少(物质的量的大小)
6.物质的量浓度
(1)概念:用单位体积的溶液中溶解溶质的物质的量的多少来表示溶液的浓度
(2)符号:
(3)单位:mol·L-1
(4)说明:①物质的量浓度是溶液的体积浓度
②溶液中的溶质既可以为纯净物又可以为混合物,还可以是指某种离子或分子
二、有关计算关系
1. m、n、N之间的计算关系
(1)计算关系: =
=
(2)使用范围:只要物质的组成不变,无论是何状态都可以使用
2.V、n、N之间的计算关系
(1)计算关系: =
= =
=
(2)使用范围:①适用于所有的气体,无论是纯净气体还是混合气体
②当气体摩尔体积用22.4L·mol-1时必须是标准状况
3.c、m、V、N之间的计算关系
(1)计算关系:
(2)使用范围:①以上计算关系必须是在溶液中使用
②微粒数目是指某种溶质
③若溶液是由气体溶解于水形成的,要特别注意以下几点:
A.必须根据定义表达式进行计算
B.氨水中的溶质主要是NH3·H2O,但要以NH3为准计算
C.溶液的体积不能直接用气体的体积或水的体积或气体与水的体积之和,而必须是通过 计算得到
计算得到
4.c、 %、ρ之间的计算关系
%、ρ之间的计算关系
(1)计算关系:
(2)使用范围:同一种溶液的质量分数与物质的量浓度之间的换算
(3)推断方法:①根据物质的量浓度的定义表达式
②溶质的物质的量用 计算
计算
③注意溶液体积的单位
5. 混合气体的平均分子量的有关计算
(1)计算依据:①1mol任何物质的质量(以g为单位)在数值上与其式量相等
②1mol任何气体的体积(以L为单位)在数值上与气体摩尔体积(以L·mol-1为单位)相等
(2)基本计算关系: M
(3)变换计算关系:①M =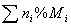 ②M =
②M =
(4)使用说明: ①(2)的计算式适用于所有的混合物的计算
②(3)中的计算式只适用与混合气体的有关计算
③(3)中的两个计算式之间应用了阿伏加德罗定律
6.密度与相对密度
(1)密度
①计算表达式:
②使用说明:A.适用于所有的物质,不受物质状态的限制,也适用于所有的混合物
B.所有物质: ,标准状况下气体
,标准状况下气体
(2)相对密度
①计算表达式:
②使用说明:
A.相对密度是在同温同压下两种气体的密度之比
B.既可以用于纯净气体之间的计算,也可以用于混合气体之间
有关规律
1.阿伏加德罗定律及其推论
(1)标准状况下的气体摩尔体积
①标准状况是指:0℃和1.01×105Pa
②标准状况下1mol任何气体的体积都约为22.4L
(2)气体摩尔体积
①温度和压强一定时,1mol任何气体的体积都约为一个定值
②说明了温度和压强以及气体的物质的量共同决定了气体的体积,而气体分子本身的大小对气体体积的影响很小
③气体摩尔体积比标准状况下气体摩尔体积的范围广
(3)阿伏加德罗定律
①阿伏加德罗定律:同温同压下相同体积的任何气体都具有相同的分子数
②阿伏加德罗定律依然是忽略了气体分子本身的大小
③阿伏加德罗定律比气体摩尔体积的应用更为广泛:
A.主要是应用于不同气体之间的比较,也可以同一种气体的比较
B.被比较的气体既可以是纯净气体又可以是混合气体
(4)克拉珀珑方程
①克拉珀珑方程又称为理想气体的状态方程,它同样忽略了气体分子本身的大小
②克拉珀珑方程:
③克拉珀珑方程的变形:
④克拉珀珑方程比阿伏加得罗定律更准确的描述了气体的压强、体积、物质的量和温度之间的关系,其应用范围更广:
A.可以做单一气体的计算
B.可以做不同气体的比较计算
C.计算以及比较计算的条件还可以不同
(5)阿伏加德罗定律的重要的四个推论
①压强之比
A.算式推导:
B.语言表达:同温同体积时,任何气体的压强之比都等于其物质的量之比,也等于其分子数之比
②体积之比
A.算式推导:
B.语言表达:同温同压时,任何气体的体积之比都等于其物质的量之比,也等于其分子数之比
③质量之比
A.算式推导:
B.语言表达:同温同压同体积时,任何气体的质量之比都等于其摩尔质量之比,也就是其式量之比
④密度之比
A.算式推导:①
②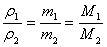
B.语言表达:①A.相同质量的任何气体的密度之比都等于其体积的反比
B.同温同压下等质量的任何气体的密度之比都等于
其物质的量的反比,也就是其分子个数之比
②A.同体积的任何气体的密度之比都等于其质量之比
B.同温同压同体积时,任何气体的密度之比都等于其摩尔质量之比,也就是其式量之比
