2 单位:g/mol kg/mol 第三节 化学中常用的物理量
—物质的量
3 数值上与相对原子(分子)质
量相等,但单位不一样,故不能说摩尔质量就是相对原子 ⑴ 物质的量是一个物理量,其单
(分子)质量 位是摩尔(mol)
m
一 物质的量及其单位——摩尔
⑵“物质的量”四个字是一个整
体不可分割或插入其他字
⑶ 物质的量是联系宏观物质和微观粒子的桥梁 1 使用摩尔时的注意事项 ⑴ 摩尔的计量对象是微观粒子不可计量宏观物质 例:1mol小米(×) ⑵ 要用元素符号或名称点明具体微粒 例 1mol氢 (×)1molH (√)1molH2(√)1mol氢原子(√)1mol氢分子(√) 2 阿伏加德罗常数 符号 NA ⑴ 1mol粒子所含粒子数=阿伏加德罗常数=12g12
C所含C原子的数=NA=6.02×1023mol-1 ⑵ 1mol任何物质所含原子数目为NA (×) ⑶ 物质的量(n) 微粒数(N)和NA 间的关系 N n = ——— N A
二 摩尔质量
1 定义:单位物质的量的物质所具有的质量
4公式 n = ———
M
三 气体的摩尔体积 1 影响物质体积的因素 ⑴所含粒子数目
⑵ 所含粒子大小 ⑶ 粒子间的间隔
固体取决于⑴,⑵ 气体取决于⑴,⑶
而⑶取决于T,P 2 概念: 标况下,1mol任何气体的体积约为22.4L,且注意22.4L
这一数值三个应用条件:
⑴标况 ⑵气体 ⑶1mol
3 推论⑴ 同温同压下,任何气体
的摩尔体积相等 推论⑵同温同压下,
ρ1/ρ2=M1/M2(依据ρ=M/Vm)
推论⑶同温同压下,气体 V1/V2=n1/n2(依据公式n=V/Vm)
4 计算公式 n=V/Vm(注意应用条件)
四 物质的量浓度
1 容量瓶:
⑴ 构造:瓶口配有磨口玻璃塞
或塑料塞,细颈梨形的平底玻璃瓶。
⑵ 特点:容量瓶上标有温度和
容积,瓶上只有一道刻度线。 ⑶ 使用注意事项:
A 使用前注意是否漏水。
B 溶解或稀释的操作不能在容量瓶中进行。
C 不能存放溶液或进行化学反应。
D 只能选择与配制溶液的体积与容量瓶容积相同的容量瓶。
⑷ 用途:
用来配制一定体积浓度准确
的溶液。 2.一定体积溶液的配制步骤:
计算→称量→溶解→冷却→转移→洗涤→定容→摇匀(装瓶帖签) 3.仪器:天平(量筒).玻璃棒、
烧杯、容量瓶 、胶头滴管(莫忘)
4.误差分析:依据公式CB=nB/V液
⑴ 天平的砝码沾有其他物质或
已生锈蚀 (nB↑ , CB↑) ⑵ 砝码有残缺 (nB↓ , CB↓) ⑶ 试剂和砝码左右位置颠倒并
已使用游码 (nB↓ , CB↓) ⑷ 用于稀释,溶解溶液的烧杯
未用蒸馏水洗涤 (nB↓ , CB↓)
⑸ 转移或搅拌液体时,有部分液体溅出(nB↓ , CB↓)
⑹ 溶解的溶液未冷却至室温就转移至容量瓶(V液↓ , CB↑) ⑺ 定容时仰视容量瓶(V液↑ , CB↓)
定容时俯视容量瓶 (V液↓ ,
CB↑)
⑻ 定容摇匀后,发现瓶颈处液面低于刻度线又向容量瓶中加水至刻度线(V液↑ , CB↓)
5 物质的量浓度
⑴ 定义:单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量
⑵ 表达式:CB=nB/V液
⑶ 单位:mol/l 或 mol/m3
6 有关物质的量浓度的计算: ⑴ 溶液中溶质的质量分数与物
质的量浓度的换算
物质的量浓度=(1000ρ.a%)/M ρ表示溶液的密度、a%表示溶质
的质量分数、M表示溶质的摩尔质量
⑵ 有关溶液的稀释和浓缩的计
算
C1V1 = C2V2(溶质的物质的量不
变)
⑶ 有关两种不同浓度溶液混合的计算
C3V3 = C1V1 + C2V2
(混合前后溶质的物质的量总和不变)
⑷ 有关溶质的计算
写出方程式,根据上下一致列比例、计算(化学反应中各物质的物质的量的比等于化学计量系数之比)
第二篇:物质的量总结
化学计量在实验中的应用——物质的量
一、知识网络:
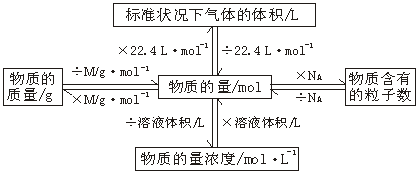
二、基本公式:
(1) 物质的量与微粒个数的关系:n=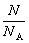
(2) 物质的量与质量的关系: n=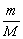 M=
M= m=M·n
m=M·n
(3) 气体物质的量与体积的关系:n=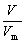 n=
n=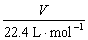 (标准状况) Vm =
(标准状况) Vm =  V=
V=
(4) 物质的量浓度:c=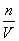 n=c·V
n=c·V
(5) 溶液物质的量浓度与质量分数的关系: c =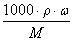 (密度的单位:g/cm3 ) n=
(密度的单位:g/cm3 ) n=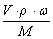
(6) 溶液稀释: c1V1=c2V2
三、物质的量的相关知识和概念:
1、物质的量:是表示大量粒子集体的一个物理量,符号为n,单位是摩尔(mol)。
2、摩尔:是物质的量的单位;
国际上规定, 1摩尔粒子集体所含的粒子数与0.012 kg C中所含的碳原子数相同,约为6.02×1023
3、阿伏加德罗常数:1摩尔的任何粒子的粒子数,即1摩尔粒子数的准确值,用符号NA表示,NA的近似值为6.02×1023mol-1。
计算公式:n=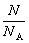
4、使用摩尔这个单位时要注意:①使用范围,只能用于微观(原子、离子等),不适用于宏观
②使用时应该用化学式指明粒子的种类,而不使用该粒子的中文名称。
5、物质的量与物质质量的关系:
1任何粒子或物质的质量以克为单位,其数值都与该粒子的相对原子质量或相对分子质量相等。
6、摩尔质量:单位物质的量的物质所具有的质量叫做~ ,用符号M表示,单位是g.mol-1。
计算公式:M=
注意:摩尔质量与相对分子质量、相对原子质量的关系:摩尔质量以g?mol-1为单位,数值上与相对分子质量或相对原子质量相等,相对原子质量或相对分子质量无单位。
7、气体摩尔体积:单位物质的量的气体所具有的体积叫做~ ,用符号Vm表示,单位是L.mol-1。
计算公式:Vm =  此概念要具备的要点:①必须是气体(可以是混合气体)②要看气体的状况
此概念要具备的要点:①必须是气体(可以是混合气体)②要看气体的状况
例如:①气体(可以是混合气体)②在标准状况下 ③物质的量为1mol ④则体积约为22.4L。
如果是气体但不在标准状况下,物质的量即使是1mol,体积也不等于22.4L。
8、阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同数目的分子。(T、p恒定时:V1/V2=n1/n2=N1/N2)
9、阿伏加德罗定律推论: PV=nRT
(1)T、p恒定时:V1/V2=n1/n2=N1/N2 (2)T、p恒定时:ρ1/ρ2=M1/M2
(3)T、p、V恒定时:m1/m2=M1/M2 (4)T、p、m恒定时:V1/V2=M2/M1
(5)T、V恒定时:p1/p2=n1/n2=N1/N2 (6)T、V、m恒定时:p1/p2=M2/M1
10、决定物质体积的三因素:
(1)微粒(分子)的数目;(2)微粒(分子)本身的大小;(3)微粒与微粒之间的距离。
A、对于固体和液体,由于他们的分子是紧密堆积的,所以他们分子之间的距离视为零。
决定固体和液体体积的因素:微粒的数目和微粒本身的大小
B、对于气体,分子之间的距离很远,分子的直径(本身的大小)与分子之间的距离比起来是很小很小的,所以分子的直径(本身的大小)可视为零。
决定气体体积的因素:微粒的数目和微粒之间的距离
11、物质的量浓度:表示单位体积溶液里所含溶质B的物质的量。符号cB ,单位: mol?L-1
12、溶液的稀释:溶液稀释的总原则:溶质的量不变
对于质量分数的溶液:溶质的质量不变,m1W1==m2W2
对于物质的量溶液:溶质的物质的量不变,c1V1==c2V2
13、物质的量浓度c与质量分数W之间的关系:c ==1000ρW/M (密度的单位:g/cm3 )
14、一定物质的量浓度溶液的配制:容量瓶
(1)步骤:计算、称量(量取)、溶解、冷却、移液、洗涤、定容、摇匀、装入试剂瓶备用。
(2)误差分析:A、仰视、俯视 B、未冷却
●习题训练
1、下列关于物质的量的叙述,错误的是( )
A.1 mol任何物质都含有6.02×1023个分子 B.0.012 kg 12C中含有约6.02×1023个C
C.1 mol水中含有2 mol氢原子和1 mol氧原子 D.1 mol Ne中含有6.02×1024个电子
2、对于物质的量相同的硫酸和磷酸,下列说法不正确的是( )
A.分子个数相等 B.含有的氧原子数相等 C.含有的氢原子数相等 D.质量相等
3、科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列
说法不正确的是( )
A.该原子的摩尔质量是aNA B.Wg该原子的物质的量一定是 
C.Wg该原子中含有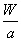 个该原子 D.由已知信息可得:
个该原子 D.由已知信息可得: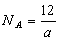
4、若某原子的摩尔质量是 g·mol-1,则一个该原子的真实质量是( )
g·mol-1,则一个该原子的真实质量是( )
A. g B.
g B.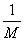 g C.
g C.
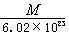 g D.
g D.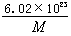 g
g
5、若50滴水正好是 mL,则1滴水所含的分子数是( )
mL,则1滴水所含的分子数是( )
A. ×50×18×6.02×1023 B.
×50×18×6.02×1023 B.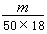 ×6.02×1023
×6.02×1023
C.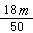 ×6.02×1023 D.
×6.02×1023 D.
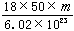
6、n g O2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( )
A.32m/n B.16m/n C.n/32m D.n/16m
7、已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A.16g B.32g C.64g /mol D.32g /mol
8、与标准状况下V L CO2所含氧原子数目相同的水的质量是( )
A.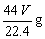 B.
B.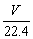 g C.
g C.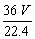 g D.
g D.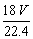 g
g
9、NA为阿伏加德罗常数,下列叙述正确的是( )
A..40 g NH4NO3中含有氮原子NA个 B.标准状况下,22.4 L H2和N2的混合气体中,H2和N2分子数之和为2NA
C.标准状况下,22.4 L CCl4所含分子数为NA D.在Fe与Cl2反应中,1 mol Fe与1 mol Cl2恰好反应
10、已知m g气体A和n g气体B所含分子数相等,下列说法不正确的是( )
A.标准状况时,相同体积的气体A和气体B的质量之比为m∶n
B.25 ℃时,相同质量的气体A和气体B的分子数之比为n∶m
C.同温、同压下,气体A和气体B的密度之比为n∶m
D.通常状况下,相同质量的气体A和气体B的体积之比为n∶m
11、在一个密闭容器中盛有11 g X气体(X的摩尔质量为44 g·mol-1)时,压强为1×104 Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104 Pa,这时容器内气体X的分子数约为( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
12、在相同状况下,质量为Wg的测量瓶,充满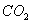 后称量其质量为124.4g;改为充满氧气时其质量为123.2g;改
后称量其质量为124.4g;改为充满氧气时其质量为123.2g;改
为充满气体X,其质量为122.8g,则充入的可能为( ) A.CO B.NO C.SO2 D.CH4
13、同温同压下的两个体积相同的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶中的气体一定具有相同的( )
A.质量 B.原子总数 C.碳原子数 D.密度
14、在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.cba D.abcd
15、将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为( )
A.1 mol·L-1 B.0.1 mol·L-1 C.0.01 mol·L-1 D.10 mol·L-1
16、取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( ) A.0.21 mol·L-1 B.0.56 mol·L-1 C.0.42 mol·L-1 D.0.26 mol·L-1
17、相同体积的Na2SO4、MgSO4、Al2(SO4)3溶液分别加入过量的BaCl2溶液,得到沉淀的物质的量之比为1∶1∶3,这三种溶液的物质的量浓度之比为( )
A.2∶2∶3 B.1∶1∶3 C.1∶1∶1 D.3∶3∶1
18、向密度为d g·cm-3的盐酸中逐滴加入硝酸银溶液到过量,生成沉淀的质量与原盐酸的质量相等,原盐酸的物质的量浓度为( ) A.25.4d mol·L-1 B.12.7d mol·L-1 C.6.97d mol·L-1 D.6.35d mol·L-1
19、将标准状况下的a L氨气溶于1000 g水中,得到氨水的密度为b g·cm-3,则该氨水的物质的量浓度为( )
A.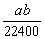 mol·L-1 B.
mol·L-1 B.  mol·L-1 C.
mol·L-1 C.  mol·L-1 D.
mol·L-1 D. 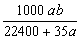 mol·L-1
mol·L-1
20、将质量分数为2 w,物质的量浓度为c1的H2SO4溶液加水稀释,使质量分数变为w,物质的量浓度变为c2,则c1和c2之间关系正确的是
A.c1>2c2 B.c2=2c1 C.c1<2c2 D.c1=2c2
21、设NA为阿伏加德罗常数。下列关于0.2 mol ·L-1 Ba(NO3)2溶液的说法不正确的是(忽略水的电离)( )
A.1 L溶液中含阴、阳离子总数是0.6 NA B.500 mL溶液中Ba2+的浓度是0.2 mol·L-1
C.500 mL溶液中NO-3的浓度是0.4 mol·L-1 D.1 L溶液中含有0.2 NA个NO-3
22、将a g锌加到V L c mol·L-1的盐酸中,共放出n L氢气(标准状况下),则被还原的HCl的物质的量是( )
A. mol B.
mol B.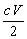 ×10-3 mol C.
×10-3 mol C.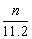 mol D. cV mol
mol D. cV mol
23、配制100 mL 1 mol·L-1氢氧化钠溶液,下列操作错误的是( )
A.在托盘天平上放两片大小、质量一样的纸,然后将氢氧化钠放在纸片上进行称量
B.把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,到离刻度线2~3 cm时改用胶头滴管滴加,直到溶液凹面恰好与刻度相切
24、在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是( )
A.用量筒量取浓盐酸时俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
25、配制500 mL 1 mol·L-1 NaCl溶液时,下列操作会使实验结果偏高的是______________,偏低的是______________,无影响的是______________。
A.振荡、摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未用游码)
C.原容量瓶洗涤后未干燥
D.移液时,未洗涤烧杯和玻璃棒
E.定容时,俯视刻度线
