载体,其考查内容涉及了化学基本概念和基本理论、元素化合物甚至化学实验等多方面的知识。解答阿伏加德罗常数试题注意的问题:
(1)状态问题,(2)特别物质的摩尔质量,如D2O、T2O等。(3)某些物质分子中的原子个数,如Ne、O3、白磷等。(4)一些物质中的化学键数目,如SiO2、Si、CH4、P4、石墨等。 (5)较复杂的化学反应中,转移电子数的求算,如Na2O2十H2O;Cl2十NaOH;电解电解质溶液等。 (6)某些离子或原子团在水溶液中能发生水解反应,使其数目减少。 例1、(历年高考试题总结)判断下列说法的正误:
1、常温常压下,氧气和臭氧的混合物16g中约含有6.02×O个氧原子 2、标准状况下,22.4L单质溴所含有的原子数目为2NA 3、 1molCH3+(碳正离子)中含有电子数为10 NA 4、12.4g白磷中含有磷原子数为0.4 NA 5、 9g重水所含有的电子数为5 NA
6、58.5 g氯化钠固体中含有NA个氯化钠分子
7、7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2 NA 8、46 g NO2 和 N2O4混合气体中含有原子数为3NA
9、1L 1mol/L醋酸溶液中离子总数为2NA
10、1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 11、常温常压下,4g氦气所含有的中子数目为4NA
12、电解食盐水若产生2g 氢气,则转移的电子数目为2NA
13、室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023 14、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA 15、30g甲醛中含共用电子对总数为4×6.02×10

23
23
16、标准状况下,11.2 L SO3所含的分子数为0.5 NA 17、100 mL2.0 mol/ L的盐酸与醋酸溶液中氢离子数均为0.2NA 18、标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA 19、20g重水(D2O)中含有的电子数为10 NA
20、等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3 21、标准状况下,22.4LCHCl3中含有氯原子数目为3NA
22、标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA 23、7gCnH2n中含有的氢原子数目为NA
2-
24、1 L0.5mol/LNa2CO3 溶液中含有的CO3数目为0.5NA 25、2.24LCO2中含有的原子数为0.3 ×6.02×1023
26、0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023 27、5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×10 28、4.5 SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023 29、1 mol Cl2与足量Fe反应,转移的电子数为3 NA 30、1.5 mol NO2与足量H2O反应,转移的电子数为NA
31、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA 32、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10 NA
33、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% 34、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 35、标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA 36、1molFeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA 37、106克Na2CO3固体中含有NA个CO32-
38、1molNa2O2与足量水蒸气反应转移电子数为2NA
答案:1、4、8、10、12、13、14、15、19、20、23、28、30、34、37 链接高考二:阿伏加德罗定律及其推论的应用
例2、在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是 B
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的
量少 C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相
对分子质量小
例3、在三个密闭容器中分别充入Ne、H2、O2三种气体,当他们的温度和密度都相同时,
这三种气体的压强(p)由大到小的顺序是 D A、p(Ne)>p(H2) >p(O2) B、p(O2) >p(Ne)>p(H2) C、p(H2)>p(O2) >p(Ne ) D、p(H2)>p(Ne)>p(O2) 链接高考三:有关物质的量浓度与溶解度、质量分数的换算
例4、有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,
23
则有关该溶液的说法不正确的是 C
A.溶质的质量分数是24.0% B.溶液的物质的量浓度是2.4 mol/L C.溶质和溶剂的物质的量之比是1∶40 D.硫酸根离子的质量分数是19.2% 链接高考四: 有关物质的量及物质的量浓度的综合计算题 例5:一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000 mol·L-1
的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O, 所需NaOH溶液的体积恰好为KMnO4
-1
溶液的3倍,则KMnO4溶液的浓度(mol·L)为 B
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
例6、某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是 BD
50 mL盐酸 50 mL盐酸 50 mL盐酸 m(混合物) 9.2g 15.7g 27.6g V(CO2)(标况) 2.24L 3.36L 3.36L A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据不能计算混合物中NaHCO3的质量分数 C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应 反馈练习:
1、T℃时,容积可变的a、b两个密闭容器,a中通入1mol NO和1mol O2,b中通入2mol NO2,保持温度不变,1min后两容器中( B )
A.气体体积相等 B.压强相等 C.氧原子数相等 D.原子总数相等 2、设NA表示阿伏加德罗常数值,下列说法中正确的是( B )
A.1mol某气体的体积为22.4L,该气体的状况一定是标准状况
B.工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜小于0.5 NA C.1molCl2参加化学反应获得的电子数都是2NA
D.将1molNO2气体在降温后颜色变浅,但其所含的分子数仍然为NA
3、NA表示阿伏加德罗常数的值,下列有关叙述正确的是(D )
A.1 mol金属镁晶体中含有2NA个电子 B.1 mol石墨晶体中含有共价键数为3NA
C.1 mol Zn与足量的盐酸反应生成NA个氢分子,体积约为22.4L D.含有CH3COOH和CH3COONa的总物质的量为0.1mol的混合溶液中,CH3COOH分子数和和CH3COO-离子总个数为0.1NA
4、设NA代表阿伏加德罗常数数的值,下列说法中正确的是( A ) ①78 g过氧化钠固体中,阴阳离子总数为3 NA
②常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05 NA
116
③0.5 mol H2O中含有的中子数约为17 NA
④室温下,22.4 L CO和CO2的混合气体中含有的C原子数约为NA
⑤71 g氯气与足量的铁粉完全反应,转移的电子数为2 NA ⑥常温常压下,1mol氦气含有的核外电子数为4 NA
A.①②⑤ B.②③④ 5、下列说法正确的是( B )
C.①④⑥
23
D.②④⑤
A.标准状况下,11.2 L臭氧中含氧原子数为6.02×10
23
B.15 g乙烷所含极性共价键的数目为3×6.02×10
C.常温下,100 mL 0.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023
D.一定条件下,2 mol 二氧化硫和1 mol 氧气混合,反应时转移的电子数为4×6.02×1023
6、设为阿伏加德罗常数,下列有关叙述正确的是( B)
A.在熔融状态下,1molNaHSO4完全电离出的阳离子数目为2NA B.0.5 mol/LCuCl2溶液中含有的Cu2+离子数为0.5 NA
C.常温常压下,16gO2和O3的混合物中共含有NA个氧原子 D.1mol CH3CH2CH(CH3)2所含甲基个数为2NA
7、设NA表示阿伏加德罗常数,下列叙述中正确的是(C )
A.1 mol·L -1 Mg(NO3)2溶液中含有NO3-的数目为2NA
B.标准状况下,33.6 LH2O含有的H2O分子数为1.5NA
C.2.24L(标准状况)Cl2与足量Ca(OH)2在常温下反应,转移的电子数为0.1NA D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
8、下列条件下,两瓶气体所含原子数一定相等的是 AC A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H6 D.同压强、同体积的N2O和CO2 9、在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是 D A.两种气体的压强相等 C.两种气体的分子数目相等
B. O2比03的质量小
D.两种气体的氧原子数目相等
10、下列说法正确的是 C
A 含有相同氧原子数的SO2和CO的质量相等
B 等物质的量浓度的NaOH溶液与氨水中的c(OH-) 相等 C 乙酸分子与甲酸甲酯分子中的共价健数相等
D 等温等压下,3mol C2H2(g)和1mol C6H6(g)的密度相等
11、⑴将W g胆矾(CuSO4·5H2O)溶解在V mL水中,得到饱和溶液,测得该饱和溶液的
密度为ρ g/cm3,该溶液的物质的量浓度为 ,该温度下,CuSO4的溶解度为 。
3
⑵用98%(密度为1.84g/cm)的浓硫酸配制3 mol/L的稀硫酸100 mL。回答下列问题: ①需要用量筒量取浓硫酸 mL。②配制操作可分解成如下几步,正确的操作顺序是 。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌 F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)由于错误操作,使制得的稀硫酸溶液浓度偏小的是 (填写编号)。
A.用量筒量取一定液体时,俯视液面读数
B.使用容量瓶配制溶液时,俯视液面定容后所得溶液浓度
C.没有用蒸馏水洗涤烧杯2~3次, 并将溶液移入容量瓶中
D.容量瓶刚用蒸馏水洗净,没有烘干
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻
度线相切
F.把配制好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
答案:⑴1000ρW/[250(W+V)] mol/L;1600W/(9W+25V)g。⑵.16.3;ADECBHGF;ACEF
第二篇:4-阿伏伽德罗常数 物质的量 物质的量浓度
阿伏伽德罗常数物质的量物质的量浓度
【2012宝山一模】16. 氢气的摩尔质量为M g/mol,密度是ρ g/L,阿伏加德罗常数为NA,则下列表达正确的是(C )
A.单位体积中所含氢气分子数目为 B.单位质量中所含氢气分子数目为ρ NA
B.单位质量中所含氢气分子数目为ρ NA
C.单个氢气分子的质量为 g D.单个氢气分子占有的体积为
g D.单个氢气分子占有的体积为 L
L
【2012崇明一模】4、下列关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是 ( B )
A.物质的摩尔质量等于其相对分子(原子)质量
B.物质的量是一个基本的物理量,单位是摩尔
C.0.12kg12C中所含的碳原子数为阿佛加德常数
D.1mol任何物质中都含有阿佛加德常数个原子
【2012崇明一模】18、设NA表示阿伏加德罗常数,下列叙述中不正确的是 (CD )
A.室温下,1mol SO3含有的分子数为NA个
B.0.1molAl 离子含有核外电子数为NA个
离子含有核外电子数为NA个
C.1molCl2与1mol Fe反应,转移电子为3 NA个
D.标准状况下2.24L己烷含有分子数目为0.1 NA个
【2012奉贤一模】 12、科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2) 3的说法正确的是( B )
12、科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2) 3的说法正确的是( B )
A. 分子中四个氮原子共平面
B. 7.6 g N(NO2) 3和N2O3混合物中共含氮原子数为0.2NA
C. 标准状况下,2.24L N(NO2) 3含有的分子数为0.1NA
D、15.2g该物质含有0.6NA个非极性键
【2012虹口一模】6. 关于0.2 mol/L BaCl2溶液,下列说法中正确的是(NA为阿伏加德罗常数)
( B )
A. 该溶液中所含阴、阳离子离子总数是0.6 NA
B. 500 mL该溶液中所含Cl— 物质的量为0.2 mol
C. 从500 mL该溶液中取出50 mL,c(Ba2+)变为0.02 mol/L
D. 向100 mL该溶液中通入足量CO2气体,可生成3.94 g BaCO3沉淀
【2012静安一模】15. 设NA表示阿伏加德罗常数,下列说法中错误的是 (B )
A.常温常压下,22.4L氮气所含分子数小于NA个
B.1molCl2通入足量水中电子转移数为NA个
C.1molSiO2中含有4 molSi-O键
D.12g金刚石含有NA个碳原子
【2012静安一模】18.已知A物质的一个分子质量为Wg,氧元素的一种同位素16O的一个原子质量为bg;若以16O原子质量的 为相对原子质量的标准,以NA 表示阿伏加德罗常数,则关于A分子的相对质量M的计算式正确的是 ( AB )
为相对原子质量的标准,以NA 表示阿伏加德罗常数,则关于A分子的相对质量M的计算式正确的是 ( AB )
A M=WNA B.M= C.M=
C.M= D M=
D M=
【2012闵行一模】19.设NA是阿伏加德罗常数的数值,下列说法正确的是(AC)
A.常温下,46g NO2中含有氧原子个数为2NA
B.在标准状况下,22.4 L丙烷中所含C—H键数目为6NA
C.将58.5g NaCl溶于1 L水中,溶液中所含Na+和Cl-总数为2NA
D.以二氧化锰和浓盐酸为原料制备氯气,当生成1mol氯气,电子转移总数为4NA
【2012浦东新区一模】19.已知2Al+2NaOH+2H2O 2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)(AB )
2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)(AB )
A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA
B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA
C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA
D.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 NA
【2012普陀一模】8、用NA表示阿伏加德罗常数,下列叙述正确的是 (D)
A.5.6g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA
B.11.2 L 乙烯(标准状况)里含共用电子对数为NA
乙烯(标准状况)里含共用电子对数为NA
C.22.4L CO(g) 与l mol N2(g) 所含的电子数相等
D.100℃时1 L pH=6的纯水中OH- 离子数目为1×10-6 NA
【2012松江一模】13.常温下,把2.7g铝投入到一定量氢氧化钠溶液中,充分反应后,下列表示正确的是(NA为阿佛加德罗常数)(A)

【2012闸北一模】8.某氯原子的质量是a g ,12C原子的质量是bg ,用NA表示阿伏加德罗常数,下列说法中正确的是(B )
A.氯元素的相对原子质量为 12b/a
B.m g该氯原子的物质的量一定是m/(a NA) mol
C.氯元素的摩尔质量是aNA
D.n g该氯原子所含的电子数为17n/(a NA) 个
【2012闸北一模】19.设NA表示阿伏加德罗常数,下列说法正确的是 (AD)
A.在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA
B.1 mol/L NH4Cl溶液中,NH4+的数目小于NA
C.1mol苯乙烯中含有的碳碳双键数为4NA
D.2.8g乙烯与丙烯的混合物中含碳原子的数目为0.2 NA
【2013崇明一模】18.设NA为阿伏加德罗常数,下列叙述中正确的是 …………( BC )
A.同温同压下,原子数均为NA的氢气和氦气具有相同的体积
B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
C.常温常压下,1mol甲基( )所含的中子数和电子数分别为8NA、9NA
)所含的中子数和电子数分别为8NA、9NA
D.在密闭容器中加入28g N2和6g H2,在高温、高压、催化剂的条件下充分反应,
生成NH3的分子数为2NA
【2013黄浦一模】18.阿佛加德罗常数用NA表示,下列叙述正确的是( BC)
A.室温时,1LpH=2的NH4Cl溶液中水电离出10-12molH+
B.常温常压下,46gNO2含3NA个原子
C.1molLiAlH4在125℃完全分解成LiH、H2、Al,转移电子3NA
D.12g石墨含有4NA个自由移动的电子
【2013嘉定一模】21.设NA为阿伏加德罗常数,下列说法中正确的是(AD)
A.标准状况下,密度为d g/L的某气体纯净物一个分子的质量为g
B.常温常压下,17g甲基(—14CH3)所含的中子数为9NA
C.25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子
D.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子
【2013金山一模】13.NA表示阿伏加德岁常数,下列叙述正确的是(B)
A.1 mol苯乙烯中含有的碳碳双键数为4NA
B.6.2 g氧化钠晶体中含有0.2 NA个Na+
C.标准状况下,22.4L空气含有NA个单质分子
D.l mol/L NH4Cl溶液中,NH4+的数目小于NA
【2013闵行一模】17.某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿伏加德罗常数,下列说法中正确的是(B)
A.氧元素的相对原子质量为 B.1mol该氧原子质量为aNA g
B.1mol该氧原子质量为aNA g
C.x g该氧原子所含的电子数为 D.y g该氧原子的中子数一定为
D.y g该氧原子的中子数一定为
【2013普陀一模】10、常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( D )

【2013青浦一模】11.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是 ( D )
A.1 L 1 mol?L-1的HAc溶液中含有氢离子数约为6.02×1023
B.18 g D2O(重水)完全电解,转移的电子数约为6.02×1023
C.标态下,22.4L NO2气体,所含氧原子数约为2×6.02×1023
D.标态下,14g乙烯和丙烯的混合物中,含有共用电子对数目约为3×6.02×1023
【2013松江一模】12.如图,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)( C)
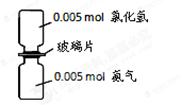 A.反应前气体反应物的总体积为0.224 L
A.反应前气体反应物的总体积为0.224 L
B.生成物的分子个数为0.005 NA
C.产物中的N-H键个数为0.02NA
D.加水溶解后所得溶液中NH4+数目为0.005 NA
【2013徐汇一模】19.已知2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2↑。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)(AB)
2NaAlO2 + 3H2↑。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)(AB)
A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA
B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA
C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA
D.溶液中每增加0.l mol的AlO2-,Na+的数目就增加0.l NA
【2013闸北一模】10. NA表示阿伏伽德罗常数,某氯气样品由37Cl2分子组成,下列说法正确的是(C)
A.37g该氯气样品含NA个氯气分子
B.11.2L该氯气样品质量是37g
C.37g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37ClO3,氧化剂和还原剂的质量之比为5:1
D.0.1NA个氯气分子溶于水形成1000mL溶液,溶液中c(Cl-)=0.2mol/L
【2013长宁一模】15.将标准状况下VL氯气通入过量的热烧碱溶液中充分反应,若产物中不含次氯酸钠,且反应中共转移了n个电子,则阿伏加德罗常数(NA)可表示为(A)
A. B.
B. C.
C. D.
D.
【2012奉贤二模】15. NA表示阿伏伽德罗常数,下列叙述错误的是(D)
A. 1 mol Cu和足量浓硝酸反应可收集的气体分子数小于2 NA
B. 4℃时,3.6 mL 重水所含的电子数小于2 NA
C. 1.45g熟石膏中的钙离子数目大于0.009 NA
D. 200 mL 0.5 mol·L-1的Na2CO3溶液:阴离子数目小于0.1 NA
【2012虹口二模】16. 设NA表示阿伏加德罗常数,下列说法正确的是(C)
A. 15.6 g Na2O2固体中含有的阴离子数目为0.4NA
B. 将1mol的Cl2通入足量的水中充分反应转移的电子数为NA
C. 标准状况下,11.2L氧气与臭氧混合气体中所含分子数为0.5NA
D. 在氯化铁溶液中,若Fe3+ 的数目为NA,则Cl—的数目肯定为3NA
【2012黄埔二模】19.常温常压下,一定量的甲烷在足量的氧气中完全燃烧生成9g水,该反应中有关物质的物理量描述正确的是(NA表示阿伏加德罗常数) (BD)
A.电子转移的物质的量为1 mol
B.断裂了1mol C-H键,转移的电子数目为2NA
C.有4gCH4参加反应,生成了5.6 L的CO2
D.1mol CH4 (g)和2molO2(g)的能量总和大于1mol CO2 (g)和2molH2O的能量总和
【2012卢湾二模】12.下列叙述中指定粒子数目一定大于NA的是(D)
A.11.2 L N2和NO的混合气体所含的原子数
B.12g 14C中所含的碳原子数
C.28g铁在反应中作还原剂时,失去电子的数目
D.1 L 0.1 mol·L-1 CH3COOH溶液中所含的分子总数
【2012浦东新区二模】19.右图是氨气与氯化氢反应的装置。抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)(C)

A.气体反应物的总体积为0.224 L
B.生成物的分子个数为0.005 NA
C.产物中的N-H键个数为0.02NA
D.加水溶解后所得溶液中NH4+数目为0.005 NA
【2012杨浦青浦静安宝山二模】12.设NA表示阿伏加德罗常数,则下列叙述正确的是(D)
A.1mol石墨含有的C-C键数为3NA
B.1mol 苯含有的C=C键数为3NA
C.1mol氯化铵含有的N-H键数为3NA
D.1 molNa2O2含有的共价键数为NA
【2012徐汇金山松江二模】8.设NA为阿伏加德罗常数的值。2mol N2和2mol C2H4相比较,下列叙述中一定正确的是(C)
A.体积相等 B.电子数均为14 NA C.质量相等 D.含共价键均为6 mol
【2012闸北二模】18.NA表示阿伏加德罗常数,下列叙述中正确的是 (BD)
A.标准状况下2.24L三氯甲烷含有分子数目为0.1 NA
B.标准状况下1.8 g H2O含有分子数目为0.1 NA
C.3.2 g硫与铜充分反应,电子转移总数为0.1NA
D.常温下,100mL 1mol/L的Na2CO3溶液中的阴离子数目大于0.1NA
【2012长宁二模】19.一定量NO2与0.5mol O2混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,发生反应的有关物质物理量的描述一定正确的是(NA表示阿伏加德罗常数)(BC)

【2013崇明二模】18.NA表示阿伏加德罗常数,下列判断正确的是………( CD )
A.60 g SiO2晶体中含有2 NA个Si-O键
B.0.17g NH3中含有的共用电子对数为0.1 NA
C.1 mol Cl2与足量Fe反应,转移电子数一定为2 NA
D.28 g丙烯、丁烯混合物完全燃烧需氧分子数为3 NA
【20##奉贤二模】7.16O和18O是氧元素的两种原子,NA表示阿伏伽德罗常数,下列说法正确的是(D)
A. 16O与18O互为同分异构体
B. 16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子
【2013黄浦二模】18.阿佛加德罗常数用NA表示,下列叙述正确的是(D)
A.室温时,0.1L 1mol·L-1的盐酸,溶液中水电离出的H+数为10-13NA
B.1L 0.2 mol·L-1MgSO4溶液中的阳离子数小于0.2NA
C.2.88g 中含有的电子数是0.18NA
中含有的电子数是0.18NA
D.常温常压下,3gHCHO和CH3COOH混合物中含有0.4NA个原子
【2013闵行二模】6.设NA为阿伏加德罗常数的值。下列说法正确是( A )
A.0.44g C3H8中含有的共价键总数目为0.1NA
B.标准状况下,2.24 L三氯甲烷中含有碳氯共价健的数目为0.3NA
C.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
D.1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA
【2013普陀二模】12、室温时在实验室里将1.12 L H2S(g)通入1L某浓度的烧碱溶液中,恰好完全反应,测得溶液的pH=10(体积变化忽略不计),正确的推断是(NA代表阿伏加德罗常数)(C)
A.硫化氢的分子数目约为0.05NA个 B.原烧碱溶液中约含溶质微粒0.1NA个
C.反应后溶液中约含OH- 1×10-4NA个 D.反应后溶液中约含S2- 0.05NA个
【2013闸北二模】11. Na2O2、Cl2和SO2均能使品红溶液褪色(NA为阿伏加德罗常数的值)。下列说法正确的是(B)
A.Na2O2、Cl2、SO2使品红溶液褪色的原理相同
B.标准状况下,1 mol Na2O2和22.4LCO2反应,转移电子数目为NA
C.等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快
D.在Na2O2中阴阳离子所含的电子数目相等
【2013长宁嘉定二模】15.下列叙述中指定粒子数目一定大于NA的是(C)
A.常温常压下,11.2LN2和NO的混合气体所含的原子数
B.1molCl2参加化学反应获得的电子数
C.1L1mol/LCH3COOH溶液中所含分子总数
D.28g铁在反应中作还原剂时,失去电子的数目
