化学计量在实验中的应用——物质的量
一、知识网络: 标准状况下气体的体积/L
×22.4 L·mol÷22.4 L·mol--1
物质物质的量/mo-1质量/M/g·mol -1÷M/g·mol ×NA÷NA物质的粒÷溶液体积/×溶液体积/L
物质的量浓度/mol二、基本公式:
(1) 物质的量与微粒个数的关系: n=N
NA
n=n(2) 物质的量与质量的关系: n=m M=mM m=M·n (标准状况) Vm = V
n(3) 气体物质的量与体积的关系:n=
V=m ρVVmV22.4 L?mol?1
(4) 物质的量浓度:c= n=c·V
1000?ρ??(5) 溶液物质的量浓度与质量分数的关系: c =(密度的单位:g/cm3 ) M V?ρ??nVn=M
(6) 溶液稀释: c1V1=c2V2
三、物质的量的相关知识和概念:
1、物质的量:是表示大量粒子集体的一个物理量,符号为n,单位是摩尔(mol)。
2、摩尔:是物质的量的单位;
国际上规定, 1摩尔粒子集体所含的粒子数与0.012 kg C中所含的碳原子数相同,约为6.02×1023
3、阿伏加德罗常数:1摩尔的任何粒子的粒子数,即1摩尔粒子数的准确值,用符号NA表示,NA的近似值为6.02×1023mol-1。
计算公式:n=N
NA
4、使用摩尔这个单位时要注意:①使用范围,只能用于微观(原子、离子等),不适用于宏观
②使用时应该用化学式指明粒子的种类,而不使用该粒子的中文名称。
5、物质的量与物质质量的关系:任何粒子或物质的质量以克为单位,其数值都与该粒子的相对原子质量或相对分子质量相等。
计算公式:M=m n注意:摩尔质量与相对分子质量、相对原子质量的关系:摩尔质量以g?mol-1为单位,数值上与相对分子质量或相对原子质量相等,相对原子质量或相对分子质量无单位。
7、气体摩尔体积:单位物质的量的气体所具有的体积叫做~ ,用符号Vm表示,单位是L.mol-1。
计算公式:Vm = V
n 此概念要具备的要点:①必须是气体(可以是混合气体)②要
看气体的状况
例如:①气体(可以是混合气体)②在标准状况下 ③物质的量为1mol ④则体积约为22.4L。 如果是气体但不在标准状况下,物质的量即使是1mol,体积也不等于22.4L。
8、阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同数目的分子。(T、p恒定时:V1/V2=n1/n2=N1/N2)
9、阿伏加德罗定律推论: PV=nRT
(1)T、p恒定时:V1/V2=n1/n2=N1/N2 (2)T、p恒定时:ρ1/ρ2=M1/M2
(3)T、p、V恒定时:m1/m2=M1/M2 (4)T、p、m恒定时:V1/V2=M2/M1
(5)T、V恒定时:p1/p2=n1/n2=N1/N2 (6)T、V、m恒定时:p1/p2=M2/M1
10、决定物质体积的三因素:
(1)微粒(分子)的数目;(2)微粒(分子)本身的大小;(3)微粒与微粒之间的距离。
A、对于固体和液体,由于他们的分子是紧密堆积的,所以他们分子之间的距离视为零。
决定固体和液体体积的因素:微粒的数目和微粒本身的大小
B、对于气体,分子之间的距离很远,分子的直径(本身的大小)与分子之间的距离比起来是很小很小的,所以分子的直径(本身的大小)可视为零。
决定气体体积的因素:微粒的数目和微粒之间的距离
11、物质的量浓度:表示单位体积溶液里所含溶质B的物质的量。符号cB ,单位: mol?L-1
12、溶液的稀释:溶液稀释的总原则:溶质的量不变
对于质量分数的溶液:溶质的质量不变,m1W1==m2W2
对于物质的量溶液:溶质的物质的量不变,c1V1==c2V2
13、物质的量浓度c与质量分数W之间的关系:c ==1000ρW/M (密度的单位:g/cm3 )
14、一定物质的量浓度溶液的配制:容量瓶
(1)步骤:计算、称量(量取)、溶解、冷却、移液、洗涤、定容、摇匀、装入试剂瓶备用。(2)误差分析:A、仰视、俯视 B、未冷却
●习题训练
1、下列关于物质的量的叙述,错误的是( )
C.1 mol水中含有2 mol氢原子和1 mol氧原子 D.1 mol Ne中含有6.02×1024个电子
2、对于物质的量相同的硫酸和磷酸,下列说法不正确的是( )
A.分子个数相等 B.含有的氧原子数相等 C.含有的氢原子数相等 D.质量相等
3、科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列 说法正确的是( )
A.该原子的摩尔质量是aNA B.Wg该原子的物质的量一定是 Wmol aNA
C.Wg该原子中含有W12 个该原子 D.由已知信息可得:
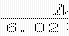
NA? aa
-4、若某原子的摩尔质量是Mg·mol1,则一个该原子的真实质量是( )
A.Mg B.1g C.Mg D.g
5、若50滴水正好是mmL,则1滴水所含的分子数是( )

A.m×50×18×6.02×1023 B.
C.×6.02×1023 D.×6.02×1023
6、n g O2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( B )
A.32m/n B.16m/n C.n/32m D.n/16m
7、已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( D )
A.16g B.32g C.64g /mol D.32g /mol
8、与标准状况下V L CO2所含氧原子数目相同的水的质量是( )
44 VV36 V18 VA.B. g C. g D. g g 22.422.422.422.4
9、NA为阿伏加德罗常数,下列叙述正确的是( )
A..40 g NH4NO3中含有氮原子NA个 B.标准状况下,22.4 L H2和N2的混合气体中,H2和N2分子数之和为2NA
C.标准状况下,22.4 L CCl4所含分子数为NA D.在Fe与Cl2反应中,1 mol Fe与1 mol Cl2恰好反应
10、已知m g气体A和n g气体B所含分子数相等,下列说法不正确的是( )
A.标准状况时,相同体积的气体A和气体B的质量之比为m∶n
B.25 ℃时,相同质量的气体A和气体B的分子数之比为n∶m
C.同温、同压下,气体A和气体B的密度之比为n∶m
D.通常状况下,相同质量的气体A和气体B的体积之比为n∶m
11.氯的原子序数为35
17Cl是氯的一种同位素,下列说法正确的是
A. 35Cl原子所含质子数为18
B. 1/18mol的H35Cl分子所含中子数为6.02×1023
C. 3.5g的35Cl2气体体积为2.24L
D. 35Cl2气体的摩尔质量为70g·mol-1
12.下列说法正确的是:
A.如果5.6LN2含有n个氮分子,则NA一定约为4n
B. 18g水中所含的电子数是8NA
C.在100 mL 0.5mol/L乙酸溶液中含有乙酸分子数为0.05NA
D.15gCH3+含有8mol电子
13.下列数量的各物质所含原子总数按由大到小顺序排列的是: ①0.5mol氨气 ②标况下22.4L氦气 ③4℃时9mL水 ④0.2mol磷酸
A.①④③② B.④③②① C.②③④① D.①②④③
14、下列物质中含分子粒子数由大到小的排列正确的是:①20g重水 ②40℃,1.01×105Pa时的22.4LO2③35.5gCl2④54mL1mol/LHCl(ρ=1g/mL)⑤1kgCu⑥1kg冰醋酸⑦72g“足球烯”(C60)
A ⑥⑦⑤④②①③ B ⑦⑤①③④②⑥
C ⑦⑤③①④②⑥ D 以上答案均不正确
15.设NA表示阿伏加德罗常数的值,则下列说法正确的是
A. Na 2O2和Na2O的晶体各1摩,含有的阴离子数为2NA和NA
B.在标况下,22.4LSO3含有的分子数为NA
C.在标况下,46克乙醇含有的原子数为9NA
D.1 mol钠作还原剂可提供个NA电子
16.设NA为阿伏加德罗常数,下列有关叙述正确的是:
A.在标准状况下,V L水含有的氧原子个数为(V/22.4) NA
B.常温常压下,14g碳烯(:CH2)所含电子总数为8NA
C. 6.8 g熔融的KHSO4中含有6.02×1022个阳离子
D.1L pH=1的水溶液中水合氢离子数为NA个
17 下列有关气体体积的叙述中,正确的是( )。(上海市高考题)
A. 一定温度、压强下,气态物质体积的大小由构成气体的分子大小决定。
B. 一定温度、压强下,气态物质体积的大小由构成气体的分子数决定。
C. 不同的气体,若体积不同,则它们所含的分子数也不同。
D. 气体摩尔体积是指1mol任何气体所占的体积约为22.4L。
18 在给定温度和压强下的理想气体,影响其所占体积大小的主要因素是( )。(云南省会考题)
A. 分子直径的大小 B. 分子间距离的大小
C. 分子间引力的大小 D. 分子数目的多少
二、填空题(共21分)
18.(6分)根据反应:KClO3+6HCl==KCl+3Cl2↑+3H2O,若有0.5mol电子转移,则⑴有______molCl2生成。⑵有___________个HCl被氧化。⑶有__________个+5价Cl被还原。
19.(4分)科学实验测定,每亩森林每月可吸收4kgSO2气体,如果每月按30天计算,那么每亩森林每天可吸收SO2的分子数是________________,每年可吸收SO2的物质的量是________mol。
20.(3分)将3.22g芒硝(Na2SO4?10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为 g。
21.(8分)同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为 ;同质量的氨和硫化氢气体的体积比为 ,其中含有的氢的原子个数比为 ;若二者氢原子数相等,它们的体积比为 。
三、实验题(20分)
22.(6分)配制0.1mol/L盐酸溶液500mL,请按操作顺序[⑴、⑵、⑶??]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字。
( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于500mL),用玻璃棒搅拌,使其均匀混合。
( )待稀释的盐酸冷却后,沿玻璃棒注入500mL的容量瓶中。
( )用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数) mL注入烧杯中。
( )用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
( )往容量瓶中小心加蒸馏水至液面接近刻度________cm处,改用________加蒸馏水,使溶液__________恰好与刻度线相切。
23、(14分)为了测定某气体样品C4H10(并含有少量C3H8,均不溶于水)的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1;
②往锥形瓶中通入干燥的该气体样品,塞好胶塞,准确称量,重复操作,直至前后两次称量结果基本相同,得到质量m2;
③往锥形瓶内加满水,塞好胶塞,称量,得到质量m3。
已知实验时的温度为T(K),压强为p(kPa),水的密度为ρ水(g/L),空气的相对平均分子质量为29.0,密度为ρ空气(g/L)。回答下列问题:
⑴本实验的原理是(具体说明)________________________________________________。
⑵步骤②中为什么要重复操作,直至前后两次称量结果基本相同?
答:______________________________________________________________________。
⑶具体说明本实验中怎样做到每次测量都是在相同体积下进行的?
答:______________________________________________________________________。
⑸锥形瓶中空气的质量(m空气)是___________________________(列出算式)。
⑹锥形瓶中样品的质量(m样品)是___________________________(列出算式)。
⑺由实验测得该气体样品的平均相对分子质量是________________________(列出算式)。
三、计算题(11分)
24.(5分)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积为多少?
25.(6分)19世纪中期,某化学家为了测定元素X的摩尔质量而选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定了每种化合物中X的质量分数。在250℃时,四种化合物都是气态。将它们分别转移至预先抽成真空的四个等容积的烧瓶中,直至每个烧瓶内的压强达到1.013×105Pa。称每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量。用氮气重复这一过程,得到如下数据表。 气体 气体的质量/g 气体中X元素的质量分数/%
N2 0.652 —
A 0.849 97.4
B 2.398 68.9
C 4.851 85.1
D 3.583 92.2
请通过计算后确定元素X可能的摩尔质量(要求写出推算过程)。
第二篇:物质的量知识总结

【本章知识总结】

【本章实验总结】
1.配制一定物质的量浓度的溶液的步骤
(1)计算:根据配制要求计算所用固体溶质的质量或所需浓溶液的体积.
(2)称量:当用固体溶质配溶液时用托盘天平称取一定质量的溶质;当用液体或浓溶液稀释配制溶液时用量筒或移液管量取液体体积.
(3)溶解:在小烧杯中用蒸馏水将称出的固体或量取的液体溶质的溶解,若溶解放热需冷却至室温,并用玻璃棒搅拌.
(4)转移:将烧杯中溶液沿玻璃棒注入相应容量的容量瓶中,并用适量蒸馏水洗涤烧杯内壁2至3次,并将洗涤液全部转入容量瓶中.
(5)定容:先向容量瓶中注入蒸馏水,至液面离刻度线1cm~2cm处,再改用胶头滴管向容量瓶中滴加蒸馏水至凹液面的最低处与容量瓶颈上的刻度线相切.
(6)摇匀:定容后用容量瓶的玻璃塞塞紧瓶口,左手拿住瓶颈,食指顶住玻璃塞,右手握住瓶底反复颠倒摇匀即可.
2.配制一定物质的量浓度的溶液误差分析
误差分析依据的原理:cB= =
= ,由m、V决定实验误差.
,由m、V决定实验误差.
(1)称量时所引起的误差
使所配容液的物质的量浓度偏高的主要原因:①天平的砝码沾有其他物质或已锈蚀.②试剂、砝码的左右位置颠倒.③调整天平零点时,游码放在了刻度线的右端.④用量筒量取液体时,仰视或俯视读数等等.
使所配溶液的物质的量浓度偏低的主要原因:①直接称热的物质.②砝码有残缺③在敞口容器中称量易吸收空气中其他成分或易于挥发的物质时的动作过慢.④用量筒量取液体时,俯视读数,使所读液体的体积偏小,等等.
(2)用于溶液稀释溶液的烧杯未用蒸馏水洗涤,使溶质的物质的量减少,致使溶液的浓度偏低.
(3)转移或搅拌溶液时有部分液体溅出,致使溶液浓度偏低.
(4)容量瓶内溶液的温度高于20℃,造成所量取的溶液的体积小于容量瓶上所标注的液体的体积,致使溶液浓度偏高.
