《化学必修1》化学方程式归纳
一、钠及其化合物
1.钠与氧气:常温: 点燃:
2.钠与水反应:________________________离子方程式:__________________________
3.钠与硫酸反应:
4.氧化钠与水反应:___________________________
5.过氧化钠与二氧化碳反应:
6.过氧化钠与水反应: _ 离子方程式:_______________________
7.NaOH溶液中通入少量CO2: 离子方程式:__ ________________
NaOH溶液中通入过量CO2: 离子方程式:_____________________
8.①向碳酸钠溶液滴入少量稀盐酸:
向稀盐酸滴入少量碳酸钠溶液:
②除去碳酸氢钠溶液中混有的碳酸钠:
③碳酸钠与氢氧化钙:
④碳酸氢钠与盐酸:
⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:
少量氢氧化钙溶液滴入碳酸氢钠溶液中:
⑥除去碳酸钠溶液中的碳酸氢钠:
⑦除去碳酸钠固体中的碳酸氢钠:
⑧鉴别碳酸钠和碳酸氢钠溶液:
二、铝及其化合物
1.铝与氧气的反应:
2.铝与氧化铁反应(铝热反应):
3.铝和稀盐酸:__________________________ 离子方程式:_________________________
4.铝和NaOH溶液:_________________________离子方程式:_________________________
5.氧化铝和稀硫酸:________________________离子方程式:_________________________
6.氧化铝和NaOH溶液:_____________________离子方程式:_________________________
7.氢氧化铝和盐酸:________________________离子方程式:_________________________
8.氢氧化铝和NaOH溶液:___________________离子方程式:_________________________
9.氢氧化铝受热分解:_____________________________
10.硫酸铝与氨水反应:________________________离子方程式:______________________
11.AlCl3溶液中加入少量NaOH溶液:
AlCl3溶液中加入过量NaOH溶液:
12.往偏铝酸钠溶液中通入少量CO2:
往偏铝酸钠溶液中通入足量CO2:
13.电解氧化铝:
三、铁及其化合物
1.铁与氧气反应: 铁与硫反应:
2.铁与盐酸反应: 离子方程式:___________________________
铁与CuSO4溶液: 离子方程式:___________________________
3.铁和水蒸气:_______________________________________________
4.氧化亚铁与盐酸反应: 离子方程式:_____________________
5.氧化铁与盐酸反应:_______________ _离子方程式:_____________________
6.CO还原氧化铁:__________________________________________
7.氯化铁与氢氧化钠溶液:______________________离子方程式:_____________________
8.硫酸亚铁与氢氧化钠溶液:____________________离子方程式:_____________________
9.氢氧化铁加热分解:__________________________________________
10.氢氧化亚铁被氧化成氢氧化铁:__________________________________________
11.除去FeCl2中的FeCl3:_____________________离子方程式:_______________________
12.FeCl2和Cl2反应:________________________离子方程式:________________________
13.FeCl3和Cu反应:________________________离子方程式:________________________
14.氯化铁与硫氰化钾溶液反应:________________________________
四、硅及其化合物
1.硅与氧气加热: 硅与氟气:________________________
2.硅单质与氢氟酸反应:
3.硅与氢氧化钠溶液反应: ____
4.二氧化硅与氢氟酸反应:_______________________________________
5.二氧化硅与氧化钙高温反应:__________________________________
6.二氧化硅与氢氧化钠溶液反应:_____________________________________________
7.二氧化硅与碳反应:____________________________________
8.硅酸钠与盐酸反应:_____________________离子方程式:_________________________
9.往硅酸钠溶液中通入二氧化碳:________________ _______ ______
10.二氧化硅与纯碱反应:_______________________ ___ _______
11.二氧化硅与石灰石反应:______________________ ___ ________
12.加热硅酸:
五、氯及其化合物
1.实验室制氯气:_____________________________离子方程式:______________________
2.钠在氯气中燃烧:________________________铁在氯气中燃烧:____________________
铜在氯气中燃烧:___________________ 氢气在氯气中燃烧:________________
3.氯气和水反应:_____________________ 离子方程式:_________________________
4.次氯酸光照分解:__________________________________
5.氯水中通入二氧化硫: 离子方程式:_________________________
6.氯气与氢氧化钠溶液:_____________________离子方程式:_______________________
7.工业生产漂白粉:__________________________________________________
8.漂白粉漂白原理:________________________________________________________
9.向漂白粉溶液中加入稀盐酸:
10.氯气通入溴化钾溶液: 离子方程式:_____________________
氯气通入碘化钾溶液: 离子方程式:_____________________
溴水和碘化钾溶液反应: 离子方程式:_____________________
11.氯化钠和硝酸银溶液: 离子方程式:_____________________
溴化钠和硝酸银溶液: 离子方程式:_____________________
碘化钠和硝酸银溶液: 离子方程式:_____________________
六、硫及其化合物
1.硫在空气中燃烧:_______________________硫与氢气加热: ________
2.二氧化硫与水:______________________________________
二氧化硫与氧化钙:__________________________________
少量SO2与氢氧化钠:________________ ______离子方程式:_______________________
过量SO2与氢氧化钠:_______________________离子方程式:_______________________
3.SO2通入过量的澄清石灰水:
过量的SO2通入澄清石灰水:
4.二氧化硫与硫化氢: _____
5.SO2的催化氧化:____________________________________
6.亚硫酸钠和硫酸反应:____________________________________________________
7.Na2SO3与氧气反应:__________________________________
8.三氧化硫和水反应:____________________________________
9.三氧化硫与氧化钙:___________________________
10.三氧化硫与氢氧化钙:___________________________
11.铜与浓硫酸反应:________________________________________________________
12.碳与浓硫酸反应:______________________________________________________
七、氮及其化合物
1.氮气和氧气反应:____________________________
2.工业合成氨:____________________________________
3.一氧化氮与氧气反应: ____________________
4.NO2溶于水:____________________________________
5.氨气溶于水:_________________ 氨水显弱碱性(电离方程式):____________________
6.浓氨水受热分解___________________________
7.氨气和氯化氢:____________________________________
8.氨的催化氧化_________________________________________
9.氯化铵受热分解: ____________________________________
10.碳酸氢铵受热分解:___________________________________
11.硝酸铵和NaOH:________________________离子方程式:_________________________
12.实验室制氨气:_______________________________________
13.浓硝酸与铜反应:_______________________离子方程式:_________________________
14.稀硝酸与铜反应:________________________离子方程式:________________________
15.硝酸见光分解:_____________________________________________
16.NH4+的检验离子方程式:___________________________
17.NO2、O2混合气通入水中无剩余气体:
18.NO、O2混合通入水中无剩余气体:
人教版《化学必修1》化学方程式归纳
一、钠及其化合物
1.钠与氧气:常温:4Na+O2=2Na2O 点燃:2Na + O2 Na2O2
Na2O2
2.钠与水反应:_2Na + 2H2O = 2NaOH + H2↑_离子方程式:2Na + 2H2O = 2Na++2OH- + H2↑
3.钠与硫酸反应:2Na +H2SO4= Na2SO4+H2↑
4.氧化钠与水反应:Na2O+H2O=2NaOH
5.过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 +O2↑
6.过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑ 离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑
7.NaOH溶液中通入少量CO2:2NaOH+CO2= Na2CO3+H2O 离子方程式:2OH-+CO2= CO32-+H2O
NaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3 离子方程式:_ OH-+CO2= HCO3-_____
8.①向碳酸钠溶液滴入少量稀盐酸: Na2CO3 + HCl = NaHCO3 + NaCl
向稀盐酸滴入少量碳酸钠溶液: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
②除去碳酸氢钠溶液中混有的碳酸钠: Na2CO3 + H2O +CO2 =2NaHCO3
③碳酸钠与氢氧化钙: Na2CO3 + Ca(OH)2 =CaCO3↓ + 2NaOH
④碳酸氢钠与盐酸: NaHCO3+HCl=NaCl+H2O+CO2↑
⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: NaHCO3+ Ca(OH)2 =CaCO3↓ + NaOH+ H2O
少量氢氧化钙溶液滴入碳酸氢钠溶液中: 2NaHCO3+ Ca(OH)2 =CaCO3↓ + Na2CO3 + 2H2O
⑥除去碳酸钠溶液中的碳酸氢钠: NaHCO3 + NaOH  Na2CO3 + H2O
Na2CO3 + H2O
⑦除去碳酸钠固体中的碳酸氢钠: 2NaHCO3 Na2CO3 + H2O +CO2 ↑
Na2CO3 + H2O +CO2 ↑
⑧鉴别碳酸钠和碳酸氢钠溶液: Na2CO3 + CaCl2 =CaCO3↓ + 2NaCl
二、铝及其化合物
1.铝与氧气的反应:4Al + 3O2 2Al2O3
2Al2O3
2.铝与氧化铁反应(铝热反应):2Al + Fe2O3 2Fe + Al2O3
2Fe + Al2O3
3.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑ 离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑
4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑
5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O
6.氧化铝和NaOH溶液:Al2O3 + 2NaOH = 2NaAlO2 +H2O离子方程式:Al2O3 + 2OH-=2 AlO2-+H2O
7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O
8.氢氧化铝和NaOH溶液:Al(OH)3 +NaOH = NaAlO2+2H2O离子方程式:Al(OH)3 +OH-= AlO2-+2H2O
9.氢氧化铝受热分解:_2Al(OH)3 Al2O3 +3H2O _
Al2O3 +3H2O _
10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______
11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=Al(OH)3↓+3NaCl
AlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH = NaAlO2 + 3NaCl+2H2O
12.往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2 =2Al(OH)3↓+Na2CO3
往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2 =Al(OH)3↓+NaHCO3
13.电解氧化铝: 2Al2O3  4Al+3O2↑
4Al+3O2↑
三、铁及其化合物
1.铁与氧气反应:3Fe + 2O2 Fe3O4
Fe3O4
铁与硫反应:Fe + S  FeS
FeS
2.铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+ = Fe2+ + H2↑_
铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu_
3.铁和水蒸气:_3Fe + 4H2O(g)  Fe3O4 + 4H2_
Fe3O4 + 4H2_
4.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O 离子方程式:FeO+2H+=Fe2++H2O _
5.氧化铁与盐酸反应:_ Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O_
6.CO还原氧化铁:_ Fe2O3 + 3CO 2Fe + 3CO2_
2Fe + 3CO2_
7.氯化铁与氢氧化钠溶液:FeCl3+3NaOH = Fe(OH)3↓+3NaCl_离子方程式:Fe3++3OH-= Fe(OH)3↓
8.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:Fe2++2OH-= Fe(OH)2↓
9.氢氧化铁加热分解:__2Fe(OH)3 Fe2O3+3H2O_____
Fe2O3+3H2O_____
10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3_
11.除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2 _离子方程式:2Fe3+ + Fe = 3Fe2+_
12.FeCl2和Cl2反应:_2FeCl2 + Cl2 = 2FeCl3_离子方程式:_2Fe2+ + Cl2 = 2Fe3++2Cl-
13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+
14.氯化铁与硫氰化钾溶液反应:_ Fe3+ + 3SCN- = Fe(SCN)3___
四、硅及其化合物
1.硅与氧气加热:Si+O2 SiO2
SiO2
硅与氟气:_ Si+2F2=SiF4 __
2.硅单质与氢氟酸反应:Si+4HF=SiF4+2H2
3.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑
4.二氧化硅与氢氟酸反应:_4HF+SiO2=SiF4↑+2H2O _
5.二氧化硅与氧化钙高温反应:SiO2+CaO CaSiO3__
CaSiO3__
6.二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O __
7.二氧化硅与碳反应:_ SiO2 + 2C  Si + 2CO↑_
Si + 2CO↑_
8.硅酸钠与盐酸反应:_ Na2SiO3+2HCl=H2SiO3↓+2 NaCl__离子方程式: SiO32-+2H+=H2SiO3↓
9.往硅酸钠溶液中通入二氧化碳:_ Na2SiO3 +CO2+H2O == H2SiO3↓+ Na2CO3_
10.二氧化硅与纯碱反应:SiO2+Na2CO3 Na2SiO3+CO2↑_
Na2SiO3+CO2↑_
11.二氧化硅与石灰石反应:_ SiO2+CaCO3 CaSiO3+CO2↑_
CaSiO3+CO2↑_
12.加热硅酸:H2SiO3 SiO2+H2O
SiO2+H2O
五、氯及其化合物
1.实验室制氯气:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
2.钠在氯气中燃烧:_2Na+Cl2  2NaCl _
2NaCl _
铁在氯气中燃烧:2Fe+3Cl2  2FeCl3_
2FeCl3_
铜在氯气中燃烧:Cu + Cl2  CuCl2
CuCl2
氢气在氯气中燃烧:H2 + Cl2 2HCl _
2HCl _
3.氯气和水反应:Cl2 + H2O = HCl + HClO 离子方程式:Cl2 + H2O = H++Cl- + HClO
4.次氯酸光照分解:_2HClO  2HCl + O2↑_
2HCl + O2↑_
5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-
6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O
7.工业生产漂白粉:_2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O _
8.漂白粉漂白原理:_ Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO _
9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 + 2HClO
10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2 + 2KCl离子方程式:Cl2 + 2Br- = Br2 + 2Cl-
氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl 离子方程式:_ Cl2 + 2I- = I2 + 2Cl-
溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr 离子方程式:Br2 +2I- = I2+2Br-
11.氯化钠和硝酸银溶液:AgNO3 + NaCl = AgCl↓ + NaNO3离子方程式:Ag++Cl- = AgCl↓
溴化钠和硝酸银溶液:AgNO3 + NaBr= AgBr↓ + NaNO3 离子方程式:Ag++Br- = AgBr↓_
碘化钠和硝酸银溶液:AgNO3 + NaI = AgI↓ + NaNO3 离子方程式:Ag++I- = AgI↓_
六、硫及其化合物
1.硫在空气中燃烧:_ S+O2 SO2__
SO2__
硫与氢气加热: S+H2 H2S
H2S
2.二氧化硫与水:_ SO2+H2O H2SO3_
H2SO3_
二氧化硫与氧化钙:_ SO2+CaO=CaSO3_
少量SO2与氢氧化钠:_2NaOH+SO2=Na2SO3+H2O _离子方程式:_2OH-+SO2= SO32-+H2O_
过量SO2与氢氧化钠:_ NaOH+SO2=NaHSO3_离子方程式:_ OH-+SO2= HSO3-_
3.SO2通入过量的澄清石灰水: Ca(OH)2+SO2=CaSO3↓+H2O
过量的SO2通入澄清石灰水: Ca(OH)2+2SO2=Ca(HSO3)2
4.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O
5.SO2的催化氧化:__2SO2 + O2 2SO3_
2SO3_
6.亚硫酸钠和硫酸反应:_ Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O__
7.Na2SO3与氧气反应:_2Na2SO3+O2=2Na2SO4_
8.三氧化硫和水反应:_ SO3+H2O=H2SO4_
9.三氧化硫与氧化钙:__ SO3+CaO= CaSO4_
10.三氧化硫与氢氧化钙:_ Ca(OH)2+SO3=CaSO4↓+H2O _
11.铜与浓硫酸反应:_ Cu + 2H2SO4 (浓) CuSO4 + 2H2O+SO2 ↑_
CuSO4 + 2H2O+SO2 ↑_
12.碳与浓硫酸反应:_ C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑_
2H2O+CO2↑+2SO2↑_
 七、氮及其化合物
七、氮及其化合物
1.氮气和氧气反应:_ N2 + O2 2NO _
2.工业合成氨:_ N2 + 3H2 2NH3_
2NH3_
3.一氧化氮与氧气反应:2NO + O2= 2NO2 _
4.NO2溶于水:_3NO2 + H2O = 2HNO3 + NO _
5.氨气溶于水: NH3 + H2O NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O
NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O NH4+ + OH-
NH4+ + OH-
6.浓氨水受热分解_ NH3·H2O  NH3↑+H2O __
NH3↑+H2O __
7.氨气和氯化氢:_ HCl + NH3 = NH4Cl _
8.氨的催化氧化_4NH3 +5O2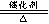 4NO + 6H2O _
4NO + 6H2O _
9.氯化铵受热分解: _ NH4Cl NH3+HCl _
NH3+HCl _
10.碳酸氢铵受热分解:_ NH4HCO3 NH3↑+ H2O↑ + CO2 ↑_
NH3↑+ H2O↑ + CO2 ↑_
11.硝酸铵和NaOH:NH4NO3 + NaOH  NaNO3 + NH3↑+H2O_离子方程式:NH4++ OH-
NaNO3 + NH3↑+H2O_离子方程式:NH4++ OH- NH3↑+H2O
NH3↑+H2O
12.实验室制氨气:_2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O
CaCl2 + 2NH3↑ + 2H2O
13.浓硝酸与铜反应:4HNO3(浓)+Cu  Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O
离子方程式:4H++2NO3-+Cu  Cu2++2NO2↑+2H2O
Cu2++2NO2↑+2H2O
14.稀硝酸与铜反应:8HNO3(稀)+3Cu  3Cu(NO3) 2+2NO↑+4H2O
3Cu(NO3) 2+2NO↑+4H2O
离子方程式:8H++2NO3-+3Cu  3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
15.硝酸见光分解:_4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)_
16.NH4+的检验离子方程式:NH4++ OH- NH3↑+H2O
NH3↑+H2O
17.NO2、O2混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4HNO3
18.NO、O2混合通入水中无剩余气体:4NO+ 3O2 + 2H2O = 4HNO3

