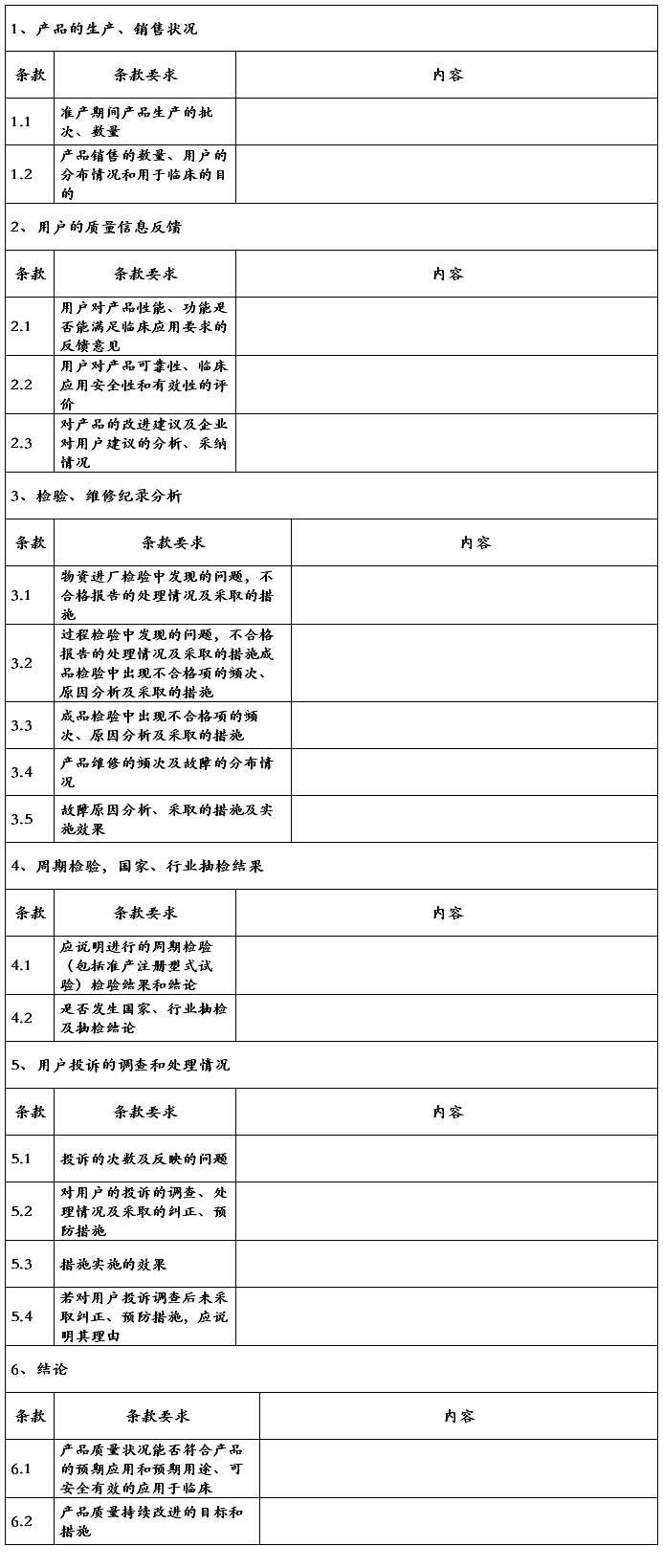
产品质量跟踪报告(范本)
为了提高企业的信誉,增强企业在市场经济的竞争能力,公司对产品质量进行跟踪,以此发现产品生产直至使用过程中存在的各种问题,并及时采取纠正措施,从而为用户提供全方位的服务。公司主要通过以下方式对产品质量进行跟踪:
一、 产品的质量控制措施以及内部审核中对产品质量的审查;
本公司依据GB/T19001-2000 idt ISO 9001:2000《质量管理体系—要求》建立质量管理体系,并定期进行管理评审。管理评审每年度不得少于一次。有下列情况时,质检部可报请管理者本文来源医药社区hpwwphwmstn7$H$_7D6&F4代表增加评审次数,经总经理批准后可实施评审。
本文来源医药社区hpwwpwharmn8Yq+3S1e3本文来源医药社区hpwwphwmn#P$8K36HQB92} 1.做好标识管理,便于产品质量追溯:
仓管部库管员负责对库内采购的原材料、外加工部件及库内成品进行标识;生产车间负责生产区域内原材料、在制品、外加工部件、工装流水线上的各种半成品及成品下线前的产品标识;质检部对所有产品表示的执行情况进行检查监督;生产车间、仓管员对产品的可追溯性负责。 本文来源医药社区hpwwpwhmn%5h3#P9L6Z~
1.1原材料的标识
1.1.1原材料入库后,库管员按类别登记入账,并做好原材料标识,标识的内容包括:原材料名称、产地、供应商、数量、规格、批次等,具体表式如下:
1.1.2所有原材料要实行动态管理,每次车间领取材料后,都须注明其领取、结存情况;原本文来源医药社区hpwwphwmstn@18ub#U#Em
材料变换产地时,应重新设置原材料标识卡。
1.2生产过程的产品标识 本文来源医药社区hpwwphwmn7n7P^C
1.2.1车间领取的各种材料应详细登记《原材料使用记录》,记录原材料的使用情况,以便追溯。
1.2.2制作工序的标识本文来源医药社区hpwwpwhmn7_2@QDO0pHAZ
本文来源医药社区hpwwwphamnvp3NN8m5^H
每种产品在制作过程中,在操作台的上方悬挂相应的标牌,对生产工序加以标识。
1.3成品的标识 本文来源医药社区hpwwpwhmnY4y@6T+ H0vE
1.3.1小包装标识
经工序检验合格的产品,在对其小包装封口时,都应施加“生产日期”、“失效日期标识”“检验合格证明”,生产日期、失效日期均为实际日期,每天上班时由车间专人负责更换日期编码。 本文来源医药社区hpwwwphamnP6&O1~7w%u1V
1.3.2中包装标识
中包装的标识同小包装
1.3.3外包装的标识
产品经工序的最终检验后,在其外包装上注明检验人、生产批号、生产日期、实效日期等标识。 本文来源医药社区hpwwpwhmn&nF0w%6}本文来源医药社区hpwwpwhmn*u$XHZ7
1.4环氧乙烷灭菌工序的标识
产品外包装后按要求进行打包,在进行环氧乙烷灭菌前,由车间在包装箱外侧要求的位置加本文来源医药社区hpwwpwhmn4A11MU
贴“环氧乙烷灭菌指示片”及“环氧乙烷灭菌标签”,并在标签的要求位置加盖生产日期及灭菌日期,待按要求灭菌、解析、检测后,由质检部加盖“环氧乙烷灭菌印章”及“检验合格印章”。
本文来源医药社区hpwwpwhmn}7OVk$Q3b
2追溯
产品的追溯有两个方面:使用原材料的追溯和责任者的追溯。本文来源医药社区hpwwwphmstnS3o%D$nEg
本文来源医药社区hpwwphwmstn"d6E+ YV%_L#m{#%
2.1原材料的追溯
当产品出现异常情况,需要对所使用的材料进行追溯时,根据销售部提供的产品名称、生产日期、批号,利用《原材料使用记录》,查得所用的原材料名称、规格、领用日期,再结合
《原材料标识卡片》,即可追溯到所用原材料的名称、产地、供应商、数量、到货日期等质量信息。
2.2责任者的追溯
2.2.1责任者的追溯又分制造责任者和检验责任者的追溯,对简单的操作工序,产品的检测由操作者自检来完成的,制作者与检验者相同;否则要分别追溯。
2.2.2当产品出现异常,确定需追溯制造者、检验者时,根据销售等部门提供的信息,查对《生产工序记录》,即可追溯至相应的制作者、检验者。
二、 顾客满意调查及信息反馈
1.内部数据的收集、分析与处理 本文来源医药社区hpwwpwharmnMQ5^u7A%L5o0q
1.1正常信息的收集、分析与处理:各部门依据相关文件的规定直接收集、分析并传递、处理日常的正常信息:质检部按有关文件规定向有关部门传递质量方针和质量目标及其完成情况和内部审核结果、管理评审结果、更新的法律、法规、标准
等信息。
1.2存在潜在的不合格的数据的收集、分析和处理执行《纠正措施控制程序》的有关规定。
本文来源医药社区hpwwpwhmn1w#1g^5kB0Y文来源医药社区hpwwphamcn8CE}1p本
1.3其它内部信息,提供者可以《信息联络处理单》反馈给质检部 进行分析和处理。
本文来源医药社区hpwwpwhmn39T-%m0 FGq^T本文来源医药社区hpwwphwmstnb@9 G4W7g%Z 2. 紧急(突发)信息的收集、分析和处理
对紧急(突发)信息——内部的和/或外部的,按信息的重要程度分为A、B、C三级:A级信息:指影响产品质量、人身设备安全、企业信誉,以及批量大、损失严重的质量事故的信息;B级信息:指影响部门工作,批量及损失价值均小于A级的信息; C级信息:指批量和损失价值微小的问题 本文来源医药社区hpwwpwhmn#O9x1}A66C6^
2.1 A级信息必须立即报告分管经理和/或总经理,同时由信息发生部门填写《信息联络处理单》,报质检部 。质检部签署意见,传递至相关部门限期处理。其处理期限为24小时。
2.2 B级信息,由信息发生部门及时填写《信息联络处理单》 由质检部验证签署意见后传递至责任部门,责任部门应立即与有关部门协商解决。当部门之间协商不通,可上升为A级信息,报质检部要求协调解决。B级信息的处理期限为72小时。
2.3 C级信息由各信息发生部门自行分析、处理,各部门应做好记录,每季报质检部 。 本文来源医药社区hpwwpwhmn06L,F*8F
3. 调查方式:
3.1 在产品大包装内附质量调查表和用户联系卡,请用户填写后寄回,对用户反馈的信息,定期分析处理并及时与用户反馈和沟通。
3.2 产品从原材料采购到生产、销售,严格做好区域和状态标识,每批产品都有对应的生产批号和灭菌批号,保证产品的可追溯性,一旦发现不合格产品应能立即不合格产品应能立即返回。
3.3及时走访客户,耐心听取意见,会同用户或有关部门进行现场调查,详细了解产品质量有关细节,认真做好记录。
3.4积累用户来信、来访和电迅等所提供的质量情况。本文来源医药社区hpwwpwhmnUq6R7dKd2Q5@
本文来源医药社区hpwwpwhmn&K1_5W8本文来源医药社区hpwwphwmn$$SM*Av96A 3.5定期召开质量会,其中对销售过程中出现的质量问题及时解决处理,并及时反馈给客户。
4.产品使用过程中用户对产品质量的反馈情况:
4.1该产品包装严密,能够保证产品无菌,包装袋易撕开,便于使用;灭菌日期、生产日期醒目清晰,有明显的灭菌指示卡,便于观测;产品的外观透明光洁没有注塑缺陷;产品密封性好,没有出现泄漏现象;产品生化性能稳定,在试用期没有发现患者有不良反应
4.2产品规格应进一步丰富。
5. 结论:该产品设计合理、操作简单、使用方便、无菌、无毒、无皮内刺激反应,物理、本文来源医药社区hpwwpwhmnK785A2nq{b4g
生物、化学性能稳定,是一种值得依赖和推广的产品。
三、 不良事件处理:
1.企业严格执行《医疗器械不良事件监测管理办法》,并指定专(兼)职人员,负责本单位生产、经营、使用的医疗器械的不良事件信息收集、报告和管理工作。
2.发现可疑医疗器械不良事件时应填写《可疑医疗器械不良事件报告表》,并按季度向所在本文来源医药社区hpwwpwhmn3R$P7L4w本文来源医药社区hpwwphwmstn9q$n9PC9d7
省、自治区、直辖市药品不良反应监测中心报告,其中严重伤害事件应于发现后10个工作日内报告,死亡事件应于24小时内报告;死亡病例同时报送国家药品不良反应监测中心。在报告与医疗器械有关的死亡或严重伤害事件后20个工作日内,向所在省、自治区、直辖市药品不良反应监测中心提交企业对该产品的补充报告。包括:产品介绍、使用说明书、对不良事件的跟踪随访情况、用户联系方式、给使用者的相关信息、事件发生可能的原因、补救措施和改进方案、本企业生产同类产品名称、标识及临床应用情况。
四、信息的汇总、分析及归档本文来源医药社区hpwwpwhmn7KR4+{4#A*
1.质检部每半年应对全公司的信息进行一次汇总、分析,写出信息分析报告,报总经理和管理者代表,并在公司的质量工作会议上进行信息发布,为持续改进提供依据。
2.质检部对信息的收集、分析和处理的有效性负责,并检查、监督、指导和协调各部门的信息管理。
五、统计技术的应用
1.质检部会同生产部等部门,确定统计技术的应用场合,并根据应用场合确定适用的统计技术。 本文来源医药社区hpwwpwhmn5W5^8K5N8B5}
2.统计技术的应用
3.针对选用的统计技术,各实施单位应制定具体的应用方案和程序,并实施。对数据进行整理归纳,去伪存真,形成数表、图形,进行统计分析,不断改进、提高产品质量。
第二篇:产品质量跟踪报告
产品质量跟踪报告
单位名称: (公章)
产品名称:
日 期: