基础化学实验报告
实验名称 三草酸合铁酸钾的制备
1185031 班 组
姓名 ,同组人
实验日期
一、 实验目的
1、有助于提高学生的综合实验能力, 而且可以提高学生对于化学实验的兴趣。
2、掌握制备过程中的称量、水浴加热控温、蒸发、浓缩、结晶、干燥、倾析、常压、减压过滤等系列化学基本操作。
二、 实验原理
首先由硫酸亚铁铵与草酸反应制备草酸亚铁:
(NH4)2Fe(SO4)2·6H2O+H2C2O4→FeC2O4·2H2O↓ +(NH4)2SO4+H2SO4+4H2O
然后在过量草酸根存在下,用过氧化氢氧化草酸亚铁即可得到三草酸合铁(Ⅲ)酸钾,同时有氢氧化铁生成:
6FeC2O4·2H2O+3H2O2+6K2C2O4→4K3[Fe(C2O4)3]+ 2Fe(OH)3+12H2O,
加入适量草酸可使Fe(OH)3转化为三草酸合铁(Ⅲ)酸钾配合物:
2Fe(OH)3+3H2C2O4+3K2C2O4→2K3[Fe(C2O4)3]·3H2O
再加入乙醇,放置即可析出产物的结晶。总反应:
2FeC2O4·2H2O+H2O2+3K2C2O4+H2C2O4→2K3[Fe(C2O4)3]·3H2O
三、仪器和试剂
仪器:托盘天平、恒温水浴、循环水泵、减压过滤装置、常用玻璃仪器、温度计、滤纸、pH试纸、酒精灯。
试剂:自制硫酸亚铁铵晶体、3mol·L- 1 H2SO4溶液、饱和H2C2O4溶液、饱和K2C2O4溶液、6%H2O2溶液、95%乙醇、K3[Fe(CN)6]固体、硝酸钾固体。
主要试剂及产物物理常数
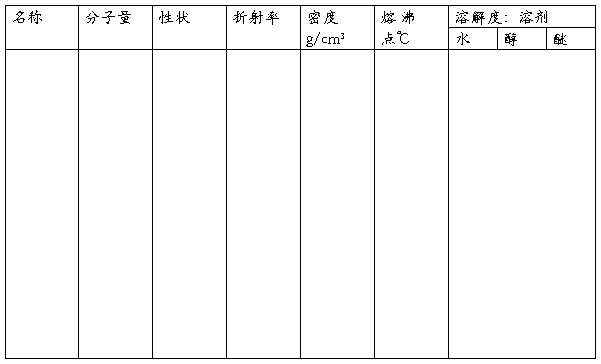
四、实验步骤及现象

五、产率的计算
六、注意事项
FeC2O4·2H2O的制备
(1)为了防止Fe(II)水解和氧化,硫酸亚铁铵溶解时应加少量的H2SO4,防止Fe(II)的水解和氧化。
(2)FeC2O4·2H2O生成时要维持微沸几分钟,主要是有利于FeC2O4·2H2O晶体颗粒长大便于过滤。通过学生实验发现不能采用酒精灯或电炉来加热,原因是FeC2O4·2H2O晶体易爆沸,不易控制火候,宜采用沸水浴加热比较安全且效果较佳。
(3)生成的FeC2O4·2H2O晶体表面容易粘着硫酸盐,要用少量H2O洗涤,洗净的标准是洗涤液中检不到SO42-。
FeC2O4·2H2O的氧化
(1)为了加快反应速度和减少溶液的总体积可使用6%的H2O2,比3%的H2O2的效果更好,而且H2O2一定要新鲜配制。在不断搅拌下慢慢滴加H2O2且需保持恒温40℃,温度太低Fe(II)氧化速度太慢,温度太高易导致H2O2分解而影响Fe(II)氧化结果。
(2)检验Fe(II)是否氧化完全:吸取1滴所得的黄色的悬浊液于白色点滴板中,加酸酸化后加少许K3[Fe(CN)6]固体,如出现蓝色(蓝色+黄色混合色为绿色),证明还有Fe(II),需再加H2O2至检测不到Fe(II)。
(3)煮沸除去过量的H2O2时间不宜过长,否则使生成的Fe(OH)3沉淀颗粒变大,不利于配位反应的进行。
三草酸合铁酸钾的制备
(1)配位过程中,H2C2O4应逐滴加入,应控制在pH 3~3.5,pH过低,会发生副反应:2Fe(OH)3+Fe2(C2O4)3+H2C2O4+2H2O=4FeC2O4·2H2O↓+2CO2↑,使产物带有黄色的粉末,而且若H2C2O4过量太多容易形成H2C2O4晶体析出,使产物的带有白色的粉末;pH过高,Fe(OH)3溶解不充分。
(2)配位后应得到澄清的翠绿色三草酸合铁酸钾溶液,若溶液颜色为暗绿色则配体C2O42-不足,可适当补加饱和K2C2O4;如果澄清的翠绿色三草酸合铁酸钾溶液体积超过20mL不利于三草酸合铁酸钾的结晶,宜用酒精灯小火加热浓缩,若用电炉加热蒸发容易出现红棕色浑浊现象,可能是如下反应:
2Fe(OH)3+3H2C2O4+3K2C2O4→2K3[Fe(C2O4)3]·3H2O发生了逆反应。
七、实验讨论
八、备注
参考文献:
[1] 林深,王世铭.大学化学实验[M].化学工业出版社,2009,88- 92.
[2] 郑臣谋,林的的.对“三草酸合铁(III)酸钾的制备”的改进[J].大学化学,1999,14(2):41- 42,45.
[3] 姜述芹,陈虹锦.三草酸合铁(III)酸钾制备实验探索[J].实验室研究与探田索,2006,25(10):1194- 1196.
[4] 程春英.硫酸亚铁铵制备三草酸合铁酸钾的思考[J].实验室科学,2009(6):62- 63.
第二篇:基础化学实验Ⅰ(下)
基础化学实验Ⅰ(下)
实验一、分析天平的称量练习
1. 用分析天平称量的方法有哪几种?指定质量称样法和递减称样法各有何优缺点?在什么情
况下选用这两种方法?
答:称量有三种方法:直接称量法,指定质量称量法,递减称量法。
指定质量称量法:此方法称量操作的速度很慢,适于称量不易吸潮,在空气中能稳定存在的
粉末状或小颗粒(最小颗粒应小于0.1mg)样品,以便容易调节其质量。在直接配制标准溶液和试样分析时经常使用指定质量称样法。
递减称量法:此称量操作比较繁琐。主要用于称量过程中样品易吸水、易氧化或易与空气中
的CO2发生反应的试样。
2. 使用称量瓶时,如何操作才能保证试样不致损失?
答:将称量瓶取出,在接收器的上方,倾斜瓶身,用称量瓶盖轻敲瓶口上部使试样慢慢落入容器中。当顷出的试样接近所需量时,一边继续用瓶盖轻敲瓶口,一边逐渐将瓶身竖直,使粘附在瓶口上的试样全部进入称量瓶中,然后再盖好瓶盖,称量。
实验二、滴定分析基本操作练习
1.HCl溶液与NaOH溶液定量反应完全后,生成NaCl和水,为什么用HCl滴定NaOH时
采用甲基橙作为指示剂,而用NaOH滴定HCl溶液时却使用酚酞作为指示剂?
答:HCl溶液与NaOH溶液,相互滴定两种指示剂均可采用,但是考虑到终点颜色的观察敏
锐性一般黄色到橙色,无色到红色容易观察,因此采用上述方法。
2.滴定读数的起点为什么每次最好调到0.00刻度处?
答:因为滴定管在制作过程中会出现管内刻度不完全均匀的现象,每次滴定都从0.00刻度开始,能消除系统误差。
实验三、混碱分析
1. 双指示剂法的测定原理是什么?
答:用HCl溶液滴定Na2CO3 为例。H2CO3 为二元酸,离解常数分别为pKa1=6.38; pKa2=10.25,用HCl溶液滴定Na2CO3 溶液时cKb1>10-9 ,c Kb2=10-8.62 > 10-9,且Kb1/Kb2=10-3.75/10-7.62=103.87 ≈104,能分步进行:第一步反应:Na2CO3+HCl=NaHCO3+NaCl,
11:pH(pp)第一化学计量点=K+K=(6.36+10.25)=8.31a1a1 22第二步的反应产物为CO2 ,其饱和溶液的浓度为0.04 mol·L-1
NaHCO3+HCl=NaCl+H2CO3 .............................................aCO2↑+H2O 11第二化学计量点=K+c=(6.36+1.40)=3.9(pp):pH2a 22
用HCl溶液滴定Na2CO3有2个滴定突跃:
第一个突跃在化学计量点pH=8.3的附近,可用酚酞作指示剂;
第二个突跃在化学计量点pH=3.9的附近,可用甲基橙作指示剂。
2. 采用Na2CO3作基准物质标定0.l mol·L-1 HCl溶液时,基准物质称取量如何计算? 1 1
答:标定反应Na2CO3+2HCl=NaCl+HCl+H2O MNa2CO31mNa2CO3m=cVNa2CO3HClHCl cHClVHCl=2××1000mL?L-121000mL?L-1
MNa2CO3
VHCl =20?40mL 时,则 1105.99g/molmNa2CO3=×0.1mol?L?1×20mL× 21000mL?L-1
=0.1059g≈0.11g
若配制250mL,分取25.00mL用于标定HCl溶液浓度则应称量1.1g ? 2.2g;
通常VHCl =20?30mL,若配制250mL,分取25.00mL用于标定HCl溶液浓度则应称量1.1g? 1.6 g
3.“总碱量”的测定应选用何种指示剂?终点如何控制?为什么?·
答:指示剂选用:“总碱量”的测定应选用甲基橙作指示剂。溶液由黄色变为橙色时即为终点。因为用和HCl溶液滴定Na2CO3时,其反应包括以下两步:
Na2CO33 +NaCl
NaHCO3NaCl + H2CO
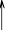
3
H2O+CO2
当中和成NaHCO3时,pH值为8.3;在全部中和后,其pH值为3.7。由于滴定的第一等当点(pH8.3)的突跃范围比较小,终点不敏锐。因此采用第二等当点,以甲基橙为指示剂,溶液由黄色到橙色时即为终点。
终点控制:滴定快到终点时应慢滴快摇,要充分摇动锥形瓶,以防形成CO2的过饱和溶液使终点提前到达。当颜色由黄变橙,且颜色稳定,即为终点。
实验四、含氮量测定
1.NH4NO3、NH4C1或NH4HCO3中的含氮量能否用甲醛法分别测定?
答:NH4NO3中铵态N可以直接用甲醛法测定,但是其中NO3里面的N无法直接用甲醛法测定;NH4C1中的含氮量可以直接用甲醛法测定;NH4HCO3中的含氮量不能直接用甲醛法测定,因为NH4HCO3中的HCO3- 干扰测定。
NH4HCO3 + HCHO →(CH2)6N4H+ + H2CO3
产物 H2CO3易分解且酸性太弱,不能被NaOH准确滴定。
2.为什么中和甲醛中的游离酸使用酚酞指示剂,而中和(NH4)2 SO4试样中的游离酸却使用甲基红指示剂?
答:若试样中含有游离酸,加甲醛之前应事先用甲基红为指示剂,用碱预中和至甲基红变为黄色 。因为(NH4)2SO4试样溶液的pH≈4.63,若用酚酞作指示剂NH4+将部分被NaOH滴定,影响结果的准确度, 故中和试样中游离酸时应选择甲基红(4.4~6.2)做指示剂;二甲醛溶液中常含有微量酸,但不存在NH4+会被部分滴定的情况,因此用酚酞作指示剂会和测定方法统一起来,做到标测一致,减少误差,提高分析结果的准确度。
3.(NH4)2 SO4试液中含有PO43-、Fe3+、Al3+等离子,对测定结果有何影响?
答:PO43-产生酸效应使测的结果偏低;Fe3+、Al3+离子在中和残余酸时,容易产生水解现象
导致测定结果偏高。
实验五、水的硬度分析
1.在中和碳酸钙基准溶液中的HCl时,能否用酚酞取代甲基红?为什么?
2
答:不能,主要是因为酚酞在终点时呈现红色,该颜色影响终点时EBT蓝色的观察,从而影响对滴定终点的判断,导致结果准确性降低。
2.阐述Mg2+-EDTA能够提高终点敏锐度的原理。
答:由于指示剂EBT对Mg2+变色灵敏,而对Ca2+不敏锐,所以当测定水硬时,试液的Mg2+浓度较低或没有Mg2+时,需要加入Mg2+-EDTA提高指示剂EBT变色的敏锐性。
提高终点敏锐度的原理: Ca2+与EDTA的络合常数为10.69,比Mg2+与EDTA的络合常数
8.7大,溶液中开始时存在大量的Ca2+,溶液中加入Mg2+-EDTA后,Ca2+置换Mg2+,形成Ca2+-EDTA,游离出的Mg2+与指示剂络合形成酒红色化合物,到滴定终点时,过量的半滴EDTA与Mg2+结合从而释放出游离指示剂(蓝色),可以敏锐的指示滴定终点。
3. 滴定为什么要在缓冲溶液中进行?如果没有缓冲溶液存在,将会导致什么现象发生? 答:EDTA滴定分析中采用的标准滴定溶液是Na2H2Y,在滴定过程中随着滴定的进行,溶液的酸度逐渐增加,EDTA的酸效应逐渐增强即αY(H)副反应系数增大,导致,,KCaY、KMgY逐渐
′<8,滴定反应不完全,不能准确滴定。为此要达到准确滴定的目的必减小,致使lgcKMY
须严格控制溶液的酸度,故需要加入缓冲溶液。
实验六、混合溶液中铅铋含量的测定
1 滴定Bi3+、Pb2+离子时溶液酸度各控制在什么范围?怎样调节?为什么?
答:因PbY: lgKPbY=18.04,(pH)min=3.3;BiY: lgKBiY=27.94,(pH)min=0.7
故:可通过控制酸度分别滴定
测定条件:pH=1 时测定Bi3+,指示剂 二甲酚橙(XO),终点Bi-XO(紫红)→XO(亮黄);在滴定Bi3+后的溶液中,调节溶液的pH=5~6 时测定Pb2+ , 终点Pb-XO(紫红)→XO(亮黄)
2. 为什么不用NaOH、NaAc或者NH3·H2O,而用六亚甲基四胺调节pH到5~6?
答:测定金属离子Pb2+的适宜的滴定酸度pH=5~6,按照缓冲溶液的选择原则选择:所需要控制的溶液的酸度应该在pKa ± 1范围内,NaOH、NH3·H2O不符合要求,单从pKa分析可以
,减少,NaAc和六亚甲基四胺缓冲液体系,但是NaAc与Pb2+生成Pb(Ac)3-,αPb(Ac)增大,KPbY
影响反应的完全程度,故用六亚甲基四胺调节pH到5~6。
实验七、重铬酸钾滴定法测定铁
1. SnCl2还原Fe3+的条件是什么?怎样控制SnCl2不过量?
答:在还原Fe3+时HCl溶液浓度应控制在4 mol/L,若大于6 mol/L,Sn2+会先将甲基橙还原为无色,无法指示Fe3+的还原反应。HCl溶液浓度低于2 mol/L,则甲基橙褪色缓慢。
控制SnCl2不过量的措施是采用甲基橙指示SnCl2还原Fe3+,原理是:Sn2+将Fe3+还原完后,过量的Sn2+可将甲基橙还原为氢化甲基橙而褪色,不仅指示了还原的终点,Sn2+还能继续使氢化甲基橙还原成N,N-二甲基对苯二胺和对氨基苯磺酸,过量的Sn2+则可以消除。在溶液中
当溶液由橙变红,再慢慢滴加SnCl2至溶液变为淡粉色,加入一滴甲基橙,再滴加SnCl2溶液,
再摇几下直至粉色褪去。如刚加入SnCl2红色立即褪去,说明SnCl2已经过量,可补加1滴甲基橙,以除去稍过量的SnCl2,此时溶液若呈现粉红色,表明SnCl2已不过量。
2. 以K2Cr2O7基准溶液滴定Fe2+时,加入H3PO4的作用是什么?
3
答:滴定反应为:6 Fe2++Cr2O72-+14H+ →6 Fe3++2 Cr3++7H2O;滴定突跃范围为0.93 ~
1.34V,使用二苯胺磺酸钠为指示剂时,由于变色点电位为0.85V,终点提前到达,引入较大误差。因而需加入H3PO4。加入H3PO4可使滴定生成的Fe3+生成无色的Fe(HPO4)2-而降低Fe3+/ Fe2+电对的电位,使突跃范围变成0.71~1.34V,指示剂可以在此范围内变色,同时也消除了FeCl4-黄色对终点观察的干扰。
实验八、碘量法测定铜盐中铜的含量
1. 碘量法测定铜合金中的铜时,为什么常要加入NH4HF2?为什么临近终点时加入NH4SCN或KSCN?
答:因为铜合金中会含有Fe3+,能氧化I-,对测定有干扰,加入NH4HF2可掩蔽。同时NH4HF2是一种很好的缓冲溶液,因HF的Ka=6.6×10-4,故能使溶液的pH值控制在3.0~4.0之间。
近终点时加入硫氰酸盐,将CuI转化为溶解度更小的CuSCN沉淀,把吸附的碘释放出来,使反应更为完全。硫氰酸盐应在接近终点时加入,否则SCN-会还原大量存在的I2,致使测定结果偏低。
2.碘量法测定铜为什么要在弱酸性介质中进行? 而用K2Cr2O7标定Na2S2O3溶液时却要先加入5mL 6 mol·L-1 HCl 溶液,而用Na2S2O3溶液滴定时却要加入100mL水稀释,为什么? 答:碘量法测定铜溶液的pH值一般应控制在3.0~4.0之间,酸度过低,Cu2+易水解,使反应不完全,结果偏低,而且反应速率慢,终点拖长;酸度过高,则I-被空气中的氧氧化为I2(Cu2+催化此反应),使结果偏高。
K2Cr2O7标定Na2S2O3溶液时,由于K2Cr2O7与I-的反应在强酸性溶液中反应,所以先加入5mL 6 mol·L-1 HCl 溶液,有利于反应速度加快,但酸度过大,I-离子容易被空气氧化。所以酸度一般要控制在 0.4 mol·L-1 较为合适。
定量析出I2后, I2与S2O32-的滴定反应在中性或弱酸性介质中进行,滴定前要进行稀释,这样既可以降低酸度,使I-离子被空气氧化的速度减慢,避免析出过多的I2,又可使Na2S2O3分解作用减小;而且稀释后Cr3+的绿色减弱,便于终点观察。
3. 实验中加入的碘化钾及硫氰酸盐的作用是什么?
答:碘化钾三个作用:KI既是Cu2+的还原剂(Cu2+→Cu+),又是Cu+是沉淀剂(Cu+→CuI),
。KI增加可以促进KI 与Cu2+ 反应加快进行,与I2 生成I3-离子防止还是I2的配位剂(I2→I3-)
I2挥发损失。
硫氰酸盐的作用:
CuI沉淀强烈吸附I-3,又会使结果偏低。通常的办法是近终点时加入硫氰酸盐,将CuI转化为溶解度更小的CuSCN沉淀,把吸附的碘释放出来,使反应更为完全。硫氰酸盐应在接近终点时加入,否则SCN-会还原大量存在的I2,致使测定结果偏低。
实验九、氯化物中氯含量的测定
1. 莫尔法测氯时,为什么溶液的pH须控制在6.5~10.5?
答:莫尔法测氯时滴定必须在中性或弱碱性溶液中进行。在酸性介质中,铬酸根将转化为重铬酸根,溶液中铬酸根的浓度将减小,指示终点的铬酸银沉淀过迟出现,甚至难以出现。若碱性太强,则有氧化银沉淀析出。
2.以K2CrO4为指示剂时,指示剂浓度过大或过小对测定有何影响?
答:指示剂的用量对滴定有影响,一般以5 × 10-3 mol·L-1为宜。若太大将会引起终点提前,且本身的黄色会影响终点的观察;若太小又会使终点滞后,都会影响滴定的准确度。 4
实验十、水泥中SO3含量的测定
1.综述硫酸钡晶形沉淀的沉淀条件?
答: 晶体沉淀的条件为:稀、慢、搅、热、陈、冷过滤。
稀:沉淀必须在稀溶液中进行,沉淀剂也要为稀溶液,这样可以降低沉淀物的相对饱和度,降低聚集速度,以获得较大粒度的沉淀;
慢:沉淀剂必须缓慢加入。以使溶液的相对过饱和度小,同时又能保持适当的过饱和度; 搅:在不断搅拌下加入沉淀剂,防止局部的过饱和度过大;
热:沉淀必须在热溶液中进行,这样使沉淀的溶解度大一些。相对过饱和度低些。减少沉淀对杂质的吸收,防止形成胶体。
陈:沉淀完毕后必须进行陈化。以使小晶体转为大晶体,同时可使晶体变的更完整和纯净。
即在稀溶液中,在搅拌下慢慢地加入热溶液,沉淀后需要陈化过夜或者数小时,最后冷过滤。
2.硫酸钡重量法测定水泥中三氧化硫含量时,洗涤至无Cl-离子的目的和检查Cl-离子的方法如何?
答:其目的是为了获得纯净的硫酸钡沉淀。
为了使硫酸钡沉淀完全,利用同离子效应在溶液中加入了过量的BaCl2,BaSO4沉淀表
其次吸附溶液中带相反电荷的Cl-,于是形成了沉淀表面的双电层。面首先吸附构晶离子Ba2+,
通常采用温水洗涤沉淀,将沉淀表面的Cl-离子洗涤干净,从而保证沉淀洗涤干净。
使用硝酸银检验Cl-离子,取几滴滤液,滴入硝酸银,若无白色沉淀生成,则证明无Cl-离子存在。
3.为什么要控制在一定酸度的盐酸介质中进行沉淀?
答:控制酸度在0.25-0.30mol/L,因为酸度是影响沉淀纯度的主要因素之一,必须严格控制,包含四个方面的作用:
(1) 防止生成BaCO3、Ba3(PO4)2(或Ba3HPO4)、Ba(OH)2等共沉淀。
(2)在此酸度下,可以不分离铁铝等离子而直接进行沉淀。
(3)加入适量的盐酸,由于酸效应可使溶液中的SO42-浓度略微降低,稍稍增大了硫酸钡的溶解度,相应地降低了溶液的过饱和度,有利于生成大颗粒沉淀。
(4)同时克服了因大量Ca2+存在而产生的共沉淀现象。
实验十一、邻二氮菲分光光度法测定微量铁
1.怎样用吸光光度法测定水样中的全铁(总铁)和亚铁的含量?试拟出一简单步骤。
答:①水样中全铁(总铁):采用邻二氮菲吸光光度法测定铁,使用处理好的水样进行试验,测定时加入盐酸羟胺溶液,将其中的三价铁均还原为二价铁,即可测定其中总铁的含量。 ②水样中亚铁:直接采用邻二氮菲吸光光度法测定铁,测定时不加入盐酸羟胺溶液,即只能测定水样中的亚铁含量。
2.制作工作曲线和进行其它条件试验时,加入试剂的顺序能否任意改变?为什么? 答:不能随意改变。
本方法的试剂顺序是铁标准溶液,盐酸羟胺,邻二氮菲和醋酸钠溶液。被测定的试液加入后,加入盐酸羟胺的目的是为了将三价铁还原为二价铁,故必须先加入;然后加入邻二氮菲和醋酸钠溶液。
5
