有关氧化还原反应知识的归纳
一、概念:凡有元素化合价升降的反应。
二、特点:任何氧化还原反应中,氧化与还原同时并存缺一不可,而且得失电子总数相等。
三、有关概念关系:
(1)氧化、被氧化。同一概念。指元素(原子或离子)失电子的反应,指反应过程,均指元素而言。化合价升高。
(2)还原、被还原。同一概念。指元素(原子或离子)得电子的反应,指反应过程,均指元素而言,化合价降低。
(3)氧化性、氧化能力、氧化剂:同一概念。指得电子的物质。本身被还原,使对方被氧化指反应物。
(4)还原性、还原能力、还原剂:同一概念。指失电子的物质。本身被氧化,使对方被还原指反应物。
(5)氧化产物:还原剂失电子被氧化成的生成物。
(6)还原产物:氧化剂得电子被还原成的生成物。

四、价态与氧化剂、还原剂的关系:
(1)元素为最低价态时,只具有还原性。I-,S2-等。
(2)元素为最高价态时,只具有氧化性。Fe3+,H+,S+6等。
(3
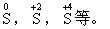
)元素处于中间价态时,既具有氧化性,又具有还原性。
五、氧化还原反应与基本反应类型关系:
(1)是化学反应的两种不同的分类法。即氧化还原反应;非氧化还原反应。
(2)置换反应:一定是氧化还原反应。复分解反应:一定是非氧化还原反应。化合、分解反应:部份是氧化还原反应,部分是非氧化还原反应。
六、表示电子转移的方向和数目的方法:
(1)单线桥式:
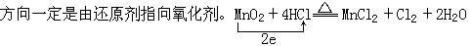
特点:明确表示氧化还原反应中电子转移的方向和数目。而且箭头
(2)双线桥式:
特点:明确表示氧化或还原时元素本身得失电子变化情况。箭头不表示电子转移方向。而且箭头都是由反应物指向生成物,所以在线桥上一定要注明“得”或“失”。

七、物质氧化性(还原性)相对强弱判断:
(1)可依据若干反应条件的差异判断:
条件越容易,反应速率越快,氧化性(还原性)越强,而不是以得失电子数多少。
例:判断反应中氧化剂的强弱。
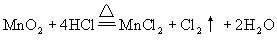
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
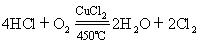
氧化能力:KMnO4>MnO2>O2
(2)可依据金属活动顺序表判断:排位越后的金属,其原子的还原性越弱;而金属阳离子的氧化性越强。(但是氧化性Fe3+>Cu2+) ※(3)可依据元素在同期表的位置判断:
同周期(适用于二、三周期):
从左到右:金属单位的还原性依次减弱,非金属单质的氧化性逐渐加强。
从上到下:金属单质的还原性依次增强,非金属单质的氧化性逐渐减弱。
(4)可依据具体反应进行判断:
理论根据:氧化剂1+还原剂1=氧化剂2(氧化产物)+还原剂2(还原产物)。
氧化能力:氧化剂1>氧化剂2(氧化产物)。
还原能力:还原剂1>还原剂2(还原产物)。
例:判断下列反应中氧化性强弱。
①I2+SO2+2H2O=2HI+H2SO4;
②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+2HCl+I2。

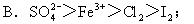
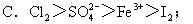
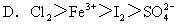
氧化性:D
※(5)依据电极反应判断:
在电解池中阴极上哪种金属的阳离子先析出(被还原)则氧化性越强,而由这种金属单质的还原性越弱,其金属活泼性越弱。
※例:A、B、C是三种金属,根据下列①②实验确定它们还原性强弱顺序:①将A与B浸在稀H2SO4中用导线连接,A上有气体逸出,B逐渐溶
解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。
A.A>B>C; B.B>A>C;
C.B>C>A; D.C>A>B
选:B
(6)依据元素化合价判断:
对同一元素而言,化合价越高,氧化性越强。如:Fe3+>Fe2+;Cu2+>Cu+,(但有例外如氧化性:HClO>HClO3>HClO4)。
物质氧化性、还原性强弱比较
物质氧化性、还原性强弱的比较,实质上是物质得失电子难易程度的比较。即物质越易夺得电子,则其氧化性越强,越难夺得电子则其氧化性越弱;反之,物质越易失去电子,则其还原性越强,越难失去电子,则其还原性越弱。
一、利用化合价,比较物质氧化性、还原性强弱
由同种元素形成的不同价态物质的氧化性和还原性的强弱规律是:元素的最高价态只具有氧化性,元素的最低价态只具有还原性,元素的中间价态既有氧化性又有还原性。
例1.对铁元素组成的物质而言:
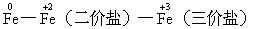
氧化性:Fe<二价铁盐<三价铁盐
还原性:Fe>二价铁盐>三价铁盐
二、利用元素活泼性的不同,比较物质氧化性、还原性的强弱
1.对金属而言,金属越活泼(金属性越强),其单质的还原性越强,其金属阳离子的氧化性越弱。
例2.对金属活动性顺序表而言:
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
活泼性(金属性)————→减弱
其单质还原性:K>Ca>Na>Mg>Al>?Hg>Ag>Pt>Au
其离子氧化性:K+<Ca2+<Na+<Mg2+<Al3+<?<Hg2+<Ag+<Pt2+<Au+ 例3.对同主族的金属元素,从上到下活泼性依次增强。如对ⅡA族金属元素:
Be Mg Ca Sr Ba
活泼性(金属性)————→增强
其单质还原性:
Be<Mg<Ca<Sr<Ba
其阳离子氧化性:
Be2+>Mg2+>Ca2+>Sr2+>Ba2+
例4.对同周期金属而言,从左到右其金属活泼性(金属性)依次减弱。如对第3周期金属而言:
Na Mg Al
活泼性(金属性)————→减弱
其单质还原性:Na>Mg>Al
其阳离子氧化性:Na+<Mg2+<Al3+
2.对非金属而言,其非金属越活泼(非金属性越强),其非金属单质的氧化性越强,其阴离子的还原性越弱。
例5.对一般的非金属活动性顺序而言:
F Cl Br I S
活泼性(非金属性)————→减弱
其单质氧化性:F2>Cl2>Br2>I2>S
其阴离子还原性:
F-<Cl-<Br-<I-<S2-
例6.对同主族的非金属而言,从上到下非金属的活泼性依次减弱。如对ⅦA族元素而言有:
F Cl Br I
活泼性(非金属性)————→减弱
其单质氧化性:F2>Cl2>Br2>I2
其阴离子还原性:F-<Cl-<Br-<I-
例7.对同周期的非金属元素而言,其活泼性从左到右依次增强。如对第3周期非金属而言:
Si P S Cl
活泼性(非金属性)————→增强
其单质氧化性:Si<P<S<Cl2
其阴离子还原性:Si4->P3->S2->Cl-
三、利用氧化还原反应比较物质的氧化性、还原性的强弱
1.对一般的氧化还原反应,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
例8.
FeCl3+Cu——→CuCl2+FeCl2
氧化剂 还原剂 氧化产物 还原产物
氧化性比较:Fe3+>Cu2+
还原性比较:Cu>Fe2+
例9.
FeCl2+Cl2——→FeCl3
还原剂 氧化剂 氧化产物,还原产物
氧化性比较:Cl2>Fe3+
还原性比较:Fe2+>Cl-
综合例8和例9有:
其氧化性比较:Cl2>Fe3+>Cu2+
其还原性比较:Cu>Fe2+>Cl-
2.对原电池反应而言,均有:
还原性比较:负极材料>正极材料;
氧化性比较:负极失去电子形成的阳离子<正极上得到电子的阳离子(或氧化剂)。
例10.用导线连接的铜锌二极,插入到CuSO4溶液中,可形成原电池。
负极(Zn):Zn——2e=Zn2+(氧化)
正极(Cu):Cu2++2e=Cu(还原)
氧化性比较:Cu2+>Zn2+
还原性比较:Zn>Cu
例11.Fe-C合金在中性溶液中存在时,Fe易发生吸氧腐蚀,本质上属原电池反应。
负极(Fe):Fe-2e=Fe2+(氧化)
正极(C):2H2O+O2+4e=4OH-(还原)
氧化性比较:Fe2+<O2
还原性比较:Fe>C
例12.Fe-Cu合金在酸性较强的介质中铁先被腐蚀,此为析氢腐蚀,本质上也属原电池反应。
负极(Fe):Fe-2e=Fe2+(氧化)
正极(Cu):2H++2e=H2↑(还原)
氧化性比较:H+>Fe2+
还原性比较:Fe>Cu
3.对电解反应而言,同一电解质溶液中,电解时,在阳极越易放电(失电子)的阴离子,其还原性越强;阴极上越易放电(得到电子)的阳离子,其氧化性越强。
如在一般浓度的电解质混合溶液中,在阳极的各离子放电顺序一般有:
S2->I->Br->Cl->OH->F-
则其还原性比较:
S2->I->Br->Cl->OH->F-
在阴极的各离子放电顺序:
Au+>Pt2+>Ag+>Hg2+>Cu2+>H+>?
则其氧化性比较:
Au+>Pt2+>Ag+>Hg2+>Cu2+>H+>?
四、用同一起点反应进行的难易程度来比较物质氧化性、还原性的强弱
1.与同一还原剂的反应越易进行,其氧化剂的氧化性越强(说明越易夺得电子)。
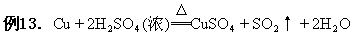
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
显然,从反应的条件可以看出与同一还原剂铜反应时,浓硝酸比浓硫酸易于发生。
氧化剂氧化性比较:浓硝酸>浓硫酸
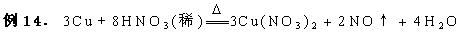
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
从反应条件可看出,与同一还原剂Cu反应时,浓HNO3比稀HNO3易于发生。
氧化剂氧化性比较:浓HNO3>稀HNO3
2.与同一氧化剂的反应越易进行,其还原剂的还原性越强(说明越易失去电子)。
例15.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
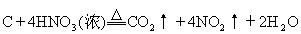
从与同一氧化剂浓HNO3反应的条件可以看出,C与浓HNO3的反应比
Cu难以发生。
还原剂还原性比较:Cu>C
以上比较规律,仅就中学知识而言。
以上比较方法,既帮助学生解决了有关物质氧化性、还原性强弱的比较问题,也使学生从不同的角度理解了物质氧化性、还原性强弱的本质,提高了综合运用知识的能力。
第二篇:氧化还原反应知识点归纳
一、氧化还原反应知识点(一课时)
考纲解读 : 1.熟记常见元素的化合价以及化合物中各元素化合价的计算方法。
2.掌握氧化反应和还原反应、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物的判断方法和各概念之间的关系。命题多以选择题的形式出现。
3.了解常见的氧化还原反应类型.
一、熟记常见元素的化合价以及化合物中各元素化合价的计算方法。
1. 化合价口诀:一价氢钾钠铵银,二价铜钙钡镁锌,亚铁正二铁正三,常用还有铝正三,负一氟氯氢氧根,还有一个硝酸根,负二硫酸碳酸根,氧硫负二记得深!
2. 在化合物中,若无特别说明则氢元素显+1、氧元素显—2.但是在NaH中H显—1,在H2O2和Na2O2氧元素显—1。
3.在一些不常见的化合物中按照化合物化合价代数和为0计算。K2Cr207设Cr元素化合价为X,则(+1)*2+X*2+(—2)*7=0 X=+6
4. 原子团中某元素化合价的计算方法。如 X2072—离子。设X化合价为a,则2a+(—2)*7=—2,则X=+6
二、氧化还原反应概念之间的关系(重点)
氧化还原反应中氧化剂和还原剂、氧化产物和还原产物之间存在如下关系:
 例如:氧化还原反应:CuO + H2 = Cu + H2O 可以这样解析:
例如:氧化还原反应:CuO + H2 = Cu + H2O 可以这样解析:
Cu0→Cu :氧化铜变成单指铜,铜元素化合价从+2降低到0, Cu0为氧化剂,铜元素被还原,氧化铜或铜元素发生还原反应,Cu0生成还原产物Cu。
H2→H2O: 氢气变成水,氢元素化合价从0升高到+1,H2为还原剂,氢元素被氧化,氢气或氢元素发生氧化反应,H2生成氧化产物H2O。
其它氧化还原反应方程式的分析方法与上叙分析方法一样。
三、氧化还原反应类型:
1.一般的氧化还原反应:指氧化剂和还原剂分别属于不同物质的氧化还原反应。
如 :MnO2+4HCl(浓) == MnCl2+Cl2↑+2H2O(氧化剂:MnO2 还原剂:HCl)
2.自身氧化还原反应:指氧化剂和还原剂属于同一种物质的氧化还原反应。如:2KClO3  2KCl + 3O2↑(氧化剂和还原剂都是KClO3 ,氧元素和氯元素化合价发生变化)
2KCl + 3O2↑(氧化剂和还原剂都是KClO3 ,氧元素和氯元素化合价发生变化)
3.歧化反应:指发生在同一物质同一元素之间的氧化还原反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。如 Cl2+2NaOH=NaCl+NaClO+H2O(氯元素的化合价从0分别变成+1和-1,氯气既是氧化剂又是还原剂)
4.归中反应:指含不同价态同种元素的物质问发生氧化还原反应。其反应规律是:反应物中,该元素一部分价态升高,一部分价态降低,该元素价态的变化一定遵循“高价+低价

→中间价”,而不会出现交错现象。如:KClO3+6HCl==KCl+3Cl2+3H2O ;对于归中反应,
可通过分析参加氧化还原反应的元素的来源,从而确定氧化产物、还原产物的物质的量之比。与氧化还原反应的概念有关的练习题。
1.下列化学反应不属于氧化还原反应的是( )
A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2O B、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2O
C、SnCl4 + 2H2O = SnO2 + 4HCl D、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl
2. 下列反应中,水作为还原剂的是( )
A、Cl2 + H2O = HCl + HClO B、CaO+ H2O = Ca(OH)2
C、2F2 + 2H2O = 4HF + O2? D、2Na + 4H2O = 2NaOH + H2?
3.P单质在下列反应中4P+3KOH+3H2O=3KH2PO2+PH3的变化是( )
A.被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原
4. 下列变化过程属于还原反应的是( )
A.HCl→MgCl2 B.Na→Na+ C.CO→CO2 D. Fe3+→Fe
5. 下列变化需要加入氧化剂的是( )
A. S2-→HS- B. HCO3-→CO2 C. 2 Cl-→Cl2 D. Cu2+→Cu
6. 在H2SO3+2 H2S=3 H2O+3S↓反应中,被氧化与被还原元素的质量比为( )
A.1:1 B.2:1 C.1:2 D.3:2
7.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1:1
8. 反应2KMnO4+16HCl 2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 ,还原剂是 ,若生成71gCl2,被氧化的HCl是 g。
2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 ,还原剂是 ,若生成71gCl2,被氧化的HCl是 g。
