氧化还原反应
一、氧化还原反应的几组概念
1、氧化还原反应与非氧化还原反应
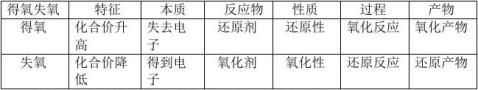
氧化还原反应:有化合价改变或者有电子得失的反应。
非氧化还原反应:没有化合价改变或者没有电子得失的反应。 例如:2AgNO3 △ 2Ag+2NO2↑+O2↑,是氧化还原反应。
2MgO是氧化还原反应的化合反应。 2Mg+O2点燃
CaO+H2O===Ca(OH)2是非氧化还原反应的化合反应。
NH4HCO3
CaCO3 △ NH3↑+CO2↑+H2O是氧化还原反应的分解反应。 高温 CaO+CO2↑是非氧化还原反应的分解反应。
BaCl2+H2SO4===BaSO4↓+2HCl是非氧化还原反应的复分解反应。 Zn+CuSO4===ZnSO4+Cu是氧化还原反应的置换反应。
结论:置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应,
化合反应可能是氧化还原反应,分解反应可能是氧化还原反应。
2、氧化剂与还原剂
氧化剂:在反应中得到电子的反应物。即:能使对方元素化合价升高的反应物。
还原剂:在反应中得到电子的反应物。即:能使对方元素化合价降低的反应物。
常见的氧化剂:Cl2、O2、Fe2O3、NO2、浓H2SO4、HNO3、HClO、FeCl3、KMnO4
常见的还原剂:Zn、C、H2、CO、SO2、H2S、HI、Fe(OH)2、FeCl2、Na2SO3、KI
3、氧化性与还原性
氧化性:反应物得到电子的性质。即:使对方元素化合价升高的性质。 还原性:反应物失去电子的性质。即:使对方元素化合价降低的性质。 规律:一般来说元素处在最高价的反应物只具有氧化性,元素处在最低价的
反应物只有还原性,元素处在中间价的反应物既具有氧化性又具有还原性。
4、氧化反应与还原反应
氧化反应:反应物失去电子的反应。
还原反应:反应物得到电子的反应。
一个氧化还原反应可以拆开为一个氧化反应和一个还原反应,这是电极反应书写的依据。
反之,一个氧化反应和一个还原反应可以合并成一个氧化还原反应。一个放热的氧化还原反应理论上可以设计成原电池。
例如:铁与氯化铁溶液反应:Fe+2FeCl3===3FeCl2
氧化反应:Fe-2e-===Fe2+ 还原反应:Fe3++e-===Fe2+
5、氧化产物和还原产物
氧化产物:失去电子后生成的产物。即:发生氧化反应生成的产物。 还原产物:得到电子后生成的产物。即:发生还原反应生成的产物。
二、学习方法
1、列举法
金属与盐溶液反应的非置换反应的氧化还原反应:Cu+2FCl3===CuCl2+2FeCl2
非金属与盐溶液反应的非置换反应的氧化还原反应:2FeCl2+Cl2===2FeCl3
还原剂具有还原性被氧化生成氧化产物。
4、针对具体反应练习五句话表达法:是不是氧化还原反应,谁是氧化剂谁是还原剂,谁具有氧化性谁具有还原性,谁发生氧化反应谁发生还原反应,谁是氧化产物谁是还原产物。
4NH3+5O2===4NO+6H2O
4FeS2+11O2 ===2Fe2O3+8SO2
2Na2O2+2H2O ===4NaOH+O2 ↑
Cu2S+O2 === 2Cu+SO2
Cl2+2NaOH===NaCl+NaClO+H2O
3S+6KOH===2K2S+K2SO3+3H2O
KClO3+6HCl===KCl+3Cl2↑+3H2O
2K2S+K2SO3+3H2SO4===3S↓+3K2SO4+3H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
3Cu2S+22HNO3===6Cu(NO3)2+10NO↑+3H2SO4+8H2O
四、强化练习
1、下列类型的反应中,一定发生电子转移的是( C )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
2、钢铁生锈过程发生如下反应:①2Fe+O2+2H2O===2Fe(OH)2
②4Fe(OH)2+O2+2H2O===4Fe(OH)3 ③2Fe(OH)3===Fe2O3+3H2O 下列说法正确的是( A )
A、反应①、②中电子转移数目相等
B、反应①中氧化剂是氧气和水
C、与铜质水龙头连接的钢质水管不易发生腐蚀
D、钢铁在潮湿的空气中不易发生电化学腐蚀
3、在下列变化:①大气固氮;②硝酸银分解;③实验室制取氨气中,按氮元素被氧化、被还原、既不被还原又不被氧化的顺序排列,正确的是( A )
A、①②③ B、②①③ C、③②① D、③①②
4、在2Na2O2+2H2O===4NaOH+O2↑的反应中,下列说法不正确的是( C )
A、过氧化钠既是氧化剂又是还原剂 B、水既不是氧化剂又不是还原剂
C、氢氧化钠是还原产物 D、氧气是氧化产物
5、在下列变化中,需要加入合适的氧化剂才能实现的是( D )
A、HCl→H2 B、CO2→CO C、Fe2O3→Fe D、Br-→Br2
6、火法炼铜过程中发生如下反应:Cu2S+O2 ===2Cu+SO2 。下列说法正确的是(C)
A、Cu2S是还原剂,O2是氧化剂
B、铜是还原产物,二氧化硫是氧化产物
C、1molCu2S和氧气反应生成2molCu,转移电子的物质的量为6mol
D、反应消耗3molCu2S时,被氧气氧化的S的物质的量为3mol
7、已知:Cl2+2NaOH===NaCl+NaClO+H2O,针对该反应,下列说法正确的是(C)
A、氯气是氧化剂,氢氧化钠是还原剂
B、氯气发生还原反应,氢氧化钠发生还原反应
C、氯化钠是还原产物,次氯酸钠是氧化产物
D、氯气具有氧化性,氢氧化钠具有还原性
一、氧化还原反应特征
1.下列关于氧化还原反应的叙述,正确的是 ( )
A.失去电子的反应是还原反应 B.在氧化还原反应中不一定所有元素的化合价都发生变化 C.作氧化剂的物质不能是还原剂 D.发生还原反应的元素对应产物是氧化产物
2.下列反应中,不是氧化还原反应的是
点燃( ) 电解 ①H2+Cl2???2HCl ②Na2CO3+2HCl==2NaCl+H2O+CO2↑ ③2H2O???2H2↑+O2↑
④CuO+2HNO3==Cu(NO3)2+H2O ⑤2HgO???2Hg+O2↑
A. ②④ B. ①③ C. ①②③ D. ④⑤
3.同物质中同种元素同一价态部分被氧化,部分被还原的氧化还原反应的是 ( )
A.3Br2+6KOH △
△KBrO3+5KBr+3H2O B.NH4NO3 △ N2O+2H2O
C.2H2S+SO2=3S+2H2O D.H2S+H2SO4=2H2O+S↓+SO2
4.3Cl2+8NH3=6NH4Cl+N2反应中,被氧化的NH3与未被氧化的NH3的分子数之比为( )
A.1∶6 B.3∶1 C.1∶3 D.6∶1
5.已知反应①SO3+H2O=H2SO4; ②Cl2+H2O=HCl+HClO; ③2F2+2H2O=4HF+O2; ④2Na+2H2O=2NaOH+H2↑,根据上述反应,试回答: ⑴上述反应中不属于氧化还原反应的有 。 ⑵H2O被氧化的是 ,被还原的是 ⑶是氧化还原反应,但水既不被氧化,又不被还原的是 。
化合价
二、化合价
1. 在一定条件下,RO3和I可发生反应:RO3+6I+6H=R+3I2+3H2O,则RO3中R元素的化合价是 。
2. 12个Na2SO3恰好与4个K2Cr2O7完全反应,则元素Cr在被还原的产物中的化合价为_____价。
3、某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为
A. +1 B. +2 C. +3 D. +4 ( ) n--n--+-n-
三、氧化剂、还原剂;氧化产物,还原产物
1、下列变化需要加入氧化剂的是( )
A S→HS B.HCO3→CO2 C.2 Cl→Cl2 D. Cu→Cu
2.需要加入适当的氧化剂才能实现的是反应是 ( ) 2----2+
A. PCl3→PCl5 B. MnO4-→Mn2+ C. SO2→HSO3- D. S2O32-→S4O62-
3、K2Cr2O7是一种橙红色且具有强氧化性的化合物,当它被还原成三价铬时,颜色有明显变化。据此,当交通警察发现汽车行驶反常时,就上前拦车,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的装置吹气。若发现硅胶变色达到一定程度,即证明司机是________________,这是因为K2Cr2O7跟___________(写化学名称)发生了反应。反应中,氧化剂是___________,还原剂是___________。
4.硫酸铵在强热条件下分解,生成氨气、二氧化硫、氮气和水,则在该反应中氧化产物
和还原产物的分子个数之比是 。
5、在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质颠,其化学方程
式是:2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O
⑴反应中 元素被氧化, 是氧化剂。
⑵用“双线桥”标出电子转移的方向和数目。
⑶反应产物中,氧化产物与还原产物的物质的量之比为 。
四、氧化还原反应中的电子得失守恒
1、反应Mn2++PbO2→MnO4-+Pb2+总反应式配平后氧化剂的化学计量系数是
( )
A. 8 B. 5 C. 10 D. 3
2.用下列方法:①KMnO4受热分解 ②KClO3受热分解(用MnO2作催化剂)
③2H2O2???2H2O+O2↑ ④2Na2O2+2H2O==4NaOH+O2↑,若要制得相同质量的氧气,
上述四种方法中所转移的电子数目之比是
A. 3:2:1:4 B. 1:1:1:1 C. 1:2:1:2 D. 2:2:1:1 ( ) MnO2
3、已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
, 如果分别用等物质的量
的这些物质氧化足量的KI,得到I2最多的是( )
A.Fe3+ B.

C.Cl2 D.HNO2
五、氧化性、还原性强弱的判断
1、在相同条件下,下列所给的离子中,哪一种氧化性最强 ( )
A.Ag+ B.Mg2+ C.Fe2+ D.Cu 2+
2、已知反应:①2A-+C2==2C-+A2 ②2C-+B2==2B-+C2 ③2D-+C2==2C-+D2,判断下列说
法正确的是
A. 氧化性:A2>B2>C2>D2 B. D-不能被B2氧化
C. 氧化能力:B2>C2>D2 D. 还原性:A->B- ( )
3、单质X和Y相互反应生成X2+Y2-。现有下列叙述:①X被氧化、②X是氧化剂、③X具有氧化性、④Y2-是还原产物、⑤Y2-具有还原性、⑥X2+具有氧化性、⑦Y的氧化性比X2+的氧化性强,其中正确的是 ( )
A. ①②③④ B. ①④⑤⑥⑦ C. ②③④ D. ①③④⑤
4.下列叙述正确的是 ( ) A含最高价元素的化合物,一定具有强氧化性 B.阳离子只有氧化性,阴离子只有还原性C.失电子多的还原剂,还原性强 D.得电子能力强的物质,氧化性强
5、今有下列三个氧化还原反应:
①2FeCl3+2KI==2FeCl2+2KCl+I2 ②2FeCl2+Cl2==2FeCl3
③2KMnO4+16HCl==2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是
A. Cl2 B. KMnO4 C. FeCl3 D. HCl ( )
6.已知下列反应均按正方向进行 2FeCl3+SnCl2=2FeCl2+SnCl4
2KMnO4+10FeSO4+8H2SO4=2MnSO4 +5Fe2(SO4)3 +K2SO4+8H2O 在上述这些物质中,最强的氧化剂是__________ ,最强的还原剂是_________。
六、氧化还原反应综合应用
1、20xx年初春,“SARS病毒”在我国一些地区肆虐,它有极强的传染性,给我国的正常生活和经济建设带来很大的影响,全国人民万众一心,众志诚城,科学防控,在预防过程中,有一种消毒液(H2O2),据此材料,对过氧化氢的性质做出判断,并回答1-3小题。
(1)从H2O2的分子组成及结构上分析,其 ( )
A.只具有氧化性 B.只具有还原性
C.既有氧化性也有还原性 D.既无氧化性也无还原性
(2)过氧化氢分解可生成H2O和O2,那么每生成n个氧气,则电子转移数为 ( )
A.n个 B.2n个 C.3n个 D.4n个
(3)过氧化氢在消毒杀菌过程中,主要利用了其 ( )
A.强氧化性 B.强还原性 C.强酸性 D.中性
2、下列微粒:Fe、Cl-、H+、F2,其中能得到电子的微粒有 ,该元素的化合价 ,表现出 性,是 剂,具有还原性的微粒是 ,它们在反应中 (填得或失)电子,发生 反应(填氧化或还原),其化合价 。
3、在KMnO4+H2C2O4+H2SO4 → K2SO4+MnSO4+CO2+H2O的反应中,若消耗1/5摩尔KMnO4,则应消耗H2C2O4为( )
A. 1/5mol B. 2/5mol C. 1/2mol D. 2mol 4、化工厂常用氨水检验管道是否漏氯气,其反应式为3Cl2+8NH3==6NH4Cl+N2,当有160.5gNH4Cl产生时,被氧化的氨气是多少克?
5、三氟化溴溶于水可发生如下反应:
??HBrO3+Br2+HF+O2↑ BrF3+H2O?
(1)其中发生自身氧化还原反应的物质是____________;
(2)当有5.0 mol水参加反应时,由水还原的BrF3的物质的量为____________,由BrF3还原的BrF3的物质的量为____________;
(3)当有5.0 mol水作还原剂参加化学反应时,由水还原的BrF3的物质的量为____________,由BrF3还原的BrF3的物质的量为____________;
(4)当有5.0 mol水未参加氧化还原反应时,由水还原的BrF3的物质的量为____________,由BrF3还原的BrF3的物质的量为____________。
参考答案:
一、1、B 2、A 3、A 4、C 5、(1)①;(2)③④;(3)②
二、1、+5 2、+3 3、C
三、1、C 2、A 3、酒后驾车;乙醇;K2Cr2O7;乙醇 4、1:3 5、(1)S;NaIO3(2)略(3)5:1
四、1、B 2、D 3、B
五、1、A 2、C D 3、B 4、D 5、C 6、KMnO4 ;SnCl2 六、1、(1)C(2)B(3)A; 2、H、F2 ;降低;氧化;氧化剂;Fe、Cl升高
3、C 4、17g
5、解析 (1)标出化合价可得答案。 +- ;失;氧化、
(2)配平后的化学方程式为:
3BrF3+5H2O====HBrO3+Br2+9HF↑+O2↑
当有5.0 mol 水参加反应时,只有2.0 mol 水作还原剂,发生氧化还原反应的水与BrF3的关系为:
由反应方程式可知,5.0 mol 水参加反应,共有2.0 mol BrF3被还原,则题设条件下被BrF3还原的BrF3的物质的量为:2.0 mol-1.3 mol=0.7 mol。
(3)由上分析:
被BrF3还原的BrF3的物质的量等于被还原的BrF3的总物质的量减去3.3 mol,即:5.0 mol-3.3 mol=1.7 mol。
[将(2)的结果放大2.5倍,得答案3.3 mol 和1.8 mol亦可]
(4)参加氧化还原反应的水与未参加氧化还原反应水的物质的量之比为2∶
3。据此和(1)可得答案。
答案:(1)BrF3 (2)1.3 mol 0.67 mol
(4)2.2 mol 1.1 mol
(3)3.3 mol 1.7 mol(或1.8 mol)
