一、氧化还原反应知识点(一课时)
考纲解读 : 1.熟记常见元素的化合价以及化合物中各元素化合价的计算方法。
2.掌握氧化反应和还原反应、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物的判断方法和各概念之间的关系。命题多以选择题的形式出现。
3.了解常见的氧化还原反应类型.
一、熟记常见元素的化合价以及化合物中各元素化合价的计算方法。
1. 化合价口诀:一价氢钾钠铵银,二价铜钙钡镁锌,亚铁正二铁正三,常用还有铝正三,负一氟氯氢氧根,还有一个硝酸根,负二硫酸碳酸根,氧硫负二记得深!
2. 在化合物中,若无特别说明则氢元素显+1、氧元素显—2.但是在NaH中H显—1,在H2O2和Na2O2氧元素显—1。
3.在一些不常见的化合物中按照化合物化合价代数和为0计算。K2Cr207设Cr元素化合价为X,则(+1)*2+X*2+(—2)*7=0 X=+6
4. 原子团中某元素化合价的计算方法。如 X2072—离子。设X化合价为a,则2a+(—2)*7=—2,则X=+6
二、氧化还原反应概念之间的关系(重点)
氧化还原反应中氧化剂和还原剂、氧化产物和还原产物之间存在如下关系:
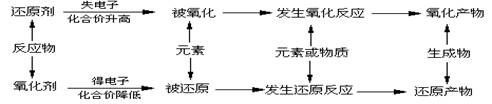 例如:氧化还原反应:CuO + H2 = Cu + H2O 可以这样解析:
例如:氧化还原反应:CuO + H2 = Cu + H2O 可以这样解析:
Cu0→Cu :氧化铜变成单指铜,铜元素化合价从+2降低到0, Cu0为氧化剂,铜元素被还原,氧化铜或铜元素发生还原反应,Cu0生成还原产物Cu。
H2→H2O: 氢气变成水,氢元素化合价从0升高到+1,H2为还原剂,氢元素被氧化,氢气或氢元素发生氧化反应,H2生成氧化产物H2O。
其它氧化还原反应方程式的分析方法与上叙分析方法一样。
三、氧化还原反应类型:
1.一般的氧化还原反应:指氧化剂和还原剂分别属于不同物质的氧化还原反应。
如 :MnO2+4HCl(浓) == MnCl2+Cl2↑+2H2O(氧化剂:MnO2 还原剂:HCl)
2.自身氧化还原反应:指氧化剂和还原剂属于同一种物质的氧化还原反应。如:2KClO3  2KCl + 3O2↑(氧化剂和还原剂都是KClO3 ,氧元素和氯元素化合价发生变化)
2KCl + 3O2↑(氧化剂和还原剂都是KClO3 ,氧元素和氯元素化合价发生变化)
3.歧化反应:指发生在同一物质同一元素之间的氧化还原反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。如 Cl2+2NaOH=NaCl+NaClO+H2O(氯元素的化合价从0分别变成+1和-1,氯气既是氧化剂又是还原剂)
4.归中反应:指含不同价态同种元素的物质问发生氧化还原反应。其反应规律是:反应物中,该元素一部分价态升高,一部分价态降低,该元素价态的变化一定遵循“高价+低价
→中间价”,而不会出现交错现象。如:KClO3+6HCl==KCl+3Cl2+3H2O ;对于归中反应,
可通过分析参加氧化还原反应的元素的来源,从而确定氧化产物、还原产物的物质的量之比。与氧化还原反应的概念有关的练习题。
1.下列化学反应不属于氧化还原反应的是( )
A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2O B、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2O
C、SnCl4 + 2H2O = SnO2 + 4HCl D、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl
2. 下列反应中,水作为还原剂的是( )
A、Cl2 + H2O = HCl + HClO B、CaO+ H2O = Ca(OH)2
C、2F2 + 2H2O = 4HF + O2? D、2Na + 4H2O = 2NaOH + H2?
3.P单质在下列反应中4P+3KOH+3H2O=3KH2PO2+PH3的变化是( )
A.被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原
4. 下列变化过程属于还原反应的是( )
A.HCl→MgCl2 B.Na→Na+ C.CO→CO2 D. Fe3+→Fe
5. 下列变化需要加入氧化剂的是( )
A. S2-→HS- B. HCO3-→CO2 C. 2 Cl-→Cl2 D. Cu2+→Cu
6. 在H2SO3+2 H2S=3 H2O+3S↓反应中,被氧化与被还原元素的质量比为( )
A.1:1 B.2:1 C.1:2 D.3:2
7.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1:1
8. 反应2KMnO4+16HCl 2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 ,还原剂是 ,若生成71gCl2,被氧化的HCl是 g。
2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 ,还原剂是 ,若生成71gCl2,被氧化的HCl是 g。
第二篇:高一化学氧化还原反应知识点
高一化学氧化还原反应知识点
化学反应的分类:
1、根据反应物和生成物的类别及反应前后物质种类的多少,化学反应分为四种基本类型,并分析下列十个反应各属于哪种类型。
⑴化合反应:A+B=AB ( )
⑵分解反应:AB=A+B ( )
⑶置换反应:A+BC=AC+B ( )
⑷复分解反应:AB+CD=AD+BC ( )
化学反应:
①2KClO3 2KCl + 3O2↑ ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
2KCl + 3O2↑ ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③Zn+H2SO4=ZnSO4+H2↑ ④2H2+O2 2H2O
2H2O
⑤CaCO3 CaO+CO2↑ ⑥Ba(OH)2+H2SO4=BaSO4↓+2H2O
CaO+CO2↑ ⑥Ba(OH)2+H2SO4=BaSO4↓+2H2O
⑦2Na+Cl2 2NaCl ⑧3Fe2O3+8Al
2NaCl ⑧3Fe2O3+8Al 9Fe+4Al2O3
9Fe+4Al2O3
⑨Na2CO3+2HCl=2NaCl+CO2↑+H2O ⑩NH3+HCl=NH4Cl
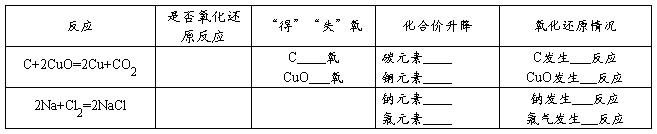
2、根据反应中物质是否得到氧或失去氧,分为氧化反应和还原反应。
⑴氧化反应:物质 氧的反应,比如:C+O2 CO2
CO2
⑵还原反应:物质 氧的反应,比如:CuO+H2 Cu+H2O
Cu+H2O
课堂研究
【讨论1】对于反应Fe2O3+3CO 2Fe+3CO2, 失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是 (填“先后”或“同时”)发生的。
2Fe+3CO2, 失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是 (填“先后”或“同时”)发生的。
氧化还原反应的第一层定义:凡是物质有 氧和 氧的反应。
【讨论2】对于反应Fe2O3+3CO 2Fe+3CO2,讨论该氧化还原反应中元素的化合价在反应前后的变化关系: 元素的化合价升高, 元素的化合价降低。
2Fe+3CO2,讨论该氧化还原反应中元素的化合价在反应前后的变化关系: 元素的化合价升高, 元素的化合价降低。
[思考]①是否只有得氧失氧的反应才是氧化还原反应?
②如果一个反应中没有氧的得失,是否一定不是氧化还原反应呢?
氧化还原反应的第二层定义:氧化还原反应是物质有化合价 和 的反应。
氧化反应:物质所含元素化合价 的反应;还原反应:物质所含元素化合价
的反应。判断一个反应是否为氧化还原反应的依据: 。
例题1:下列反应属于氧化还原反应的是 ( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑ B、CaCO3高温CaO+CO2↑
C、Na2O+H2O=2NaOH D、Mg+2HCl=MgCl2+H2↑
例题2:在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
【讨论3】化学反应的本质是原子间的重新组合。那么氧化还原反应的本质又是什么呢?在反应中为什么会有元素化合价的升降呢?
⑴钠与氯气的反应:2Na+Cl2=2NaCl
Na:化合价 , (得或失)电子,被 ,发生 反应;
Cl:化合价 , (得或失)电子,被 ,发生 反应。
在这个反应中, 是还原剂, 是氧化剂。
⑵氢气与氯气的反应:H2+Cl2=2HCl
H:化合价 ,电子对 ,被 ,发生 反应;
Cl:化合价 ,电子对 ,被 ,发生 反应。
在这个反应中, 是还原剂, 是氧化剂。
氧化还原反应的第三层定义:氧化还原反应是有电子 (得失或 )的反应。
氧化反应表现为被氧化的元素化合价 ,其实质是该元素的原子 (或偏离)电子的过程;还原反应表现为被还原的元素化合价 ,其实质是该元素的原子 (或偏向)电子的过程。氧化还原反应的本质是 。
例题3:下列叙述正确的是 ( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
[思考]请分析四种基本反应类型的反应与氧化还原反应之间的关系,并试着画出它们之间的交叉分类示意图,然后列举一些具体的化学反应加以说明。
【总结】

课后巩固
1.下列反应一定属于氧化还原反应的是 ( )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
2.有关氧化还原反应的叙述正确的是 ( )
A、氧化还原反应的实质是有氧元素的得失
B、氧化还原反应的实质是元素化合价的升降
C、氧化还原反应的实质是电子的转移(得失或偏移)
D、物质所含元素化合价升高的反应是还原反应
3.下列变化中,需加入还原剂的是 ( )
A、SO32-→SO2 B、S2-→S C、CO2→H2CO3 D、CO2→CO
4.下列反应中,不属于氧化还原反应的是 ( )
A、2CO+O2 2CO2 B、CH4+2O2
2CO2 B、CH4+2O2 CO2+2H2O
CO2+2H2O
C、2KClO3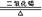 2KCl+3O2↑ D、2Fe(OH)3
2KCl+3O2↑ D、2Fe(OH)3 Fe2O3 +3H2O
Fe2O3 +3H2O
5.对于反应CaH2+2H2O=Ca(OH)2+2H2↑,有以下判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2中的氢元素被还原;⑤此反应中的氧化产物与还原产物的分子个数之比为1:1。上述判断正确的是 ( )
A、①④⑤ B、②③ C、① D、③⑤
6.下列各反应中,水只做氧化剂的是 ( )
A、C+ H2O=CO+ H2 B、2H2O=2 H2↑+ O2↑
C、Na2O + H2O=2NaOH D、CuO + H2 = Cu+ H2O
7.下列反应中,水作为还原剂的是 ( )
A、Cl2 + H2O = HCl + HClO B、2Na2O2 + 2H2O = 4NaOH + O2?
C、2F2 + 2H2O = 4HF + O2? D、2Na + 4H2O = 2NaOH + H2?
8.下列反应中属于氧化还原反应,又是离子反应的是 ( )
A、铁和稀硫酸反应 B、碳和氧化铁高温反应
C、水电解 D、氢氧化亚铁与盐酸反应
9.某元素在化学反应中由化合态变为游离态,则该元素 ( )
A、一定被氧化 B、一定被还原
C、既可能被氧化,也可能被还原 D、以上都不是
10.下列各组物质中,每种物质都既能被氧化又能被还原的是 ( )
A、FeCl2、Cl2、CuSO4 B、H3PO4、HNO2、H2SO4
C、H2S、HCl、H2SO3 D、Na2S、NaClO、NH4HCO3
11.P单质在下列反应中4P+3KOH+3 H2O=3KH2PO2+P H3的变化是 ( )
A、被氧化 B、被还原
C、既被氧化又被还原 D、既未被氧化又未被还原
12.在H2SO3+2 H2S=3 H2O+3S反应中,被氧化与被还原元素的质量比为 ( )
A、1:1 B、2:1 C、1:2 D、3:2
13.黑火药爆炸反应为:S+2KNO3+3C=K2S+3CO2? +N2?。在该反应中,氧化剂是( )
①C ②S ③K2S ④KNO3 ⑤N2
A、①③⑤ B、②④ C、②④⑤ D、③④⑤
14.已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-,②ClO3-+5Cl-+6H+=3Cl2+3H2O,
③2FeCl3+2KI=2FeCl2+2KCl+I2,④2FeCl2+Cl2=2FeCl3。下列各微粒氧化能力由强到弱的顺序正确的是 ( )
A、ClO3->BrO3->Cl2>Fe3+>I2 B、BrO3->Cl2>ClO3->I2>Fe3+
C、BrO3->ClO3->Cl2>Fe3+>I2 D、BrO3->ClO3->Fe3+>Cl2>I2
15.按要求写出有关氧化还原反应的化学方程式,并指出氧化剂和还原剂。
⑴是化合反应,也是氧化还原反应____________________________________________,
氧化剂是 ,还原剂是 。
⑵是分解反应,也是氧化还原反应_____________________________________________,
氧化剂是 ,还原剂是 。
⑶有金属单质Hg生成的的置换反应___________________________________________,
氧化剂是 ,还原剂是 。
⑷不属于四种基本反应类型的氧化还原反应____________________________________,
氧化剂是 ,还原剂是 。
16.分析下列氧化还原反应中化合价的变化关系,用“双桥法”标出电子转移的方向和数目,指出哪种物质是氧化剂,哪种物质是还原剂;哪种元素被氧化,哪种元素被还原。
⑴PbO+CO Pb+CO2 ⑵2AgNO3
Pb+CO2 ⑵2AgNO3 2Ag+2NO2?+O2?
2Ag+2NO2?+O2?
⑶Zn+H2SO4=ZnSO4+H2? ⑷Cl2+H2O=HCl+HClO
17.已知反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O ,若有71克Cl2 生成,
⑴被氧化的HCl 与未被氧化的HCl质量之比?
⑵被氧化的HCl质量?(注:Cl的原子量:35.5)
